
Сибирский Государственный Медицинский Университет
Кафедра химии

Выполнил: студент группы 3705
Фармацевтический факультет
Тырышкин Артем
Проверила: доцент кафедры химии
Дрыгунова Л.А.
г. Томск
2008-2009 Учебный год
Анализ смеси сухих солей.
В исследуемой соли могут находиться ионы:
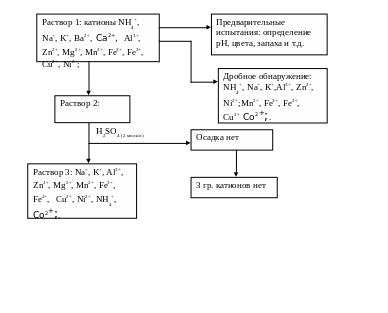
Катионы: NH4+, Na+, K+, Ba2+,Ca2+, Al3+, Zn2+, Mg2+, Mn2+, Fe3+, Cu2+, Co2+, Ni2+;
Анионы: SO42-, S2O32-, CO32-, HPO42-, B4O72-, Cl-, NO3-, CH3COO- ;
1.Визуальное исследование образца:
Исследуемая соль состоит из белых и розовых кристаллов, не имеет запаха, по структуре соль кристаллическая, неоднородная.
Вывод: после визуального исследования я могу предположить, что соль содержит ионы: Co2+
2. Отбор средней пробы:
Средняя проба - это часть анализируемого вещества, отражающая его химический состав. Для проведения отбора средней пробы я поместил соль в фарфоровую ступку, предварительно протерев её спиртом, и проводил измельчение до тех пор, пока не получился мелкий порошок. Затем хорошо измельченную часть исследуемой соли, рассыпал тонким слоем на горизонтальной поверхности в виде квадрата, разделил его на четыре равные части. Соль из противоположных треугольников в квадрате отделил и поместил в пробирку. Снова поместил в ступку часть исходной соли и проделал такую же процедуру еще один раз. Затем подготовленную для анализа среднюю пробу разделил на три части: одну часть буду
использовать для анализа катионов, вторую - для анализа анионов, третью – для предварительных испытаний и проверочных определений.



3. Предварительные испытания:
Окрашивание пламени: немного сухой соли смачиваем каплей раствора HCl (концентрированной) для того, чтобы малолетучие соли перешли в легколетучие хлориды, затем пропитываем вату спиртовым раствором, обмакиваем ее в соли и подносим к пламени спиртовки. Пламя окрашивается в фиолетовый цвет.
Вывод: в исследуемой соли возможно присутствие катионов K+.
Действие кислот и щелочей на сухую соль: к небольшому количеству сухой средней пробы добавляем несколько капель растворов HCl и H2SO4. Выделение каких-либо газов не происходит, нет ни запаха уксусной кислоты, ни запаха аммиака.
Вывод: в исследуемой соли скорее всего отсутствуют анионы: S2O32-, CO32-, CH3COO-; катион NH4+.
Растворение сухого образца и обнаружение катионов.
К небольшому количеству средней пробы добавляю очищенную воду. Немного встряхиваем пробирку. Соль растворилась в воде полностью. pH=6-7. Раствор бесцветен, запах отсутствует. Приступаем к обнаружению катионов:
Дробное обнаружение:
Обнаружение NH4+-ионов: в пробирку вносим 8-10 капель исследуемого раствора и прибавляем к нему 10 капель NaOH (2 моль/л). Затем раствор осторожно нагреваем, не допуская разбрызгивания. Над пробиркой помещаем влажную универсальную лакмусовую бумажку. Она не изменила цвет.
Вывод: в исследуемой соли нет катиона NH4+;
Обнаружение Na+ - ионов: на предметное стекло наносим каплю полученного раствора, немного упариваем до образования кристаллов по краям, рядом помещаем 2 капли пикриновой кислоты и стеклянной палочкой медленно соединяем их с сухим остатком. Затем исследуем предметное стекло под микроскопом. Наличие длинных игольчатых кристаллов не наблюдается.
Вывод: в исследуемой соли нет катионов Na+;
1.3 Обнаружение K+ - ионов: к 2 – 3 каплям исследуемого раствора добавляем 2 капли раствора водород тартрата, происходит выпадение желтого осадка.
2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6](ТВ.) + 2NaCl
Вывод: в исследуемой соли есть катионы K+;
Обнаружение Al3+- ионов: смачиваем фильтровальную бумагу раствором K4[Fe(CN)6], подсушиваем её. Затем на эту бумагу наносим 1-2 капли исследуемого раствора, добавляем каплю воды. Держим бумагу над парами аммиака, затем тонким капилляром обводим пятно ализарином, снова держим над парами аммиака, добавляем уксусной кислоты. Фиолетовая окраска исчезает, красного круга алюминиевого лака не остается.
Вывод: в исследуемой соли нет катиона Al3+;
Обнаружение Zn2+ - ионов: в пробирке смешиваем 5 капель исследуемого раствора и 5 капель раствора кобальт нитрата. Смесь нагреваем и кипятим около минуты. Горячим раствором смачиваем полоску фильтровальной бумаги, высушиваем её и сжигаем в фарфоровом тигле. Образование золы зеленого цвета не наблюдается.
Вывод: в исследуемой соли нет катионов Zn2+;
Обнаружение Mn2+ - ионов: в пробирку помещаем 2-3 капли исследуемого раствора, затем удаляем этот раствор, чтобы избежать избытка ионов Mn2+ . В пробирку прибавляю 2-3 капли HNO3(разб.) и несколько крупинок NaBiO3, при этом раствор окрашивается в малиново-фиолетовый цвет, характерный для MnO4-.
2Mn(NO3)2 + 5 NaBiO3 + 16 HNO3 = 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 + 7H2O
Вывод: в исследуемой соли есть катионы Mn2+;
1.7 Обнаружение Fe3+- ионов: в пробирку помещаем 2-3 капли исследуемого раствора, прибавляем 1 – 2 капли HCl (2 моль/л) и по каплям раствор K4[Fe(CN)6]. Темно – синий осадок не образуется.
Вывод: в исследуемой соли нет катионов Fe3+;
Обнаружение Fe2+- ионов: к исследуемому раствору добавляем калий гексацианоферрат (III), темно-синего осадка комплексного соединения, так называемой «турнбулевой сини» нет.
Вывод: в исследуемой соли нет катионов Fe2+;
Обнаружение Cu2+- ионов: в пробирку вносим 2 – 3 капли исследуемого раствора и прибавляю по каплям раствор аммиака (концентрированный). Раствор не окрашивается в ярко – синий цвет.

Вывод: в исследуемой соли нет катиона Cu2+;
Обнаружение Ni2+ - ионов: в пробирку помещаем 3 - 4 капли исследуемого раствора, добавляем 3 – 4 капли раствора NH4OHконц. и 1 каплю спиртового раствора реактива Чугаева. Окрашивание раствора в розовый цвет не наблюдается, так же не выпадает ярко – красный осадок.
Вывод: в исследуемой соли нет катионов Ni2+;
Обнаружение Со2+- ионов: в пробирку вносят 2-3 капли исследуемого раствора, 1-2 капли CH3COOH и прибавляют 2-3 капли раствора реактива Ильинского. При осторожном нагревании наблюдаю выделение пурпурно-красного осадка.
CoCl3 + 3
Вывод: в исследуемой соли есть катионы Со2+;
Систематический анализ
В исследуемой соли нет 2 гр. катионов, проверим наличие 3 гр.
1. Обнаружение 3 гр. катионов: к раствору добавляю H2SO4, этанол, осадок не выпал.
Вывод: в исследуемой соли нет 3 гр. катионов(Ba2+,Ca2+).
Обнаружение Mg2+- ионов систематическим способом:к исследуемому раствору прибавляем NaOH(2мол/л), получил осадок,к осадку прибавляем NH4CL(сух.), воды, нагреваем, после охлаждения осадок и раствор центрифугируем. К 2 – 3 каплям раствора добавляем 2 капли раствора аммиака и несколько капель NH4CL до растворения выпавшего в начале осадка Mg(OH)2. Затем добавляем 2 – 3 капли 5%-го спиртового раствора 8 – оксихинолина. Образование осадка зеленовато – желтого цвета не образуется.
Вывод: в исследуемой соли нет катионов Mg2+;
Схема анализа катионов:
Анализ сухой соли на анионы:
1. Предварительные выводы: при подкислении раствора не выделяются газы. Соль растворяется в воде.
Вывод: в исследуемой соли скорее всего нет анионов неустойчивых кислот.
Подготовка исследуемого раствора к анализу анионов: часть средней пробы растворяем в воде, помещаем в фарфоровую чашку и добавляем насыщенный раствор Na2CO3 (для удаления катионов тяжелых металлов). Осторожно кипятим содержимое в течении 10 – 15 минут. Осадок и раствор переносим в коническую пробирку и центрифугируем.В осадке получаем:
2CuSO4 + 2CO3- + H2O = (CuOH2)CO3(ТВ) + 2SO42- + CO2(г)
2ALCL3 + 3CO3- + 3 H2O = 2Al(OH)3 + 6CL- + 3 CO2(г)
Вывод: проведя данную операцию мы избавились от «тяжелых» металлов и подготовили раствор для проведения дробного и систематического анализа.
Анализ анионов: схема 2:
Предварительные испытания
Р – р 1: SO42-,
HPO42-,
B4O72-,
Cl--,
NO3-,
CH3COO--
Дробное обнаружение: HPO42-,
B4O72-,
CH3COO--,
SO42-;


Р – р 2: Cl--,
NO3-
,



Р – р 3: NO3-
Обнаружение NO3-

Осадок 3: AgCL

Р – р 4: [Ag(NH3)2]CL

Обнаружение Cl--
