
- •Лекция 1
- •Дисперсные системы
- •Адсорбция ↔ десорбция;
- •Адсорбция на границе раствор – газ
- •Адсорбция на границе твердое тело – газ
- •Теория полимолекулярной адсорбции Поляни
- •Уравнение Фрейндлиха
- •Адсорбция на границе твердое тело – раствор
- •Молекулярная адсорбция из растворов
- •Ионная адсорбция (адсорбция из растворов электролитов)
Лекция 1
Дисперсные системы
Дисперсная система (ДС) – это система, в которой хотя бы одно вещество находится в раздробленном состоянии.
ДС имеет два характерных признака: гетерогенность и дисперсность. Гетерогенность означает, что система состоит как минимум из двух фаз.
Дисперсность означает, что одна из фаз обязательно должна быть раздробленной, ее называют дисперсной фазой. Сплошная среда, в которой раздроблена дисперсная фаза, называется дисперсионной средой.
Фаза считается дисперсной, если вещество раздроблено хотя бы в одном направлении. Если вещество раздроблено только по высоте, образуются пленки (ткани, пластины и т. д.). Если вещество раздроблено и по высоте и по ширине, образуются волокна, нити, капилляры. Наконец, если вещество раздроблено по всем трем направлениям, дисперсная фаза состоит из дискретных частиц.
Характерным свойством ДС является наличие большой межфазной поверхности. В связи с этим определяющими являются свойства поверхности, а не частиц в целом. Характерными являются процессы, протекающие на поверхности, а не внутри фазы.
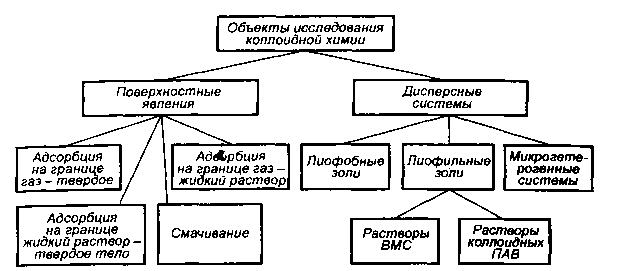
Рис. 1.1. Содержание курса коллоидной химии
Коллоидная химия – это наука о поверхностных явлениях и физико-химических свойствах дисперсных систем (рис. 1.1).
1.2. КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ДС
Для характеристики ДС используются три величины:
1. Поперечный размер частиц – d. [d] = см; м. Для сферических частиц это диаметр сферы, для кубических частиц – ребро куба.
2. Дисперсность (раздробленность) – Д – величина, обратная поперечному размеру частиц:
![]()
3. Удельная поверхность Syд – это межфазная поверхность (S1,2), приходящаяся на единицу объема дисперсной фазы (V) или ее массы (m).
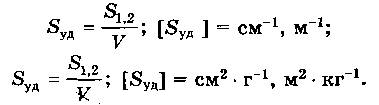
1.3. КЛАССИФИКАЦИЯ ДС
Классификация ДС может быть проведена на основе различных свойств.
Классификация по дисперсности
Зависимость величины удельной поверхности от дисперсности Syд = f(d) графически выражается равносторонней гиперболой (рис. 1.2).
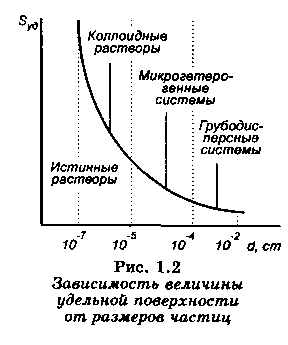
Рис. 1.2. Зависимость величины удельной поверхности от размера частиц
Из графика видно, что с уменьшением поперечных размеров частиц величина удельной поверхности существенно возрастает.
При d < 10-7 см гипербола обрывается, так как частицы уменьшаются до размеров отдельных молекул, и гетерогенная система становится гомогенной, в которой межфазная поверхность отсутствует. По степени дисперсности ДС делятся на:
– грубодисперсные системы, d > 10-3 см;
– микрогетерогенные системы, 10-5 < d < 10-3 см;
– коллоидно-дисперсные системы или коллоидные растворы, 10-7 < d < 10-5 см;
– истинные растворы, d < 10-7 см.
Самую большую удельную поверхность имеют частицы дисперсной фазы в коллоидных растворах.
Классификация по агрегатному состоянию фаз
Классификация по агрегатному состоянию фаз была предложена Вольфгангом Оствальдом. Возможно 9 комбинаций.
Таблица 1.1 – Классификация по агрегатному состоянию фаз
Агрегатное состояние дисперсной фазы |
Агрегатное состояние дисперсионной среды |
Условное обозначение фаза/среда |
Название системы |
Примеры |
г |
г |
г/г |
аэрозоли |
атмосфера Земли |
ж |
г |
ж/г |
туман, слоистые облака |
|
тв |
г |
тв/г |
дымы, пыли, перистые облака |
|
г |
ж |
г/ж |
газовые эмульсии, пены |
газированная вода, мыльная пена, лечебный кислородный коктейль, пивная пена |
ж |
ж |
ж/ж |
эмульсии |
молоко, масло сливочное, маргарин, кремы и т.д. |
тв |
ж |
тв/ж |
лиозоли, суспензии |
лиофобные коллоидные растворы, суспензии, пасты, краски и т. д. |
г |
тв |
г/тв |
твердые пены |
пемза, твердые пены, пенопласт, активированный уголь, пенобетон, хлеб, пористые тела в газе и т. д. |
ж |
тв |
ж/тв |
твердые эмульсии |
вода в парафине, природные минералы с жидкими включениями, пористые тела в жидкости |
тв |
тв |
тв/тв |
твердые золи |
сталь, чугун, цветные стекла, драгоценные камни: золь Au в стекле – рубиновое стекло (0,0001%) (1т стекла – 1г Au) |
Классификация по взаимодействию дисперсной фазы и дисперсионной среды (по межфазному взаимодействию)
Эта классификация пригодна только для систем с жидкой дисперсионной средой. Г.Фрейндлих предложил подразделить ДС на два вида:
– лиофобные, в них дисперсная фаза не способна взаимодействовать с дисперсионной средой, а следовательно, и растворяться в ней, к ним относятся коллоидные растворы, микрогетерогенные системы;
– лиофильные, в них дисперсная фаза взаимодействует с дисперсионной средой и при определенных условиях способна в ней растворяться, к ним относятся растворы коллоидных ПАВ и растворы ВМС.
Классификация по межчастичному взаимодействию
Согласно этой классификации ДС подразделяют на:
– свободнодисперсные (бесструктурные);
– связнодисперсные (структурированные).
В свободнодисперсных системах частицы дисперсной фазы не связаны друг с другом и способны независимо передвигаться в дисперсионной среде.
В связнодисперсных системах частицы дисперсной фазы связаны друг с другом за счет межмолекулярных сил, образуя в дисперсионной среде своеобразные пространственные сетки или каркасы (структуры). Частицы, образующие структуру, не способны к взаимному перемещению и могут совершать только колебательные движения.
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Поверхностная энергия. Адсорбция
При описании свойств гетерогенной системы следует различать свойства участка фазы, находящегося на поверхности и свойства фазы в объеме.
Частицы, находящиеся на поверхности каждой фазы, образуют особую поверхностную фазу. Средняя энергия gs частицы, находящейся на поверхности раздела фаз, отличается от средней энергии такой же частицы в объеме фазы gv (может быть больше или меньше). Поэтому важнейшей характеристикой поверхностной фазы является поверхностная энергия Gs - разность средней энергии частицы, находящейся на поверхности фазы, и частицы, находящейся в объеме фазы, умноженная на число частиц на поверхности N:
![]()
Для характеристики поверхности раздела, отделяющей данную фазу от другой, вводится понятие поверхностное натяжение σ – отношение поверхностной энергии к площади поверхности раздела фаз; величина поверхностного натяжения зависит только от природы обеих фаз.
![]() ,
Дж/м2,
Н/м
,
Дж/м2,
Н/м
= (dG/dS)p,T,N
При S = 1 м2, = G, то есть поверхностное натяжение – энергия Гиббса единицы поверхности.
Поверхностное натяжение положительно, если находящиеся на поверхности частицы взаимодействуют с частицами этой же фазы сильнее, чем с частицами другой фазы (и, следовательно, gs > gv). Согласно принципу минимума свободной энергии, любая фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию; поэтому в случае положительного поверхностного натяжения (σ > 0) фаза стремится уменьшить свою поверхность. В случае если σ < 0, поверхностная энергия фазы будет уменьшаться при увеличении площади поверхности.
На границе конденсированной (т.е. твердой или жидкой) фазы с газом поверхностное натяжение всегда положительно, поскольку частицы конденсированной фазы взаимодействуют друг с другом сильнее, чем с молекулами газа. Согласно принципу минимума свободной энергии, конденсированная фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию. Это проявляется либо в уменьшении площади поверхности фазы (именно поэтому капля жидкости в невесомости принимает форму сферы), либо в уменьшении поверхностного натяжения при появлении на поверхности раздела фаз новых частиц – молекул газа либо растворенного вещества. Процесс самопроизвольного увеличения концентрации какого-либо вещества у поверхности раздела двух фаз называется адсорбцией. Адсорбентом называется вещество, на поверхности которого происходит изменение концентрации другого вещества – адсорбата (адсорбтив).
Адсорбция характеризуется тремя общими признаками:
– термодинамической обратимостью, т е. динамическим равновесием двух противоположных процессов - адсорбции и десорбции -
