
- •Введение
- •Лабораторная работа № 1 определение молекулярной массы кислорода Теоретическая часть
- •6 Уравнение Клапейрона-Менделеева
- •Экспериментальная часть
- •Расчётная часть
- •Вопросы и задачи
- •Лабораторная работа № 2 оПределение эквивалентной массы магния теоретическая часть
- •Закон эквивалентов
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка результатов
- •Результаты опыта
- •Расчётная часть
- •22,4 H2 весит 2,0 г.
- •V0 л весит mH2
- •Вопросы и задачи
- •Лабораторная работа № 3 растворы. Приготовление растворов различных концентраций Теоретическая часть
- •Экспериментальная часть Опыт 1. Приготовление раствора заданной концентрации из навески
- •Порядок проведения опыта
- •Вопросы и задачи
- •Химическое равновесие
- •Экспериментальная часть
- •Взаимодействие иодата натрия с сульфитом натрия
- •Взаимодействие нитрата ртути (II) с иодитом калия
- •Растворение карбоната кальция в хлороводородной кислоте
- •Вопросы и задачи
- •Лабораторная работа № 5 гидролиз солей теоретическая часть
- •Экспериментальная часть
- •Реакции обмена в растворах электролитов Опыт 4. Смещение ионного равновесия
- •Вопросы и задачи
- •Лабораторная работа № 6 окислительно-восстановительные реакции ТеоретическАя часть
- •Экспериментальная часть
- •Взаимодействие разбавленной кислоты с металлами
- •Окисление сульфида натрия перманганатом калия в кислой среде
- •Восстановительные свойства соединений железа (II.
- •Восстановление сульфид-ионами хроматов и дихроматов
- •Окисление меди концентрированной азотной кислотой
- •Экспериментальная часть
- •Получение комплексного соединения висмута (тетраиодовисмутиата калия)
- •Аквакомплексы кобальта
- •Взаимодействие ферроцианида калия с сульфатом меди
- •Вопросы и задачи
- •Экспериментальная часть
- •Электролиз с нерастворимым анодом
- •Электролиз с растворимым анодом
- •Вопросы и задачи
- •Правила техники безопасности при работе в лаборатории общей и неорганической химии
- •Список литературы
- •Содержание
- •Редактор л.А. Маркешина
- •450062, Республика Башкортостан, г. Уфа, ул. Космонавтов, 1.
Химическое равновесие
Многие химические реакции идут не до полного исчезновения исходных веществ, а до состояния, не изменяющегося во времени, когда в реакционной смеси можно обнаружить как исходные вещества, так и продукты реакции. Такое состояние системы называется химическим равновесием. С точки зрения термодинамики состояние равновесия характеризуется тем, что система достигает минимального значения энергии Гиббса при заданных температуре, давлении и общем составе. С точки зрения кинетики химическое равновесие устанавливается тогда, когда скорости образования продуктов реакции из исходных веществ и из продуктов реакции выравниваются между собой.
Химическое равновесие является неизменным во времени только при отсутствии внешнего воздействия. При наличии внешних воздействий (изменение температуры, давления, концентрации реагентов) система реагирует на них, переходя в другое равновесное состояние.
В зависимости от природы процесса, условий, а также наличия или отсутствия катализаторов время достижения равновесия может меняться от малых долей секунды до веков и тысячелетий.
Когда равновесие достигнуто для реакции
|
(1) |
величина
|
(2) |
называемая
константой
равновесия,
принимает определенное значение.
Выражение (2) называется законом
действующих масс,
где
![]() ,
,
![]() и т.д. – равновесные молярные концентрации
реагирующих веществ и продуктов в
степенях, равных соответствующим
стехиометрическим коэффициентам в
уравнении реакции.
и т.д. – равновесные молярные концентрации
реагирующих веществ и продуктов в
степенях, равных соответствующим
стехиометрическим коэффициентам в
уравнении реакции.
Если в химической реакции участвуют твердые вещества, например:
|
(3) |
или
|
(4) |
в выражении константы равновесия их концентрации отсутствуют. Это связано с тем, что в процессе реакции меняются только количества твердых веществ, но не меняется их «концентрация».
Константы равновесия имеют вид
![]() – для реакции (3)
и
– для реакции (3)
и
![]() – для реакции (4).
– для реакции (4).
Если химическая реакция протекает в разбавленном растворе и изменением концентрации растворителя в процессе реакции можно пренебречь, его концентрация также не входит в выражение для константы равновесия, например:
|
(5) |
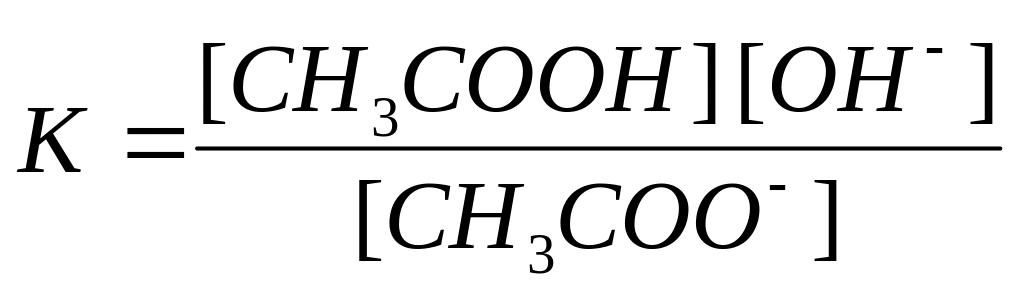 .
.
Константа равновесия не зависит от концентрации реагентов. Например, для реакции
|
(6) |
соотношение
равновесных концентраций
![]() ,
,
![]() ,
,
![]() при заданной температуре не зависит от
того, имелись ли в начале процесса чистые
азот, водород, аммиак или их смесь.
при заданной температуре не зависит от
того, имелись ли в начале процесса чистые
азот, водород, аммиак или их смесь.
Изменение равновесных концентраций в результате внешнего воздействия называется смещением химического равновесия.
Основным законом, указывающим направление смещения равновесия при внешних воздействиях, является принцип Ле-Шателье:
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, смещающее это равновесие, то смещение происходит в сторону, ослабляющую воздействие, до тех пор, пока нарастающее в системе противодействие не станет равным оказываемому действию.
Внешним воздействием, смещающим равновесие, может быть изменение температуры, давления или концентрации одного или нескольких веществ, участвующих в реакции.
При нагревании, т.е. сообщении системе теплоты, преимущество получает эндотермический процесс, сопровождающийся поглощением теплоты и препятствующей тем самым повышению температуры системы. При охлаждении, отнятии у системы теплоты, преимущество получает экзотермический процесс, восполняющий до некоторой степени потерю теплоты в системе и препятствующий понижению ее температуры, т.е. и в первом и во втором случае в системе возникает противодействие, ослабляющее внешнее воздействие.
Иными словами, для экзотермической реакции (6) повышение температуры смещает равновесие влево, в сторону образования исходных веществ (азота и водорода), а понижение – вправо, в сторону образования продуктов реакции (аммиака).
При уменьшении объема системы в результате повышения давления преимущество получает процесс, сопровождающийся образованием веществ меньшего объема; при этом давление в системе повышается не столь значительно, как в отсутствие такого процесса. И наоборот.
Для реакции (6) повышение давления сместит равновесие вправо, а понижение – влево.
При увеличении концентрации одного из реагентов получает преимущество реакция его расходования и равновесие смещается вправо. При увеличении концентрации одного из продуктов равновесие реакции смещается в сторону образования исходных реагентов.
Такие воздействия, как освещение, приложение электрического или магнитного поля и т.п., на состояние равновесия, как правило, не влияют.
Частным, но очень важным случаем установления химического равновесия является процесс образования (выпадения) осадка, например:
|
(7) |
или обратный ему процесс растворения осадка:
|
(8) |
Константы равновесия этих процессов имеют следующий вид:
![]()
для реакции (7) и
|
(9) |
для реакции (8).
На практике всегда
используют вторую константу (9), которую
называют произведением растворимости
и обозначают ПР. Очевидно, что для
малорастворимой соли состава
![]() .
.
Зная величину ПР,
можно вычислить концентрацию ионов
соли в насыщенном растворе, т.е. ее
растворимость. Кроме того, если в растворе
содержатся известные концентрации
ионов
![]() и
и
![]() ,
можно установить, выпадет ли из этого
раствора осадок соли или нет.
,
можно установить, выпадет ли из этого
раствора осадок соли или нет.
Условие выпадения осадка имеет вид
![]() .
.
Если в растворе
над осадком понизить концентрацию
одного из ионов, то произведение
концентраций
![]() станет меньше ПР, и осадок растворится.
станет меньше ПР, и осадок растворится.
Например, равновесие
![]()
при добавлении
![]() сместится вправо, за счет образования
устойчивого комплекса
сместится вправо, за счет образования
устойчивого комплекса
![]() :
:
![]() .
.
