
- •Введение
- •Лабораторная работа № 1 определение молекулярной массы кислорода Теоретическая часть
- •6 Уравнение Клапейрона-Менделеева
- •Экспериментальная часть
- •Расчётная часть
- •Вопросы и задачи
- •Лабораторная работа № 2 оПределение эквивалентной массы магния теоретическая часть
- •Закон эквивалентов
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка результатов
- •Результаты опыта
- •Расчётная часть
- •22,4 H2 весит 2,0 г.
- •V0 л весит mH2
- •Вопросы и задачи
- •Лабораторная работа № 3 растворы. Приготовление растворов различных концентраций Теоретическая часть
- •Экспериментальная часть Опыт 1. Приготовление раствора заданной концентрации из навески
- •Порядок проведения опыта
- •Вопросы и задачи
- •Химическое равновесие
- •Экспериментальная часть
- •Взаимодействие иодата натрия с сульфитом натрия
- •Взаимодействие нитрата ртути (II) с иодитом калия
- •Растворение карбоната кальция в хлороводородной кислоте
- •Вопросы и задачи
- •Лабораторная работа № 5 гидролиз солей теоретическая часть
- •Экспериментальная часть
- •Реакции обмена в растворах электролитов Опыт 4. Смещение ионного равновесия
- •Вопросы и задачи
- •Лабораторная работа № 6 окислительно-восстановительные реакции ТеоретическАя часть
- •Экспериментальная часть
- •Взаимодействие разбавленной кислоты с металлами
- •Окисление сульфида натрия перманганатом калия в кислой среде
- •Восстановительные свойства соединений железа (II.
- •Восстановление сульфид-ионами хроматов и дихроматов
- •Окисление меди концентрированной азотной кислотой
- •Экспериментальная часть
- •Получение комплексного соединения висмута (тетраиодовисмутиата калия)
- •Аквакомплексы кобальта
- •Взаимодействие ферроцианида калия с сульфатом меди
- •Вопросы и задачи
- •Экспериментальная часть
- •Электролиз с нерастворимым анодом
- •Электролиз с растворимым анодом
- •Вопросы и задачи
- •Правила техники безопасности при работе в лаборатории общей и неорганической химии
- •Список литературы
- •Содержание
- •Редактор л.А. Маркешина
- •450062, Республика Башкортостан, г. Уфа, ул. Космонавтов, 1.
Расчётная часть
По объёму, вытесненному при нормальных условиях водорода V0, вычисляют массу объёма. Учитывая, что масса водорода 22,4 л при нормальных условиях (н.у.) весит 2 г, находят массу H2.
22,4 H2 весит 2,0 г.
V0 л весит mH2
mH2=![]()
По известным массам израсходованного магния (mMg) и вытесненного им водорода определяют эквивалентную массу магния:
![]()
Полученный результат сравнивают с эквивалентной массой, вычисляемой по формуле
ЭMg=![]() ,
,
где А атомная масса металла; В валентность металла.
Вопросы и задачи
1 Вычислить эквиваленты следующих соединений: NaOH, Mg(OH)2, Ca(OH)2, H3PO4, KMnO4, Ca3(PO4)2.
2 Вычислить эквивалент азота в его соединениях с кислородом: N2O, NO, NO2, N2O3, N2O5.
3 Сколько оксида получается при окислении 3 г металла, эквивалентная масса которого равна 9 г/моль?
4 Определить эквивалентные массы кислот и оснований:
а) HNO3 + Bi(OH)3 → Bi(OH)2NO3 + H2O;
б) 3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O;
в) H3PO4 + Ca(OH)2 → CaHPO4 + 2H2O;
г) 2HCl + Bi(OH)3 → BiOHCl2 + 2H2O.
5 Какой объём займут при н.у. массы одного эквивалента кислорода и водорода?
6 Определить эквивалент металла, если 0,046 г его вытеснили из кислоты 62,35 мл Н2 при t=17°С и давлении 1,017×105 Па. Давление водяного пара при 17°С равно 0,193×105 Па.
7 Вычислить эквивалентную массу: а) олова, если при нагревании 0,92 г его в токе кислорода образуется 1,17 г оксида олова;
б) магния, если при нагревании в токе кислорода масса его увеличилась на 66,7%.
8 Вычислить эквивалент серной кислоты в реакции с КОН:
а) H2SO4 + KOH → KHSO4 + H2O;
б) H2SO4 + 2KOH → K2SO4 + 2H2O.
9 Вычислить эквивалент Са(ОН)2 и H3PO4, рассчитать, сколько граммов Са(ОН)2 потребуется для нейтрализации 150 г Н3РО4.
Лабораторная работа № 3 растворы. Приготовление растворов различных концентраций Теоретическая часть
Растворы – это однородные (гомогенные) системы, состоящие их двух и более компонентов (составных частей) и продуктов их взаимодействия.
Важной характеристикой любого раствора является его количественный состав, который выражается концентрацией.
Концентрацией раствора называют количество растворенного вещества, содержащегося в определенном количестве раствора или растворителя.
Существуют различные способы выражения концентрации растворов: процентная (по массе), молярная, нормальная, титр, мольная доля, мольная концентрация.
Процентная концентрация (С % или ω) определяет процентное отношение массы растворенного вещества к общей массе раствора:
![]() ,
,
где
![]() – масса растворенного вещества;
– масса растворенного вещества;
![]() – общая масса
раствора.
– общая масса
раствора.
Молярная масса,
или молярность,
![]() выражается числом молей растворенного
вещества, содержащегося в 1 литре
раствора:
выражается числом молей растворенного
вещества, содержащегося в 1 литре
раствора:
![]() ,
,
где – масса растворенного вещества;
![]() – молярная масса
растворенного вещества;
– молярная масса
растворенного вещества;
![]() – объем раствора,
– объем раствора,
размерность
![]() .
.
Нормальная
концентрация, или нормальность,
![]() выражается числом растворенного
вещества, содержащегося в 1 литре
раствора:
выражается числом растворенного
вещества, содержащегося в 1 литре
раствора:
![]() ,
,
где – масса растворенного вещества;
![]() – эквивалентная
масса растворенного вещества;
– эквивалентная
масса растворенного вещества;
– объем раствора,
размерность
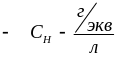 .
.
Титр Т – это количество растворенного вещества в граммах, содержащееся в 1 мл раствора. Расчет титра в зависимости от нормальности производится по формуле
![]() ,
,
где – нормальность раствора;
– эквивалентная масса растворенного вещества,
размерность
![]() .
.
Мольная доля
![]() – это отношение числа молей растворенного
вещества
– это отношение числа молей растворенного
вещества
![]() к сумме числа молей всех компонентов
раствора
к сумме числа молей всех компонентов
раствора
![]() .
.
Мольная доля –
безразмерная величина. Сумма мольных
долей всех компонентов раствора всегда
равна единице (![]() ).
).
