
- •Введение
- •Лабораторная работа № 1 определение молекулярной массы кислорода Теоретическая часть
- •6 Уравнение Клапейрона-Менделеева
- •Экспериментальная часть
- •Расчётная часть
- •Вопросы и задачи
- •Лабораторная работа № 2 оПределение эквивалентной массы магния теоретическая часть
- •Закон эквивалентов
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка результатов
- •Результаты опыта
- •Расчётная часть
- •22,4 H2 весит 2,0 г.
- •V0 л весит mH2
- •Вопросы и задачи
- •Лабораторная работа № 3 растворы. Приготовление растворов различных концентраций Теоретическая часть
- •Экспериментальная часть Опыт 1. Приготовление раствора заданной концентрации из навески
- •Порядок проведения опыта
- •Вопросы и задачи
- •Химическое равновесие
- •Экспериментальная часть
- •Взаимодействие иодата натрия с сульфитом натрия
- •Взаимодействие нитрата ртути (II) с иодитом калия
- •Растворение карбоната кальция в хлороводородной кислоте
- •Вопросы и задачи
- •Лабораторная работа № 5 гидролиз солей теоретическая часть
- •Экспериментальная часть
- •Реакции обмена в растворах электролитов Опыт 4. Смещение ионного равновесия
- •Вопросы и задачи
- •Лабораторная работа № 6 окислительно-восстановительные реакции ТеоретическАя часть
- •Экспериментальная часть
- •Взаимодействие разбавленной кислоты с металлами
- •Окисление сульфида натрия перманганатом калия в кислой среде
- •Восстановительные свойства соединений железа (II.
- •Восстановление сульфид-ионами хроматов и дихроматов
- •Окисление меди концентрированной азотной кислотой
- •Экспериментальная часть
- •Получение комплексного соединения висмута (тетраиодовисмутиата калия)
- •Аквакомплексы кобальта
- •Взаимодействие ферроцианида калия с сульфатом меди
- •Вопросы и задачи
- •Экспериментальная часть
- •Электролиз с нерастворимым анодом
- •Электролиз с растворимым анодом
- •Вопросы и задачи
- •Правила техники безопасности при работе в лаборатории общей и неорганической химии
- •Список литературы
- •Содержание
- •Редактор л.А. Маркешина
- •450062, Республика Башкортостан, г. Уфа, ул. Космонавтов, 1.
Окисление меди концентрированной азотной кислотой
Выполнение опыта: поместите в пробирку маленький кусочек медной проволоки или стружки и прилейте 3-4 капли концентрированной азотной кислоты. Если реакция идет медленно, то следует осторожно слегка нагреть раствор над пламенем спиртовки.
Запись данных опыта: в какой цвет окрашен выделяющийся газ и какому оксиду азота принадлежит эта краска? Обратите внимание на цвет полученного раствора и укажите, какой ион имеет в водном растворе такую окраску. Написать уравнение реакции.
Опыт 5. Восстановители кислоты, в которых центральный атом находится в низшей степени окисления
а) восстановление брома и йода сернистой кислотой или сульфитом натрия
Выполнение опыта: к 3-5 каплям бромной воды добавьте раствор сернистой кислоты до полного обесцвечивания. Проделать то же, взяв вместо бромной воды йодную, а вместо сернистой кислоты – раствор сульфида натрия.
Докажите наличие сульфат – иона в окисленных растворах с помощью раствора BaCl2?
Запись данных опыта: написать уравнение реакции;
б) восстановительные свойства азотистой кислоты и нитритов
Выполнение опыта: к 2-3 каплям раствора дихромата калия, подкисленного таким же объемом разбавленной серной кислоты, приливайте по каплям раствор нитрита калия до получения устойчивой окраски. Отметить цвет полученного раствора.
Запись данных опыта: написать уравнение реакции.
Все реакции ОВР в растворах написать методом электронно-ионного баланса (методом полуреакций).
Лабораторная работа № 7
Комплексные соединения
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Комплексные соединения
Многие молекулы сложных веществ, способны участвовать в реакциях присоединения за счет образования дополнительных химических связей по донорно-акцепторному механизму. Вещества, в которых элементы проявляют «дополнительные» валентности, называются соединениями высшего порядка или комплексными.
Реакции могут протекать между веществами, находящимися в любом агрегатном состоянии, но наиболее часто в жидком.
Комплексные соединения образуются в результате насыщения химическими связями атомов, молекул или ионов, за счет вакантных (акцепторы) или заполненных (доноры) орбиталей. Большинство имеют явно выраженный центральный атом, вокруг которого располагаются связанные с ним частицы атомы, ионы, молекулы. Этот атом называется комплексообразователем. Он устанавливает химическую связь с каждой окружающей его частицей. Частицы, непосредственно связанные с комплексообразователем называются лигандами (аддендами). Комплексообразователь вместе с лигандами образует комплексную частицу, которая при написании заключается в квадратные скобки это внутренняя сфера. Количество лигандов в ней определяется координационным числом комплексообразователя.
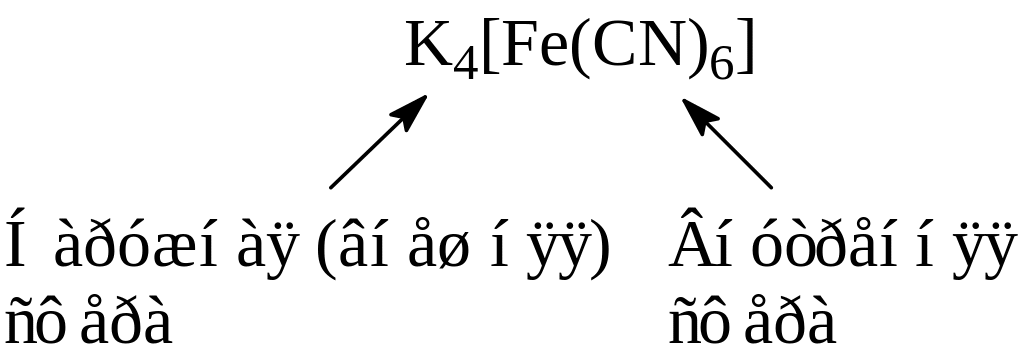
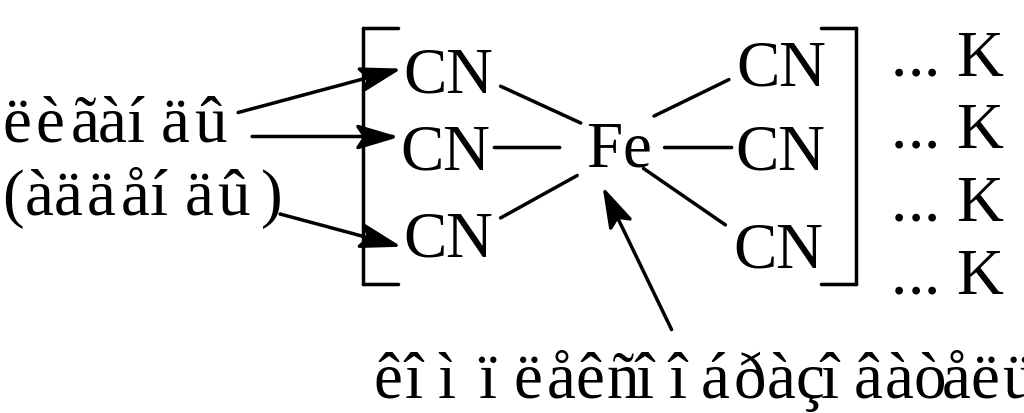
Координационное число (к.ч.) является для комплексных соединений важнейшей характеристикой и определяет его состав и структуру.
Комплексообразователь связан с лигандами σ-связью. Чаще всего им бывает атом или ион металла. Лигандами могут быть либо отрицательно заряженные частицы (Fˉ, Clˉ, O²ˉ, OHˉ, NO2ˉ и т.д.), либо полярные молекулы (NH3, H2O, CO и т.д.).
Заряд комплексной частицы находится как сумма заряда комплексообразователя и зарядов всех лигандов.
Чтение комплексных соединений. С 1963г. используется рациональная номенклатура. Дается название аниона, затем в родительном падеже название катиона. Перечисляются все составные частицы. К обычному латинскому названию лиганда добавляется окончание О (если оканчивается на ИД, то оно отбрасывается) F – фторо; Cl – хлоро и т.д.
NH3 – анилин 2 – ди, 3 – три,
N2H4 – гидродин 4 – тетра, 5 – пента
PH3 – фосфин 6 – гекса, 7 – гекта
NO – нитрозил 8 – окта
H2O – аква и т.д.
Последним называют комплексообразователь (со степенью окисления в скобках):
Fe3[Fe(CN)6]2 – гексацианоферрат (III) железа (II).
