
- •Введение
- •Лабораторная работа № 1 определение молекулярной массы кислорода Теоретическая часть
- •6 Уравнение Клапейрона-Менделеева
- •Экспериментальная часть
- •Расчётная часть
- •Вопросы и задачи
- •Лабораторная работа № 2 оПределение эквивалентной массы магния теоретическая часть
- •Закон эквивалентов
- •Экспериментальная часть
- •Порядок выполнения работы
- •Обработка результатов
- •Результаты опыта
- •Расчётная часть
- •22,4 H2 весит 2,0 г.
- •V0 л весит mH2
- •Вопросы и задачи
- •Лабораторная работа № 3 растворы. Приготовление растворов различных концентраций Теоретическая часть
- •Экспериментальная часть Опыт 1. Приготовление раствора заданной концентрации из навески
- •Порядок проведения опыта
- •Вопросы и задачи
- •Химическое равновесие
- •Экспериментальная часть
- •Взаимодействие иодата натрия с сульфитом натрия
- •Взаимодействие нитрата ртути (II) с иодитом калия
- •Растворение карбоната кальция в хлороводородной кислоте
- •Вопросы и задачи
- •Лабораторная работа № 5 гидролиз солей теоретическая часть
- •Экспериментальная часть
- •Реакции обмена в растворах электролитов Опыт 4. Смещение ионного равновесия
- •Вопросы и задачи
- •Лабораторная работа № 6 окислительно-восстановительные реакции ТеоретическАя часть
- •Экспериментальная часть
- •Взаимодействие разбавленной кислоты с металлами
- •Окисление сульфида натрия перманганатом калия в кислой среде
- •Восстановительные свойства соединений железа (II.
- •Восстановление сульфид-ионами хроматов и дихроматов
- •Окисление меди концентрированной азотной кислотой
- •Экспериментальная часть
- •Получение комплексного соединения висмута (тетраиодовисмутиата калия)
- •Аквакомплексы кобальта
- •Взаимодействие ферроцианида калия с сульфатом меди
- •Вопросы и задачи
- •Экспериментальная часть
- •Электролиз с нерастворимым анодом
- •Электролиз с растворимым анодом
- •Вопросы и задачи
- •Правила техники безопасности при работе в лаборатории общей и неорганической химии
- •Список литературы
- •Содержание
- •Редактор л.А. Маркешина
- •450062, Республика Башкортостан, г. Уфа, ул. Космонавтов, 1.
Взаимодействие нитрата ртути (II) с иодитом калия
Выполнение работы: несколько кристалликов сухих солей нитрата ртути (II), иодита калия поместить в сухую пробирку, в другую пробирку насыпать приблизительное количество этих же веществ в виде мелкого порошка, энергично встряхнуть обе пробирки. Наблюдать появление окраски вследствие образования иодида ртути (II). Отметить различную скорость течения реакции.
Запись данных опыта: влияние какого фактора изменяет скорость? Написать уравнение происходящей реакции.
Растворение карбоната кальция в хлороводородной кислоте
Выполнение работы: взять два небольших, по возможности одинаковых кусочка мела. Один из них положить на фильтровальную бумагу и стеклянной палочкой измельчить его в порошок. Полученный порошок поместить в коническую пробирку. В обе пробирки одновременно добавить одинаковое количество (10-20 капель) хлороводородной кислоты (плотность 1,19 г/см3). Отметить время полного растворения мела в каждом случае.
Запись данных опыта: Написать уравнение соответствующей реакции. Почему скорость растворения мела в двух случаях различная?
Опыт 5. Влияние катализаторов на скорость реакции
Каталитическое восстановление железа (III)
Выполнение работы: в две пробирки внести 10 капель 0,5 н раствора роданида калия или аммония и по 1 капле 0,5 н раствора хлорида железа (III). Что наблюдается ? В одну пробирку добавить 1 каплю 1 н раствора сульфата меди. В обе пробирки внести по 10 капель тиосульфата натрия. Наблюдать различную скорость обесцвечивания растворов, которое происходит вследствие восстановления железа (III) до железа (II) тиосульфатом натрия (Na2S2O3).
Запись данных опыта: Отметить все наблюдаемые явления, написать уравнения реакций:
а) взаимодействия железа (III) с роданидом калия, в результате которого образуется Fe(SCN)3 красного цвета;
б) восстановления железа (III) в железо (II) тиосульфатом натрия, протекающего по уравнению
![]()
Какую окраску
имеет
![]() ?
Что явилось катализатором в данном
опыте?
?
Что явилось катализатором в данном
опыте?
Вопросы и задачи
1 Написать выражения константы равновесия для реакции:
а)
![]() ;
;
б)
![]() ;
;
в)
![]() ;
;
г)
![]() .
.
В каком направлении сместится равновесие в каждом случае при увеличении давления?
2 В каком направлении сместится равновесие следующих обратимых реакций:
а)
![]() ;
;
б)
![]()
при понижении температуры, при понижении давления?
3 Действием каких факторов можно сместить равновесие указанных реакций вправо:
а)
![]() ;
;
б)
![]() ?
?
4 Приведите по два примера обратимых и практически необратимых реакций.
5 Почему химическое равновесие называют динамическим, или подвижным?
6 Для следующих химических реакций напишите выражение для констант равновесия и укажите, каким воздействием можно сместить равновесие вправо:
N2 (г) + 3H2 (г) ↔ 2NH3 (г);
H2 (г) + I2 (тв) ↔ 2HI (г);
N2 (г) + O2 (г) ↔ 2NO (г);
CaCO3 (тв) ↔ CaO(тв) + CO2 (г);
ZnCl2 (р-р) + H2S(р-р) ↔ ZnS(тв)↓ + 2HCl(р-р).
Лабораторная работа № 5 гидролиз солей теоретическая часть
Растворы солей, образованных слабыми кислотами или слабыми основаниями, практически никогда не имеют нейтральной реакции (pH=7). Причиной такого поведения является то, что анионы слабых кислот, а также гидратированные катионы металлов проявляют соответственно свойства оснований или кислот, т.е. способны захватывать или отдавать протоны. Вода является амфолитом и способна проявлять свойства как кислоты, так и основания. Поэтому между анионами слабых кислот и водой и, соответственно, между гидратированными катионами металлов и водой возможно взаимодействие кислотно-основного типа.
Рассмотрим в качестве примера две реакции:
|
(1) |
|
(2) |
В реакции (1) протон
переходит от молекулы воды, выступающей
в роли кислоты, к ацетатиону, проявляющему
свойства основания, а в реакции (2) – от
молекулы воды гидратной оболочки
аквакомплекса (кислота) к свободной
молекуле воды растворителя (основание).
Такое взаимодействие между ионами солей
и водой меняет концентрации [![]() ]
и [
]
и [![]() ],
и, следовательно, раствор соли обнаруживает
кислую и щелочную реакцию.
],
и, следовательно, раствор соли обнаруживает
кислую и щелочную реакцию.
Следует отметить, что свойства аквакислот проявляют почти все гидратированные ионы металлов. Исключение составляют только ионы щелочных и щелочноземельных металлов, которые, имея сравнительно большие размеры и малый заряд, не могут вызвать отщепление протона от молекул гидратной оболочки.
К реакциям гидролиза, как к равновесным процессам, применим закон действующих масс. Следовательно, для реакций (1), (2) можно записать выражения для констант равновесия, которые называются константами гидролиза:
|
(3) |
|
|
или, для упрощения, не выписывая формулы молекул воды у гидратированных ионов алюминия,
|
(4) |
Умножив числитель
и знаменатель уравнения (3) на концентрацию
ионов водорода
![]() ,
а уравнения (4) – на концентрацию
гидроксид-ионов
,
а уравнения (4) – на концентрацию
гидроксид-ионов
![]() и выполнив некоторые преобразования,
получим выражение, связывающее константу
гидролиза с константой диссоциации
слабой кислоты:
и выполнив некоторые преобразования,
получим выражение, связывающее константу
гидролиза с константой диссоциации
слабой кислоты:
|
|
|
(5) |
или, соответственно, с константой диссоциации образующегося слабого основания:
|
(6) |
Таким образом,
константа гидролиза может быть вычислена
по константам диссоциации кислоты или
основания, образующих данную соль, и
константе автопротолиза (ионному
произведению) воды
![]() .
.
В водных растворах с участием многозарядных катионов и анионов гидролиз протекает по стадиям, например:
|
(7) |
|
(8) |
Для описания гидролиза в растворе определенной концентрации можно использовать степень гидролиза h. Степень гидролиза – это отношение числа молекул (катионов или анионов), подвергшихся гидролизу, к общему числу молекул (катионов или анионов), введенных в раствор. Зная степень гидролиза, можно определить концентрации ионов и в растворе, а значит, и pH растворов солей.
Все соли, кроме
образованных сильными кислотами и
сильными основаниями (![]() ,
,
![]() и т.п.), в различной степени подвергаются
гидролизу. Чем слабее кислота или
основание, образующие соль, тем сильнее
она гидролизована и тем больше pH
ее раствора отличается от 7. Так, в
растворе ацетата натрия
и т.п.), в различной степени подвергаются
гидролизу. Чем слабее кислота или
основание, образующие соль, тем сильнее
она гидролизована и тем больше pH
ее раствора отличается от 7. Так, в
растворе ацетата натрия
![]() pH
8, а pH
соли
pH
8, а pH
соли
![]() ,
образованной более слабой угольной
кислотой, близок к 11 (реакции 1,7 и 8).
,
образованной более слабой угольной
кислотой, близок к 11 (реакции 1,7 и 8).
Если соль образована
слабым основанием и слабой кислотой,
например
![]() ,
гидролиз идет в существенно большей
степени, т.к. образуется не один, а два
слабо диссоциирующих продукта:
,
гидролиз идет в существенно большей
степени, т.к. образуется не один, а два
слабо диссоциирующих продукта:
![]() .
.

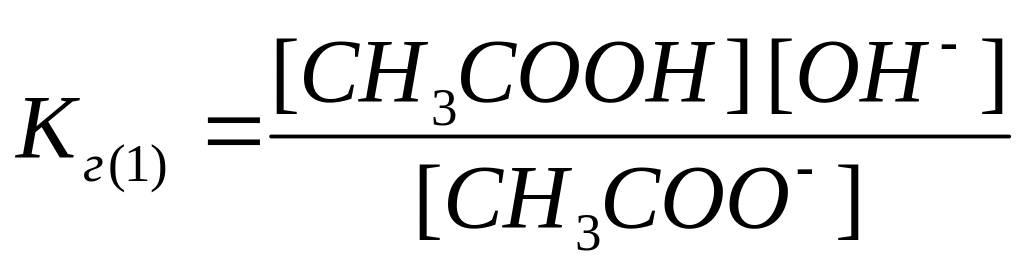 ,
,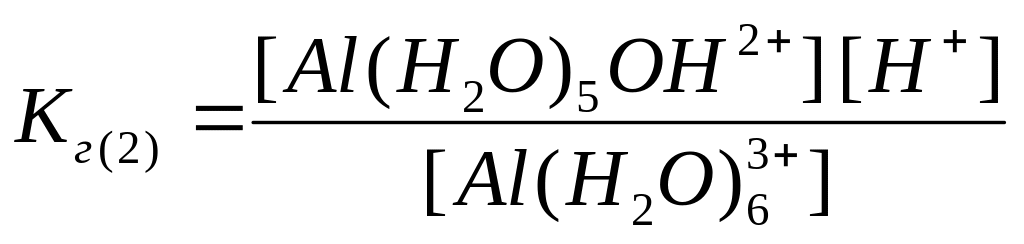 ,
,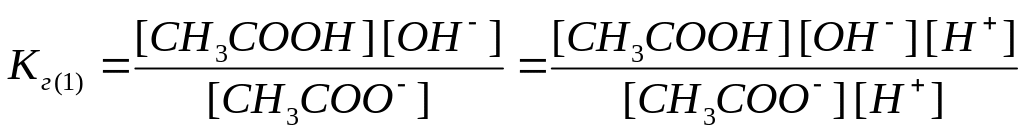 ,
,