
- •Розділ і. Хімічний зв’язок та будова макромолекул
- •Хімічний зв’язок, будова молекул
- •1.2. Виникнення і розвиток поняття макромолекула
- •1.3. Макромолекула, як об’єкт запису і перетворення інформації
- •Розділ іі. Об’єкти та методи досліджень
- •Лінійні аморфні полімери та неорганічні наповнювачі. Отримання зразків.
- •2.2. Використання методів розсіювання світла для визначення макромолекулярних констант
- •Розділ ііі. Макромолекулярні константи лінійних аморфних полімерів та їх систем
- •3.1. Основні геометричні константи макромолекул лінійних аморфних полімерів
- •3.2. Частотний спектр структуроутворень гетерогенних полімерних систем
- •Розв’язок рівняння (3.84) для основного тону коливань підсистеми буде мати вигляд
- •3.3. Макромолекулярні константи і дефект модуля зсуву в гетерогенних полімерних системах
- •Висновки
- •Література
Зміст
Вступ |
3 |
І. Хімічний зв’язок та будова макромолекул |
6 |
|
6 |
|
12 |
|
19 |
ІІ. Об’єкти та методи досліджень |
24 |
2.1. Лінійні аморфні полімери та неорганічні наповнювачі. Отримання зразків |
24 |
2.2. Використання методів розсіювання світла для визначення макромолекулярних констант |
27 |
ІІІ. Макромолекулярні константи лінійних аморфних полімерів та їх систем |
36 |
3.1. Основні геометричні константи макромолекул лінійних аморфних полімерів |
36 |
3.2. Частотний спектр структуроутворень гетерогенних полімерних систем |
43 |
3.3. Макромолекулярні константи і дефект модуля зсуву в гетерогенних полімерних системах |
75 |
Висновки |
83 |
Література |
84 |
ВСТУП
Актуальність роботи. Для прогнозування фізико-механічних та хімічних властивостей гетерогенних полімерних систем, встановлення функціональних закономірностей між структурою і властивостями використовуються різні модельні підходи. Це перш за все зумовлено тим, що багато явищ, які відбуваються в таких системах, зумовлені індивідуальними взаємодіями. Тому макромолекули полімерів, навіть якщо вони мають однаковий склад і число ланок, є індивідуальні і на них записана деяка комбінаторна інформація. Відповідно до цього система набуває здатності до самоорганізації. При цьому найчастіше розділяють два різних поняття інформації: структурна інформація (загальна для значної групи молекул) і конфігураційна (дискретна) – індивідуальна інформація кожної макромолекули, яка отримується за рахунок комбінації на певних ділянках ланцюга деяких конкретних первинних положень атомів і груп атомів ланки.
З цієї точки зору особливої ваги набуває розгляд поведінки структурних елементів макромолекул лінійних аморфних полімерів в силових і температурних полях, де доводиться враховувати не тільки гармонічні ефекти, але й ангармонізм їх коливань.
Визначити таку поведінку можливо лише за умови знання макромолекулярних характеристик ланцюгових молекул. Такі характеристики макромолекул можна визначити на основі моделювання та експериментальних досліджень.
Зв’язок роботи з науковими програмами, планами, темами.
Виконання роботи проводилося у межах комплексних досліджень наукової лабораторії фізики високомолекулярних сполук при кафедрі фізики Рівненського державного гуманітарного університету відповідно до тем „Дослідження шляхів напрямленої модифікації властивостей гетерогенних полімерних та дисперсних систем” і „Шляхи напрямленого регулювання релаксаційних і термічних властивостей гетерогенних полімерних систем на основі гнучколанцюгових полімерів” та згідно з держбюджетними науково-дослідними роботами Міністерства науки і освіти України, зокрема «Вплив нелінійних ефектів на кібернетику структури і енергообмінні процеси в гетерогенних полімерних системах» (01.2010-01.2012), №реєстр.0109U000176.
Мета і завдання дослідження.
Для встановлення поведінки макромолекул, їх структурних елементів у полях різної природи потрібно враховувати як внутрішні так і міжмолекулярні взаємодії та їх вплив на макромолекулярні параметри. Відповідно до цієї мети формулюються і завдання дослідження.
Охарактеризувати макромолекулу як об’єкт запису і передачі інформації.
Показати можливості експериментальних методів для визначення макромолекулярних констант.
На основі моделювання ланцюгових макромолекул визначити їх макромолекулярні константи.
Наукова новизна.
На основі ентропійного підходу та кібернетичних уявлень макромолекула лінійних аморфних полімерів розглядається як структурний об’єкт запису і перетворення, передачі польової інформації.
Методами моделювання макромолекул лінійних аморфних полімерів введені і визначені їх геометричні константи.
Використання підсистемного підходу дало можливість визначити частотний спектр структурних елементів гетерогенних полімерних систем і дефект модуля зсуву при поширенні механічних коливань.
Практичне значення отриманих результатів.
На основі макромолекулярних констант прогнозуються в’язкопружні властивості гетерогенних полімерних систем.
Показано, що характер зміни комплексу властивостей полімерних систем при їх модифікації наповнювачами безпосередньо пов’язаний із зміною геометричних та енергетичних мікропараметрів макромолекул.
Розділ і. Хімічний зв’язок та будова макромолекул
Хімічний зв’язок, будова молекул
Молекула – найдрібніша частинка речовини, що володіє її основними хімічними властивостями і складається з атомів, з’єднаних між собою хімічними зв’язками. Молекули можуть відрізнятися між собою природою або кількістю атомів, що входять до її складу; напрямком лінії зв’язку між центрами атомів; віддалю між окремими атомами; енергією зв’язку [1].
У хімії розрізняють два роди зв’язку, що призводять до утворення молекул: іонний (гетерополярний) і гомополярний. Хімічні властивості елементів, визначаються в основному електронами зовнішнього шару, який може містити тільки s- і p-оболонки. Електрони внутрішніх шарів майже не впливають на хімічні процеси, так як вони набагато сильніше зв’язані з ядром, чим зовнішні. Тому енергія, що виділяється при хімічних реакціях, значно менша, ніж енергія зв’язку електронів внутрішніх шарів [2].
Іонний зв’язок реалізується в тих випадках, коли молекулу можна подати як утворену із позитивних і негативних іонів (наприклад, NaCl). Знак заряду іона залежить з однієї сторони, від потенціалу іонізації, а з іншої – від тієї енергії, з якою нейтральний атом може утримувати додатковий електрон на зовнішньому шарі.
Нехай
нейтральний атом з порядковим номером
z
містить N
електронів на внутрішніх орбітах, тоді
на зовнішній орбіті їх буде –
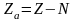 .
Кулонівська потенціальна енергія, за
рахунок якої утримуються електрони,
дорівнює:
.
Кулонівська потенціальна енергія, за
рахунок якої утримуються електрони,
дорівнює:
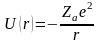 .
(1.1)
.
(1.1)
Для
електронів зовнішнього шару електрони
внутрішнього шару будуть екранувати
частину заряду ядра, а зовнішні електрони
повинні екранувати частину заряду ядра
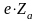 для оболонок, які лежать за межами
зовнішнього шару (тобто оболонок
збуджених станів). У самому ж зовнішньому
шарі частина заряду ядра буде зкомпенсована
не повністю, і тому ядро за рахунок цієї
частини заряду здатне утримувати в
зовнішньому шарі додаткові електрони,
що може привести до утворення негативних
іонів.
для оболонок, які лежать за межами
зовнішнього шару (тобто оболонок
збуджених станів). У самому ж зовнішньому
шарі частина заряду ядра буде зкомпенсована
не повністю, і тому ядро за рахунок цієї
частини заряду здатне утримувати в
зовнішньому шарі додаткові електрони,
що може привести до утворення негативних
іонів.
Іонний
зв’язок може бути пояснений наступним
чином: гетерополярна валентність
елементів визначається числом електронів,
які треба забрати або додати, щоб отримати
іон, який має електронний шар найближчого
інертного газу [3]. За таких умов основну
роль в іонному зв’язку повинні відігравати
сили кулонівського притягання між
різнойменно зарядженими іонами. Але
одні електростатичні сили не можуть
забезпечити стійку рівновагу такої
системи. Тому для обрахунків потенціальної
енергії взаємодії вводяться сили
відштовхування у вигляді
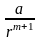 ,
де a,
m
– емпіричні константи. Тоді повна
потенціальна енергія двох іонів може
бути подана у вигляді:
,
де a,
m
– емпіричні константи. Тоді повна
потенціальна енергія двох іонів може
бути подана у вигляді:
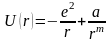 .
(1.2)
.
(1.2)
Поряд
з іонними з’єднаннями існують молекули,
які утворюються безпосередньо з
нейтральних атомів. Такі молекули
отримали назву атомних утворення атомних
молекул пояснити навіть якісно з точки
зору класичних уявлень не можливо.
Відповідь на це питання може дати
квантова механіка [3]. Для з’ясування
природи гомополярного зв’язку розглянемо
молекулу H2.
Виражають потенціальну енергію взаємодії
між двома атомами, як функцію відстані,
яка складається з двох частин: із енергії
взаємодії ядер
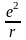 та енергії електронів E,
яка залежить від відстані між ядрами.
та енергії електронів E,
яка залежить від відстані між ядрами.
Таким чином можна записати, що енергія взаємодії дорівнює:
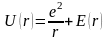 . (1.3)
. (1.3)
Сили хімічного зв’язку володіють такою властивістю як насиченість [4]. Це пояснюється тим, що число електронів у зовнішньому шарі атома обмежено, і частина з них зв’язана один з одним, пари електронів знаходяться в одному і тому ж квантовому стані і мають протилежної орієнтації спіни. Такі спарені електрони не утворюють хімічного зв’язку. Останній виникає тільки завдяки наявності в зовнішньому шарі неспарених електронів. Кожний атом може утворювати з іншими атомами стільки ковалентних зв’язків, скільки електронів з вільною орієнтацією спіну міститься в зовнішньому шарі.
Властивість атомів з’єднуватись один з одним утворюючи молекулу, описується за допомогою поняття валентності [5]. Кожному атому приписується певна валентність і при з’єднанні атомів їх валентності повинні взаємно насичуватися, тобто кожному валентному зв’язку атома повинен відповідати валентний зв’язок іншого атома. Для кількісної характеристики здатності атомів до взаємного з’єднання зручно користуватися цілим числом – подвоєних спінів атомів. Це число співпадає з хімічною валентністю атома. Слід зазначити, що один і той же атом може мати різну валентність в залежності від того, в якому стані він знаходиться.
Квантовий підхід до опису утворення молекули дозволяє використати прийняте в хімії зображення молекул, як сукупності атомів, з’єднаних локалізованими в просторі валентними зв’язками. Локалізація зв’язків проходить внаслідок ущільнення електронних хмарин за певними напрямками в інтервалах між атомами. Електронна хмарина для електронів, які знаходяться в p-стані витягнута вздовж однієї з осей. Це фактично і зумовлює в просторі напрям ковалентного зв’язку, так як приєднання інших атомів до даного іде за напрямком найбільшого перекриття хвильових функцій у валентній парі. (рис.1.1)
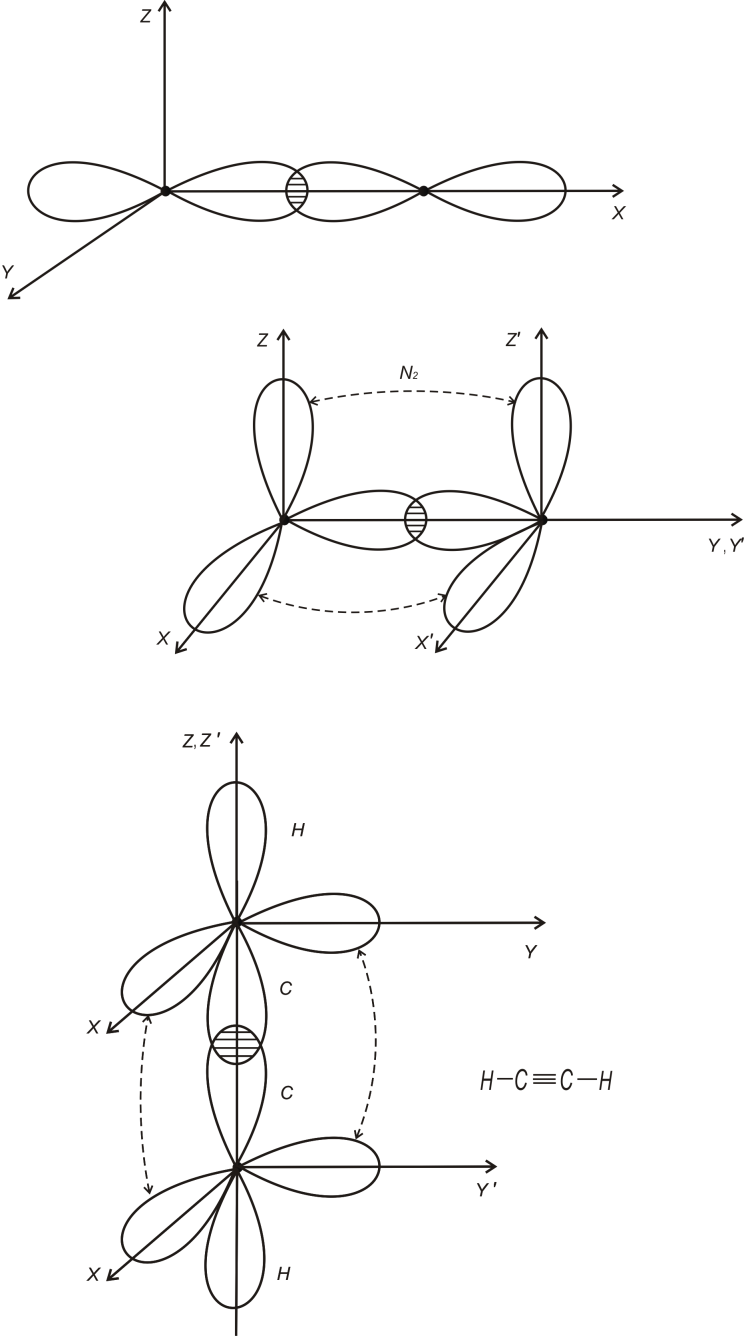
Рис.1.1.
У деяких молекулах хімічний зв’язок між парами електронів здійснюється не однією, а двома чи і трьома парами електронів[6]. Типовим прикладом молекули з потрійним зв’язком є молекула N2 (рис.1.2)
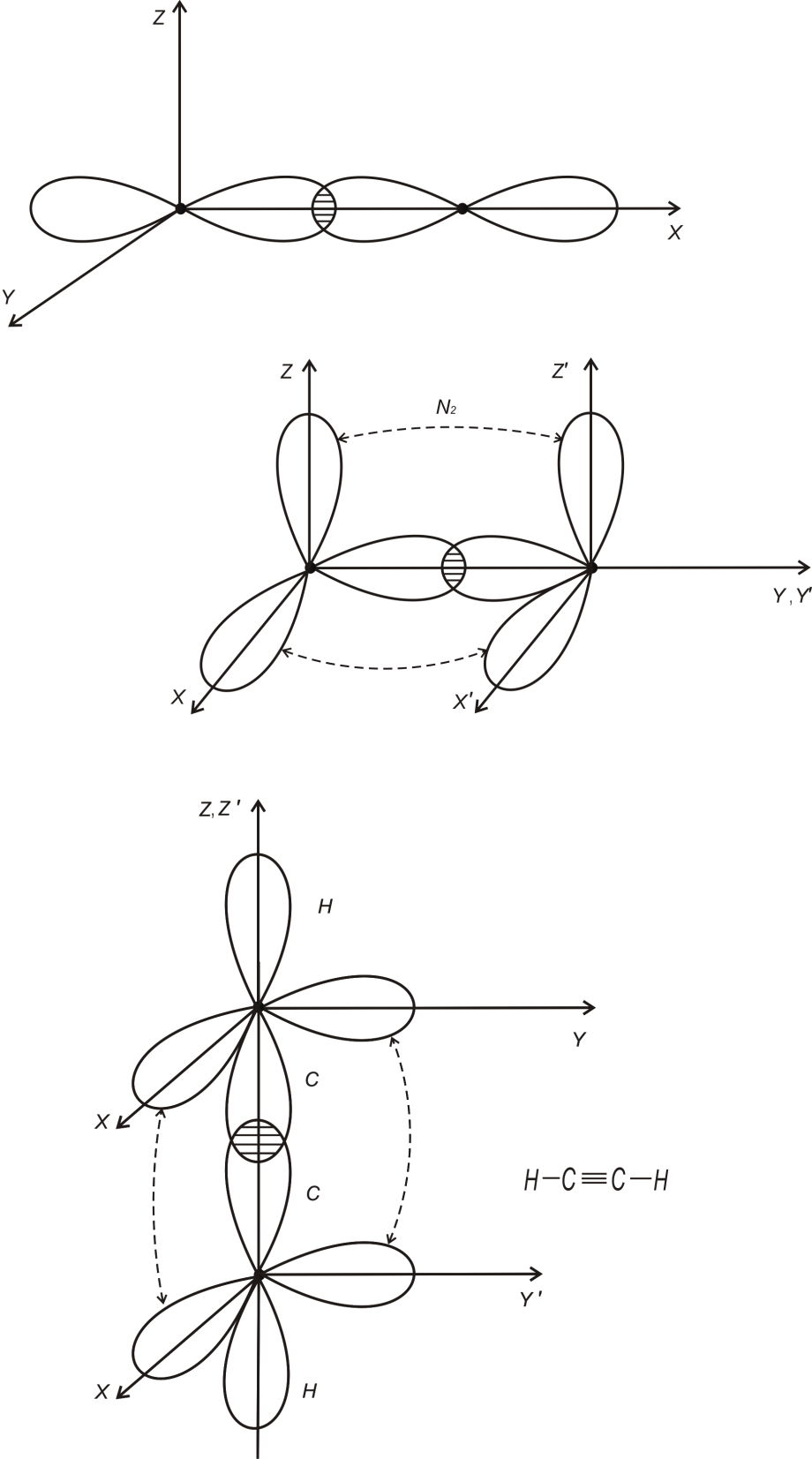
Рис.1.2.
Кожний
з атомів азоту має три “пелюстки”. Тому
при їх зближенні і утворенні молекули
її вісь відповідає напрямку, вздовж
якого перекривається пара однакових
орієнтовних “пелюстків” (наприклад,
вісь Y).
Зв’язок, який виникає при цьому найбільш
міцний і називається
 -зв’язком.
Хвильові функції решти електронів
вздовж осей X
і Z
перекриваються незначно. У зв’язку з
великим взаємним відхиленням цих
областей відповідні зв’язки, які
утворюються, значно слабші. Їх називають
-зв’язком.
Хвильові функції решти електронів
вздовж осей X
і Z
перекриваються незначно. У зв’язку з
великим взаємним відхиленням цих
областей відповідні зв’язки, які
утворюються, значно слабші. Їх називають
 -зв’язками.
Зв’язки
-типу
легко руйнуються і дозволяють отримувати
нові з’єднання. Однак роль цих зв’язків
значна, особливо в з’єднаннях карбону.
Прикладом потрійного зв’язку може бути
молекула ацетилену C2H2
(рис.1.3)
-зв’язками.
Зв’язки
-типу
легко руйнуються і дозволяють отримувати
нові з’єднання. Однак роль цих зв’язків
значна, особливо в з’єднаннях карбону.
Прикладом потрійного зв’язку може бути
молекула ацетилену C2H2
(рис.1.3)
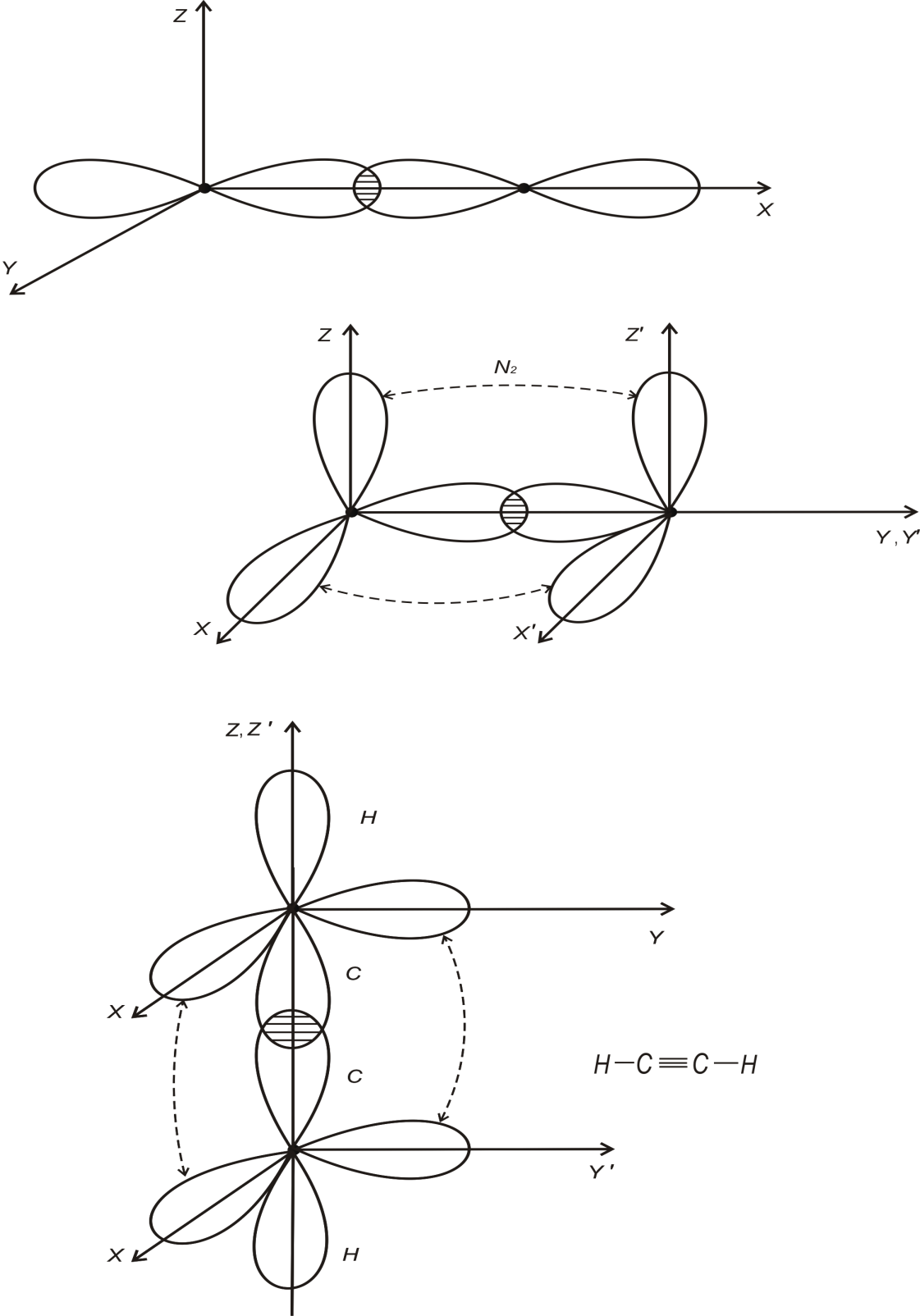
Рис.1.3
Два зв’язки між атома С – це зв’язки -типу, вони орієнтовані вздовж осей X або Y; решта С-С зв’язки відносяться до зв’язків - типу. За рахунок таких зв’язків молекула C2H2 – лінійна. Подвійний зв’язок спостерігається в молекулах етилену C4H2 (рис.1.4)
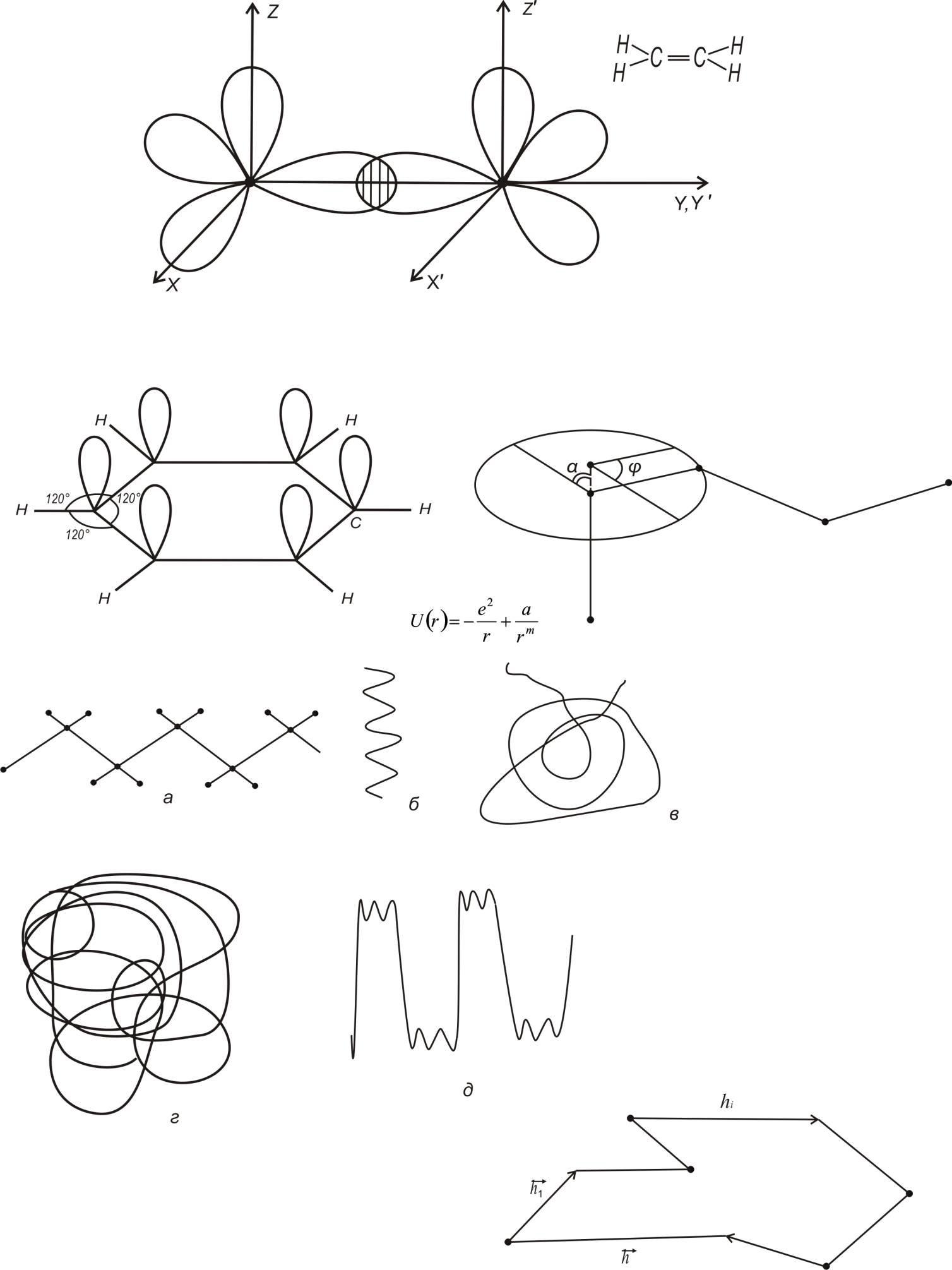
Рис.1.4.
У цьому випадку кожний атом С має три рівноцінних -зв’язки: С-С; С-Н; С-Н. Тому зв’язки групи CH2 розміщені в площині під кутом 1200. Враховуючи, що максимальне перекриття хвильових функцій в -зв’язках досягається за рахунок паралельності їх напрямків, отримують плоску структуру молекули етилену.
У розглянутих вище зв’язках приймають участь електрони двох сусідніх атомів. Утворені таким чином зв’язки називають локалізованими. Зовсім інший зв’язок спостерігається в молекулах типу бензолу C6H6. У цій молекулі три електрони кожного атома С приймають участь в утворенні трьох -зв’язків: один з атомом Н і два з сусідніми атомами С. Оскільки ці зв’язки рівноцінні, вони утворюють плоску структуру з кутом 1200 між зв’язками. Крім того, у кожному атомі С наявний один неспарений електрон, здатний утворювати зв’язок -типу. Внаслідок цього молекула C6H6 є плоским правильним шестикутником (рис.1.5)
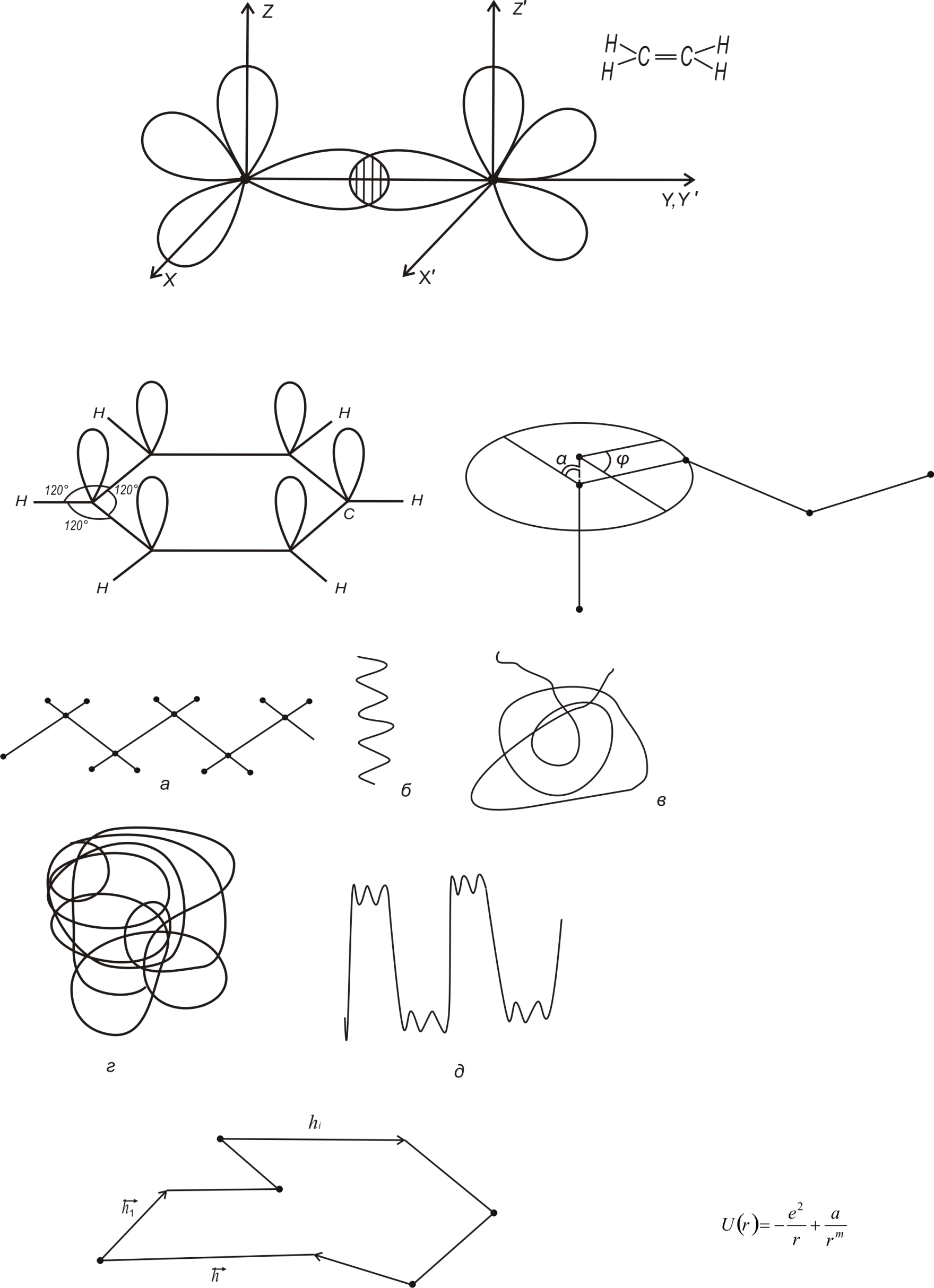
Рис.1.5.
Проте у молекулі бензолу є відмінності від інших кратних зв’язків, а саме: у молекулі C6H6 на кожний -зв’язок припадає по два електрони; для шести -зв’язків наявні не 12, а лише 6 електронів. Оскільки молекула бензолу симетрична, то це означає, що на кожний -зв’язок між атомами С припадає половина локалізованого -зв’язку. З точки зору квантової механіки, цей факт трактується таким чином: кожний неспарений електрон у зовнішньому шарі атома карбону бере участь в обміні одночасно з електронами обох сусідніх атомів. Виникаючий при цьому -зв’язок “нелокалізований”, бо він для кожного атома С здійснюється і з “лівим”, і з “правим” електронами. Оскільки всі атоми карбону рівноправні, зв’язок має місце між усіма атомами карбонового кільця у молекулі бензолу. Така “делокалізація” -зв’язку приводить до його зміцнення. Таким чином енергія дисоціації “нелокалізованого” зв’язку значно перевищує енергію дисоціації у випадку чергування трьох одинарних і трьох подвійних зв’язків. Крім того, електрони, які приймають участь у “нелокалізованому” -зв’язку, дуже рухливі. Вони здатні переміщуватися за рахунок тунельного ефекту від одного атома вуглецю до іншого. “Нелокалізований” -зв’язок у молекулі бензолу може служити моделлю так званого металічного зв’язку характерного для кристалів, металів і деяких інших речовин [7].
Розгляд полімерних матеріалів показав, що міжатомна взаємодія в них і низькомолекулярних речовинах за своїм характером не має принципової різниці.
