
- •Классификация. Номенклатура.
- •1) Кислотность
- •2) Образование полных и неполных эфиров с неорганическими и органическими кислотами.
- •3) Окисление диолов
- •4) Дегидратация
- •Методы получения.
- •1. Классификация и номенклатура
- •2. Методы получения
- •3. Физические свойства и строение
- •4. Химические свойства
3. Физические свойства и строение
Фенолы – жидкие или кристаллические вещества с сильным характерным запахом. При хранении на воздухе быстро темнеют из-за окисления. Ограниченно растворимы в воде.
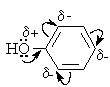
Гидроксигруппа и ароматическое кольцо образуют сопряженную систему. Гидроксигруппа проявляет электронодонорные свойства за счет +М-эффекта, который превышает по силе –I-эффект.
Фенол и его гомологи – полярные соединения. Дипольный момент направлен в сторону бензольного кольца. Взаимодействии неподеленной пары электронов кислорода с -системой кольца обусловливает электронодонорные свойства этих соединений. Энергия ионизации фенола составляет 8,5-8,6 эВ, что ниже, чем у бензола и спиртов.
Спектральные характеристики.
Введение гидроксильной группы в бензольное кольцо вызывает сдвиг полос поглощения в УФ-спектрах в длинноволновую область и усиливает их: 210 ( 6200) и 270 ( 1450) нм.
В ИК-спектрах характеристические полосы поглощения валентных колебаний группы ОН лежат в области 3390-3600 см-1 и зависят от растворителя и концентрации.
В спектрах ПМР сигнал протонов группы ОН находится в широком диапазоне и зависит от температуры, концентрации, рН и растворителя (в дейтерохлороформе 4,5-7,5 м.д.)
4. Химические свойства
Для фенолов характерны нуклеофильные свойства, которые усиливаются при превращении их в феноксид-анионы в результате ионизации полярной связи О-Н. При этом электрофилы могут реагировать как по атому кислорода, так и по атомам углерода ароматического кольца фенолов или феноксид-анионов.
Кислотные свойства
Фенолы являлются слабыми ОН-кислотами, но значительно превосходят по кислотности спирты. Например, фенол в 108 раз более сильная ОН-кислота по сравнению с циклогексанолом.
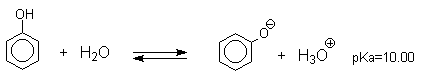
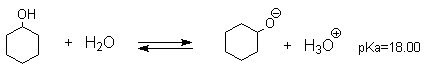
Причина более высокой кислотности фенолов состоит в стабилизации феноксид-аниона за счет делокализации отрицательного заряда с участием ароматического кольца.

Влияние заместителя в бензольном кольце на кислотность фенолов согласуется с представлениями об их электронных эффектах. Электроноакцепторные заместители, особенно в орто- и пара-положениях, усиливают, а электронодонорные - понижают кислотные свойства фенолов.
Величины рКа орто-, мета- и пара-замещенных фенолов в воде при 25оС
Заместитель |
орто |
мета |
пара |
Заместитель |
орто |
мета |
пара |
H |
10.00 |
10.00 |
10.00 |
F |
8.73 |
9.29 |
9.89 |
CH3 |
10.29 |
10.09 |
10.26 |
Cl |
8.56 |
9.12 |
9.41 |
C(CH3)3 |
10.62 |
10.12 |
10.23 |
Br |
8.45 |
9.03 |
9.37 |
C6H5 |
10.01 |
9.64 |
9.55 |
I |
8.51 |
9.03 |
9.33 |
OCH3 |
9.98 |
9.65 |
10.21 |
NO2 |
7.23 |
8.36 |
7.15 |
Большинство фенолов легко растворяется в водных растворах щелочей МОН с образованием фенолятов ArOM.
Получение простых и сложных эфиров фенолов
Нуклеофильные свойства атома кислорода фенолов понижены по сравнению со спиртами в результате сопряжения. Как следствие этого ариловые эфиры карбоновых кислот нельзя получать прямой этерификацией фенолов карбоновыми кислотами. Сложные эфиры получают ацилированием фенолов или их Na-и K-солей галогенангидридами или ангидридами кислот.
ArOH + RCOX RCOOAr + HX
ArO-Na+ + RCOX RCOOAr + NaX
(X=Cl, OCOR)
Феноляты легко алкилируются , алкилгалогенидами и диалкилсульфатами с образованием простых эфиров.
ArO-Na+ + RX ArOR + NaX
(X=Hal, ROSO3)
Метиловые эфиры фенолов получают также действием диазометана в эфирном растворе.
ArOH + CH2N2 AROCH3 + N2
В отличие от спиртов фенолы как более сильные кислоты метилируются диазометаном в отсутствие катализатора.
Перегруппировка Кляйзена аллилариловых эфиров
Аллиловый эфир фенола при нагревании до 200-220оС превращается в орто-аллилфенол, т.е. аллильная группа мигрирует в орто-положение бензольного кольца.
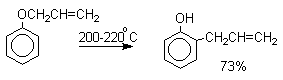
Если оба орто-положения заняты заместителями, то аллильная группа перемещается в пара-положение:

Установлено, что и орто- и пара-перегруппировки являются внутримолекулярными реакциями первого порядка. Миграция в орто-положение сопровождается инверсией аллильной группы, т.е. она присоединяется к бензольному кольцу -углеродным атомом.

Из этого следует, что переходное состояние перегруппировки Кляйзена должно быть циклическим шестизвенным. Такое переходное состояние включает шесть -электронов и является ароматическим, что составляет движущую силу этой термической перегруппировки. На последней стадии происходит изомеризация циклогексадиенона в о-аллилфенол. Эта стадия аналогична изомеризации кетона в енольную форму.
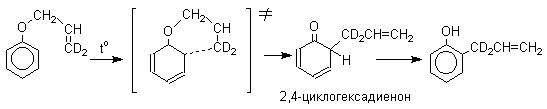
2,4-Циклогексадиенон является интермедиатом перегруппировки аллилариловых эфиров. Такой интермедиат может быть выделен при перегруппировке аллилового эфира 2,6-диметилфенола, когда аллильная группа мигрирует в пара-положение, поскольку енолизация кетона в фенол в этом случае не может происходить из орто-положения. Конечным результатом двух последовательных миграций аллильной группы является сохранение структуры мигрирующей группы.
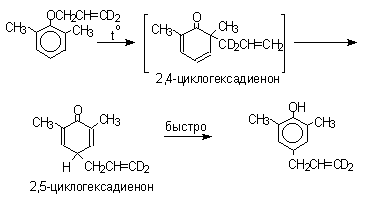
Кроме того, при проведении перегруппировки в присутствии малеинового ангидрида 2,4-циклогексадиенон улавливается в виде аддукта диенового синтеза.
Реакции электрофильного замещения в ароматическом кольце
Гидроксильная группа относится к числу групп, активирующих электрофильное замещение в ароматическом кольце и направляющих заместитель в орто- и пара-положения. Фенолы вступают практически во все типичные реакции электрофильного замещения как с сильными, так и со слабыми электрофильными агентами.
Галогенирование
Галогенирование фенолов не требует катализа кислотами Льюиса и легко осуществляется под действием молекулярного галогена. Галогенирование фенола молекулярным бромом или хлором в полярной среде практически невозможно остановить на стадии моногалогенирования, поскольку реагирующей частицей здесь является фенолят-ион, который содержит очень сильную активирующую группу –O-. Скорость галогенирования фенолят-иона по крайней мере в тысячу раз выше, чем фенола. Галогензамещенный фенол является более сильной кислотой, чем сам фенол, что облегчает введение второго и третьего атома галогена в орто- и пара-положения.

Бромирование фенола в воде приводит к образованию нерастворимого 2,4,6-трибромфенола. Эта реакция настолько чувствительна, что позволяет обнаружить фенол в концентрации 10-5М в водном растворе. 2,4,6-Трибромфенол взаимодействует еще с одним молем брома с образованием 2,4,4,6-тетрабромциклогекса-2,5-диенона, окрашенного в желтый цвет.

При обработке продукта этой реакции раствором гидросульфита натрия или другого слабого восстановителя он легко превращается в исходный 2,4,6-трибромфенол. При бромировании фенола в растворе бромистоводородной кислоты диссоциация полностью подавляется и галогенированию подвергается сам фенол. При этом в зависимости от условий и количества галогена может быть получен п-бромфенол или 2,4-дибромфенол.

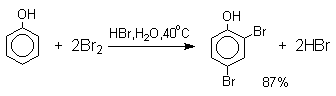
Аналогичным образом протекает хлорирование фенола хлором в соляной кислоте, но здесь получается значительное количество о-хлорфенола. Моногалогензамещенные производные фенолов удобно получать при галогенировании в неполярной среде, что также исключает диссоциацию фенолов.


В качестве галогенирующего агента кроме самих галогенов можно использовать комплексы галогенов с диоксаном, ДМФА.

Во всех случаях соотношение пара/орто-изомеров при бромировании и иодировании значительно выше, чем при хлорировании.
Нитрование
Нитрование фенолов разбавленной 20-25%-ной азотной кислотой приводит к получению смеси орто- и пара-нитрофенолов.

Даже в таких мягких условиях нитрование сопровождается окислением фенола и этот процесс становится доминирующим, если для нитрования использовать концентрированную азотную кислоту. Поэтому для получения 2,4,6-тринитрофенола (пикриновой кислоты) используют видоизмененный способ нитрования. Фенол первоначально сульфируют до 4-гидрокси-1,3-бензолдисульфокислоты, а затем нитруют азотной кислотой.
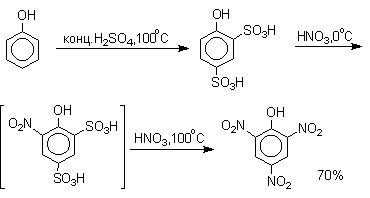
Вторая стадия по существу представляет собой электрофильное ипсо-замещение сульфогруппы на нитрогруппу. Для нитрования фенолов в качестве нитрующего агента кроме азотной кислоты можно использовать ацетилнитрат и N2O4. Эти реагенты способствуют преимущественному нитрованию в орто-положение к гидроксильной группе.
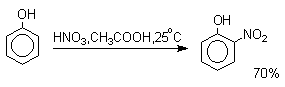

Сульфирование
Моносульфирование фенола серной кислотой приводит к образованию смеси орто- и пара-изомеров гидроксибензолсульфоксилоты. При 20оС в реакционной смеси содержится 49% орто-изомера и 51% пара-изомера, тогда как при 120оС доля пара-изомера возрастает до 96%.
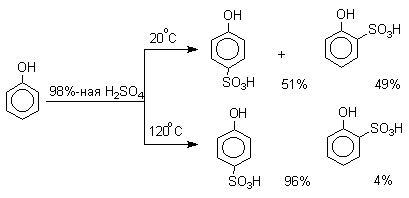
Изменение в соотношении продуктов сульфирования обусловлено обратимостью реакций, когда в равновесии преобладает термодинамически более стабильный пара-изомер. Сульфирование в орто-положение протекает с большей скоростью, но орто-гидроксибензолсульфокислота легко гидролизуется на исходные реагенты в отличие от пара-изомера, для которого скорость гидролиза мала.
Нитрозирование
Нитрозирование фенолов осуществляется с помощью азотистой кислоты в воде или уксусной кислоте. Эта реакция отличается очень высокой региоселективностью и замещение идет в пара-положение к гидроксильной группе. Типичное распределение орто- и пара-изомеров при нитрозировании можно проиллюстрировать на примере самого фенола.

Алкилирование и ацилирование по Фриделю-Крафтсу
Так как фенолы взаимодействуют с галогенидами алюминия и другими кислотами Льюиса с образованием солей типа ArOAlCl2, прямое их алкилирование в условиях реакции Фриделя-Крафтса провести не удается. Фенолы алкилируют алкенами и спиртами в условиях кислотного катализа. В качестве катализаторов предпочитают использовать серную, фтористоводородную, фосфорную кислоты или катиониты КУ-2 и другие катионообменные смолы. Таким образом, из крезола и изобутилена в промышленности получают пространственно затрудненный фенол - 2,6-ди-трет-бутил-4-метилфенол (ионол), который широко применяется для стабилизации полимеров.
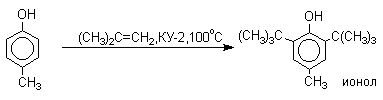
Аналогично из фенола и изопропилового спирта получается 2,4,6-триизопропилфенол.
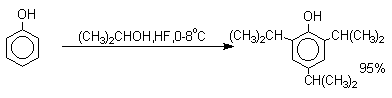
Ацилирование фенолов в классических условиях реакции Фриделя-Крафтса комплексом ацилгалогенида и хлорида алюминия приводит к неудовлетворительным результатам, так как ацилированию подвергается гидроксильная группа фенола. Более эффективна такая модификация этого метода, когда в качестве ацилирующего агента используется комплекс карбоновой кислоты и трехфтористого бора. Ацильная группа при этом вводится практически исключительно в пара-положение бензольного кольца. Так, например, фенол при взаимодействии с комплексом уксусной кислоты и BF3 дает пара-гидроксиацетофенон с 95%-ным выходом.

Наиболее общий метод получения гидроксикетонов ароматического ряда основан на перегруппировке Фриса. Ариловые эфиры карбоновых кислот при нагревании с AlCl3 или AlBr3 перегруппировываются в изомерные орто- и пара-гидроксикетоны.
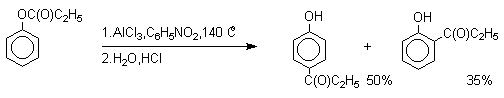
Соотношение орто- и пара-изомеров зависит главным образом от температуры и растворителя. В более жестких условиях преобладает орто-гидроксикетон, а при 20-25оС - пара-гидроксикетон.

Механизм перегруппировки Фриса, по-видимому, заключается в межмолекулярном ацилировании орто- или пара-положения бензольного кольца арилового эфира комплексом второй молекулы сложного эфира и AlCl3 с образованием ацильного производного гидроксикетона и фенола.

Перегруппировка завершается межмолекулярным переносом ацильной группы к фенолу.
Формилирование
Формилирование – это введение группы СНО (см. лек.35). Синтетически наиболее важными являются формилирование фенолов по Вильсмейеру-Хааку и Реймеру-Тиману.
Реакция Вильсмейера-Хаака
N-Алкиламиды муравьиной кислоты - N,N-диметилформамид (ДМФА) и N-метилформамид в присутствии хлорокиси фосфора являются региоселективными формилирующими агентами. С помощью этих реагентов альдегидная группа вводится в пара-положение по отношению к ОН -группе. Эту реакцию можно также рассматривать как ацилирование, где роль катализатора (кислоты Льюиса) выполняют хлорокись фосфора (POCl3). Наиболее эффективна система ДМФА-POCl3, в которой ДМФА служит и реагентом, и растворителем. Электрофильным агентом в реакции Вильсмейера-Хаака является иминиевая соль, которая образуется при взаимодействии ДМФА и хлорокиси фосфора.
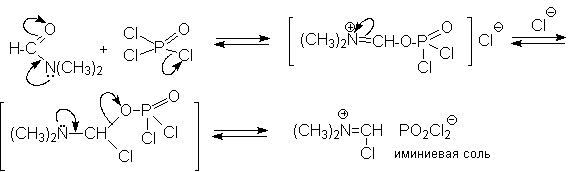
Иминиевая соль при необходимости может быть выделена в индивидуальном виде, однако обычно ее не выделяют и используют непосредственно после ее образования.

Реакция Вильсмейера-Хаака чрезвычайно проста в экспериментальном отношении и обеспечивает очень высокие выходы ароматических гидроксиальдегидов.
Реакция Реймера-Тимана
Формилирование фенолов по Реймеру-Тиману достигается при нагревании смеси фенола и большого избытка хлороформа с водным раствором гидроксида натрия при 50-70оС. Выходы альдегидов обычно невелики и редко превышают 30%, однако метод исключительно прост и доступен в практическом отношении. Главное достоинство реакции Реймера-Тимана заключается в преимущественном образовании орто-, а не пара-изомеров, как это имеет место в реакции Вильсмейера-Хаака.

Механизм включает образование дихлоркарбена как интермедиата. Дихлоркарбен :CCl2 выполняет роль электрофильного агента по отношению к феноксид-иону, образующемуся в щелочной среде. Предполагаемый механизм реакции Реймера-Тимана может быть представлен следующей последовательностью превращений:

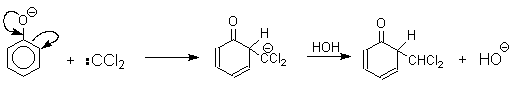
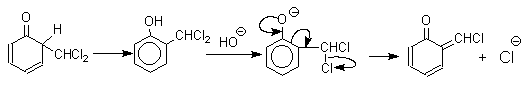

Реакция протекает только в сильно щелочной среде при наличии фенольного гидроксила, тогда как простые эфиры фенолов и диалкиланилины не формилируются в этих условиях.
Карбоксилирование феноксид-ионов (реакция Кольбе)
Будучи сильными нуклеофилами феноксид-анионы способны взаимодействовать с таким слабым электрофильным реагентом как оксид углерода (IV). При нагревании сухих фенолятов натрия или лития с СО2 при повышенном давлении, образуются натриевые или литиевые соли салициловой кислоты.
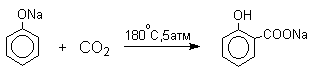
В аналогичных условиях из фенолятов калия, рубидия и цезия получаются только соли пара-гидроксибензойной кислоты.
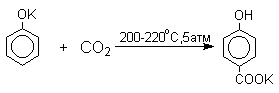
Такое различие в направлении карбоксилирования Na- и К-солей фенола принято объяснять различием в хелатообразовании этих двух катионов с атомом кислорода CO2 в переходном состоянии реакции, приводящем к салициловой кислоте. Катионы натрия и, особенно, лития значительно более эффективны по сравнению с катионом калия в способности к образованию координационной связи с атомом кислорода.
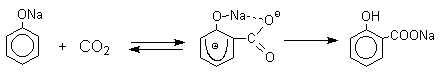
Предполагается, что для фенолятов калия, рубидия и цезия электрофильная атака осуществляется исключительно в пара-положение без какой-либо координации катиона по атому кислорода.
В отличие от одноатомных фенолов двухатомные и трехатомные фенолы карбоксилируются в более мягких условиях. Так, резорцин карбоксилируется при пропускании СО2 в водный раствор его дикалиевой соли при 50оС. При этом образуется 2,4-дигидроксибензойная кислота.

Конденсация с альдегидами и кетонами
Фенолы реагируют с формальдегидом в водном растворе в присутствии основания с образованием полимерного продукта, получившего название феноло-формальдегидной смолы, карболита или бакелита.
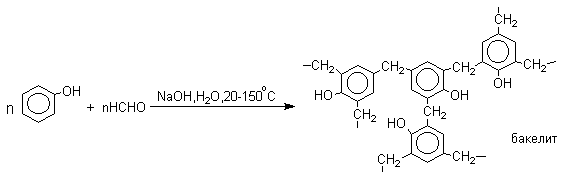
Взаимодействие феноксид-иона с формальдегидом напоминает альдольную конденсацию с той лишь разницей, что роль нуклеофильного агента вместо енолят-иона выполняет амбидентный феноксид-ион, а карбонильной компонентой является формальдегид.

Подобно альдолям, орто- и пара-изомеры гидроксиметилфенола подвергаются дегидратации с образованием хинонметидов - соединений, родственных орто- и пара-хинонам.


Последующее присоединение феноксид-иона к хинонметиду представляет собой присоединение амбидентного аниона к , -непредельному кетону по Михаэлю.

В результате дальнейшей поликонденсации в орто- и пара-положение к гидроксигруппе фенола получается трехмерная структура конечного продукта - бакелита. Бакелит представляет собой прозрачную смолу, в которой линейные звенья связаны "поперечными" связями впара-положениях.
Фенол конденсируется с ацетоном в кислой среде с образованием так называемого бисфенола А.
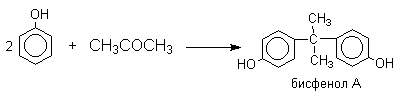
Получено много подобных продуктов конденсации фенолов с кетонами. Они находят применение в качестве антиоксидантов и мономеров для получения эпоксидных смол.
Окисление
Окисление фенолов относится к числу сложных, многостадийных процессов, приводящих к продуктам разного строения. Механизм окисления может сильно меняться в зависимости от строения фенола и природы одно- или двухэлектронного окислителя. Механизм окисления включает стадию образования стабилизированных резонансом ароксильных радикалов.
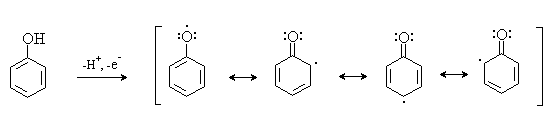
Направление дальнейших превращений зависит от характера заместителей в ароматическом кольце. При окислении большинства фенолов образуется несколько различных форм димеров в результате образования новых связей С-С между орто-орто, орто-пара- и пара-пара-положениями ароксильных радикалов, а также новых С-О связей между атомом кислорода одного радикала и орто- или пара-положением другой радикальной частицы. Всего, таким образом, образуется потенциально не менее пяти различных типов димеров, которые находится в равновесии с исходным ароксильным радикалом. Например, для монозамещенного фенола:

Димеры, возникающие в результате рекомбинации радикалов с образованием новой С-С связи, называются хинолидами. Хинолиды далее изомеризуются с образованием изомерных дигидроксибифенилов. Другой тип димеров, содержащих центральную связь С-О, носит название хиноловыхэфиров.
Ароксильные радикалы пространственно затрудненных фенолов, содержащие в обоих орто- и пара-положении третичные алкильные группы, мономерны и не проявляют тенденции к образованию димеров в растворе. Например, при окислении 2,4,6-три-трет-бутилфенола гексацианоферратом(III) калия K3Fe(CN)6 в бинарной системе бензол-вода в инертной атмосфере образуется устойчивый радикал одновалентного кислорода - три-трет-бутилфеноксил, окрашенный в синий цвет.
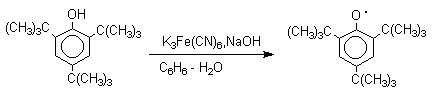
Этот радикал находится в мономерной форме в 0,1 молярном растворе в бензоле или эфире, а также в кристаллическом состоянии. Он очень чувствителен к действию кислорода воздуха, оксида азота (IY), оксида азота (II) и других радикальных частиц. Стабильность ароксильных радикалов пространственно затрудненых фенолов обусловливает их антиокислительные свойства. Они выполняют роль ловушек свободных радикалов в процессах пероксидного окисления. Активный свободный радикал, ведущий цепь окисления, быстро взаимодействует с таким фенолом, давая устойчивый ароксильный радикал, что приводит к обрыву цепи.
ArOH + RO2 ArO + ROOH
Пространственно затрудненные фенолы (ионол, гальваноксил) используют как антиоксиданты, стабилизирующие синтетические каучуки, пищевые жиры, витамины и др.
Лекция №30
ПРОСТЫЕ ЭФИРЫ
План
Классификация и номенклатура простых эфиров.
Способы получения диалкиловых эфиров, их физические и химические свойства.
Циклические эфиры.
Оксираны и краун – эфиры.
Простые эфиры можно рассматривать как производные спиртов, в которых атом водорода гидроксильной группы замещен на углеводородный радикал.
По характеру атомов углерода, связанных с кислородным атомом, простые эфиры можно подразделить на следующие типы:
1. Эфиры, содержащие связи С(sp3)O.
К ним относятся эфиры структуры ROR/и циклические эфиры.
![]() 2.
Эфиры содержащие связь С(sp2)O
2.
Эфиры содержащие связь С(sp2)O
К ним относятся
алкилалкениловые (виниловые) эфиры
![]()
диалкениловые эфиры
![]()
алкилариловые эфиры
![]()
диариловые эфиры
![]() 3.
Эфиры, содержащие связь С(sp)O
3.
Эфиры, содержащие связь С(sp)O
RC C-OR/
Диалкиловые эфиры
Диалкиловые эфиры являются наиболее важными представителями класса простых эфиров. Их эмпирическая формула СnH2n + 2O или СnH2n + 1OCmH2m + 1.
Изомерия и номенклатура
Наименование диалкиловых эфиров по рациональной номенклатуре образуют путем перечисления заместителей и прибавления слова "эфир".
Номенклатура IUPAC рассматривает эфир как производное углеводорода, замещенного на алкоксигруппу, причем в основе названия лежит наиболее длинная углеводородная цепь.

Способы получения диалкиловых эфиров
Синтез Вильямсона.
![]()
Можно видеть, что этот способ удобен для получения несимметричных эфиров.
Межмолекулярная дегидратация спиртов.
![]()
Реакция эффективна при получении симметричных эфиров. Следует иметь в виду, что при повышении температуры будет прогрессировать реакция нуклефильного отщепления, особенно если обьектом дегидратации являются разветвленные спирты (вторичные и третичные)
Алкилирование спиртов алкенами.

Функция кислоты – катализатора заключается в генерировании карбкатионов, которые эффективно атакуются нуклеофилом – спиртом:
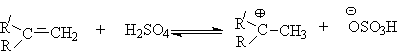
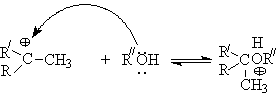
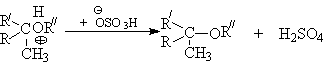
Эффективность реакции определяется стабильностью карбкатиона, поэтому соблюдается следующий ряд реакционной способности алкенов.
![]()
Алкоксимеркурирование алкенов.
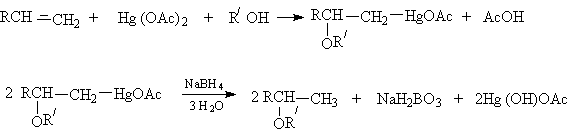
или суммарно
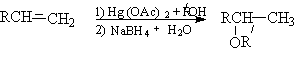
Физические свойства и строение
Простые эфиры являются бесцветными жидкостями (кроме диметилового эфира) со своеобразным запахом и низкими температурами кипения, что свидетельствует о слабом межмолекулярном взаимодействии. Это является показателем низкой полярности диалкиловых эфиров и отсутствия (в отличие от спиртов) предпосылок для образования водородных связей. В отличие от спиртов эфиры обладают более сильными электронодонорными свойствами, о чем свидетельствует значение потенциалов ионизации. Увеличение электронодонорных свойств обьясняется положительным индуктивным эффектом алкильных групп. Валентный угол приближается к тетраэдрическому и равен109–1120.
Химические свойства
Основность
Основность простых эфиров проявляется в их взаимодействии с кислотами Бренстеда и Льюиса. С Бренстедовскими кислотами умеренной силы взаимодействие осуществляется посредством водородной связи.

В случае сильных Бренстедовских кислот происходит протонирование эфиров и образование оксониевых кислот.
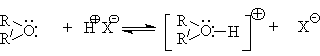
Простые эфиры – слабые основания и начинают протонироваться в ощутимых количествах в растворе 30 - 40%-ной серной кислоты.
С кислотами Льюиса диалкиловые эфиры образуют стабильные продукты присоединения – эфираты.
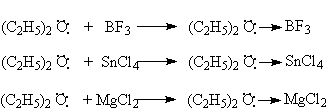
В этих соединениях образуется донорно–акцепторная связь за счет неподеленной пары атома кислорода.
Способность простых эфиров сольватировать катионы различных металлов имеет исключительное значение для получения металоорганических соединений в растворах диалкиловых эфиров или тетрагидрофурана.
Реакции при - углеродном атоме диалкиловых эфиров.
Простые эфиры могут вступать в реакции свободнорадикального хлорирования и автоокисления, причем обьектом этих реакций является - углеродный атом эфиров.

Основанием для такого направления является стабильность - алкилалкоксирадикалов,

обуслoвливающая энергетическую выгодность реакции инициирования (в случае автоокисления) и развития цепей (в случае автоокисления и хлорирования)
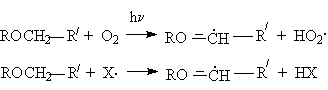
где Х. – радикал цепи при хлорировании (Cl.) и автоокислении
![]()
Образующиеся в результате автоокисления гидропероксиды являются взрывчатыми веществами. Они могут образовываться в эфирах при хранении в условиях доступа воздуха и в прозрачных бутылках. Поэтому эфиры после длительного хранения перед употреблением подлежат обработке с целью разрушения гидропероксидов.
Реакции расщепления С О – связи
Эфиры расщепляются под действием сильных кислот, например, иодоводородной, бромоводородной, суперкислот:
![]()
![]()
При действии суперкислот на эфиры при низких температуах генерируются карбкатионы, которые могут претерпевать различные перегруппировки и распад до алкенов.

При этом легче расщепляются простые эфиры, которые содержат разветвленные группы, так как в результате протонирования образуются более устойчивые карбкатионы.
Алкилвиниловые эфиры.
Методы получения
Винилирование спиртов
![]()
Дегидрогалогенирование - галогендиалкиловых эфиров
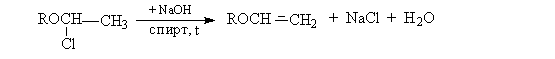
Химические свойства алкилвиниловых эфиров
Основными реакциями алкилвиниловых эфиров являются:
Электрофильное присоединение
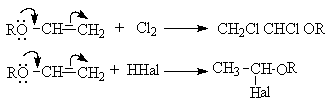
Можно показать, что порядок присоединения HНal и других протонных кислот определяется стабильностью промежуточных карбкатионов.
Полимеризация
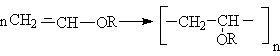
Эти реакции могут осуществляться по свободнорадикальному или карбкатионному механизмам. В первом случае в качестве инициаторов используют органические пероксиды или азобисизобутилонитрил, во втором - реакции катализируются протонными кислотами, причем во избежание электрофильного присоединения кислоты - катализатора НХ к двойной связи, кислоте должен соответствовать слабый нуклефил Х.
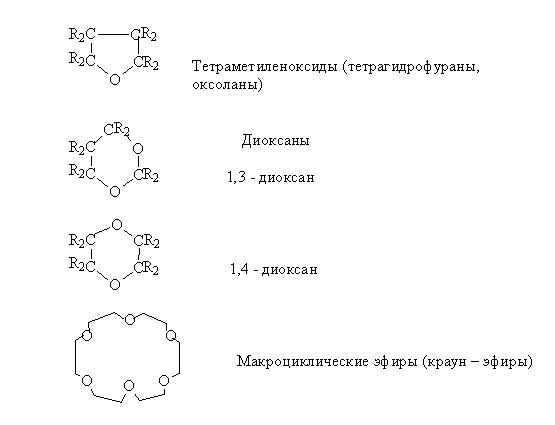
Циклические эфиры
Циклические эфиры – производные алкандиолов, в которых эфирная связь образована внутримолекулярно.
Циклические эфиры подразделяются на несколько групп в зависимости от величины цикла и числа кислородных атомов в цикле. Их часто называют оксидами.
В этом плане различают:

Эпоксиды (оксираны)
Основу названия этих соединений составляет наименование углеводорода, а на присутствие кислородного мостика указывает приставка "эпокси". Для простейших соединений сохраняется название этиленоксид и пропиленоксид. Используется также номенклатура гетероциклических соединений "оксираны". Например,

Методы получения
Дегидрогалогенирование галогеналканолов (галогенгидринов)
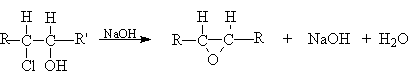
Окисление (эпоксидирование) алкенов (реакция Прилежаева)
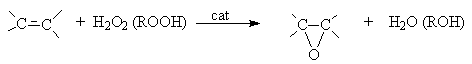
В качестве катализаторов используют кислые соли вольфрамовой кислоты (Н2О2) и соединений молибдена (ROOH). Реакцию можно осуществлять некаталитически, если в качестве эпоксидирующего агента использовать органические надкислоты.
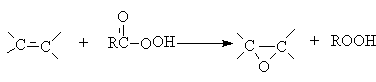
Первый член гомологического ряда этиленоксид, в промышленности получают парофазным окислением кислородом или воздухом.
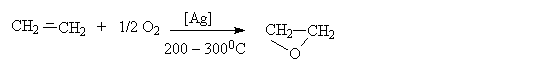
Химические свойства
Химическое поведение оксиранов определяется тремя факторами: поляризацией связей С О с образованием частичного положительного заряда на углероде оксидного цикла, электронодонорными свойствами атома кислорода и напряженностью оксидного цикла. Поэтому наиболее характерными реакциями оксиранов являются реакции нуклеофильного присоединения по положительно заряженному углероду цикла, сопровождающиеся разрывом связи С О цикла, облегчаемым протонированием кислородного атома под действием протонодонорного агента.
Совместное действие этих факторов отчетливо проявляется в некаталитической реакции этиленоксида с водой
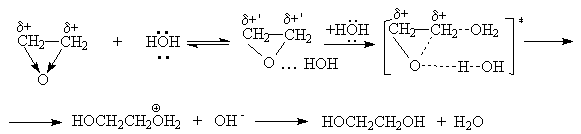
или суммарно:

Эта реакция протекает медленно, поскольку вода является слабым протонодонорным агентом. Для ускорения этой реакции необходимо использовать высокую температуру и давление.
Другие более сильные нуклеофилы (NH3, RNH2, RMgX) реагируют более легко.
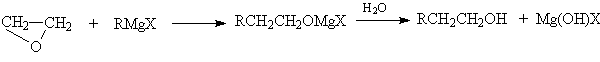
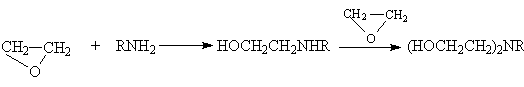
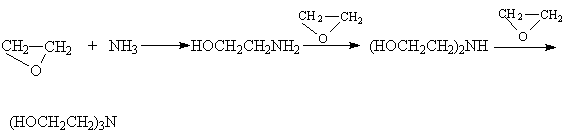
Приведенные реакции имеют важное препаративное и промышленное значение. Получаемый гидратацией этилена этиленгликоль являются антифризом и исходным веществом для синтеза лавсана, этаноламины используются в качестве абсорбентов для извлечения кислых примесей из газов. Оксиэтилирование реактивов Гриньяра – важный способ увеличения длины углеродной цепи органических соединений на два углеродных атома.
Если в реакциях нуклеофильного замещения оксиранов участвуют нуклеофилы HNu, обладающие слабой нуклефильной активностью и слабой кислотностью (H2O, H2S, RSN), то для эффективного проведения этих реакций используют кислотный или основной катализ. Например, кислотно–каталитическая реакция со спиртами связана с эффективным протонированием оксирана, приводящим к увеличению положительного заряда на его углеродных атомах и делающим атаку нуклеофила более эффективной:
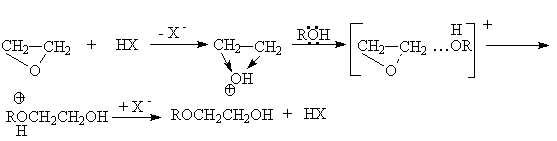
Или суммарно
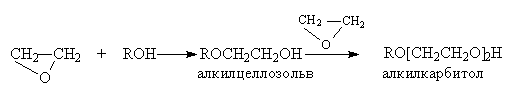
Образующиеся в этих реакциях целлозольвы и карбитолы – универсальные растворители.
При основном катализе под действием основания продуцируется более эффективный нуклеофил, например, в реакциях с ROH, RSH, H2S, HCN, эффективно атакующий углеродный атом оксиранового цикла:
![]()
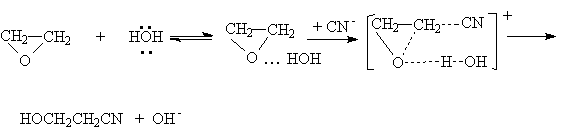
или суммарно:

Краун – эфиры
Краун-эфиры - макроциклические полиэфиры с четырьмя и более кислородными атомами в цикле. В большинстве случаев они являются производными этиленгликоля. В названии соединений цифра в квадратных скобках указывает число атомов в макроцикле, а вторая - число кислородных атомов.
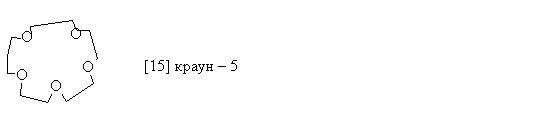
Краун - эфиры получают по реакции Вильямсона из соответствующих гликолятов и дигалогеналканов:
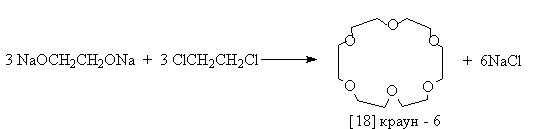
или галогенов , ’ – дигалогеналкиловых эфиров.

Самое важное свойство краун–эфиров – образование комплексов с катионами металлов.

Ион металла находится в полости макроцикла и прочно удерживается благодаря донорно–акцепторным связям кислород – металл, причем чем ближе ионный диаметр металла к диаметру полости, тем устойчивее комплекс.
Краун – эфиры используют для улучшения растворимости неорганических солей в органических растворителях, в качестве межфазных катализаторов, для генерирования несольватированных анионов в неорганических растворителях. Благодаря этому можно ускорить реакцию нуклеофильного замещения этими анионами. Соединения типа краун – эфиров играют большую роль в биологических системах – они осуществляют транспорт ионов через биологические мембраны
