- •Классификация. Номенклатура.
- •1) Кислотность
- •2) Образование полных и неполных эфиров с неорганическими и органическими кислотами.
- •3) Окисление диолов
- •4) Дегидратация
- •Методы получения.
- •1. Классификация и номенклатура
- •2. Методы получения
- •3. Физические свойства и строение
- •4. Химические свойства
ГИДРОКСИЛПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
План
Классификация. Номенклатура.
Методы получения.
Строение.
Физические и химические свойства.
Гидроксилпроизводные следует рассматривать как результат замещения атомов водорода в углеводороде на гидроксильную группу.
Гидроксилпроизводные могут быть подразделены по типу атомов углерода, связанных с гидроксильной группой:
1) гидроксилпроизводные С (SP3) - ОН;
2) гидроксилпроизводные С (SP2) - ОН.
Гидроксилпроизводные С (SP) - ОН неизвестны, известны только их производные - эфиры С(SP) - OR.
Гидроксилпроизводные со связью С (SP3) - ОН
К ним относятся:
а) гидроксилпроизводные алканов и циклоалканов - алканолов и циклоалканолов;
б) гидроксилпроизводные алкенов, алкинов, циклоалкенов, если С С и С С - группы отделены от группы ОН по крайней мере одним атомом углерода в состоянии sp3, например:
СН2 СН СНОН СН С СН2 СН2ОН
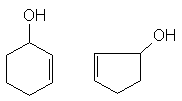
в) гидроксилпроизводные алкиларенов в которых гидроксильная группа находится в алкильном заместителе
ArCH2OH Ar(CH2)nOH
Алканолы (спирты)
Алканолы - результат замещения атомов водорода в алканах на ОН - группы.
Различают одноатомные и многоатомные алканолы. Последние представляют собой результат замещения атомов водорода в алканах при различных углеродных атомах, например:

Эмпирическая формула одноатомных спиртов СnH2n+2O.
Изомерия и номенклатура одноатомных алканолов
В зависимости от типа углеродного атома, с которым связана гидроксильная группа, различают первичные, вторичные и третичные алканолы (спирты):


Согласно заместительной номенклатуре, углеродные атомы цепи нумеруют таким образом, чтобы гидроксильная группа обозначалась меньшим номером. Если гидроксильная группа старшая, то ее обозначают суффиксом “-ол”. Если в молекуле имеются более старшие группы ( С = О, СООН), то гидроксильную группу обозначают префиксом “гидрокси-“ (иногда “окси-”). По радикально-функциональной номенклатуре алканолы называются спиртами, например:
Изомерия алканолов определяется местонахождением гидроксильных групп и разветвлением углеродной цепи. Начиная с бутанола -2, имеет место также стереоизомерия, т.к. появляется хиральный атом углерода.
Методы получения
1. Гидратация
алкенов
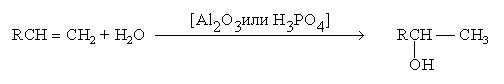 2.
Гидроборирование алкенов
2.
Гидроборирование алкенов
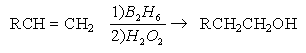
3. Гидролиз галогеналканов
2RCl + Na2CO3 +H2O 2ROH + 2CO2 + 2NaCl
4. Гидрирование карбонильных соединений.
а) Восстановление водородом

Катализаторами этих процессов являются Ni, Pt, Pd.
б) Восстановление алкоголятами

Восстановление осуществляется благодаря переносу гидрид - аниона от алкоголята к карбонильному углероду
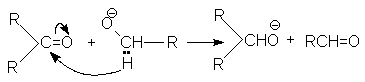
Поэтому в качестве восстанавливающих агентов могут использоваться только первичные или вторичные спирты.
Для смещения равновесия реакцию ведут в режиме выкипания легкокипящего продукта реакции – карбонилсодержащего соединения.
Благодаря этому подавляются также побочные реакции конденсации карбонильных соединений, катализируемые алкоголят-анионами.
Более мягкими восстанавливающими агентами являются алкоголяты алюминия, в которых связи Al О близки к ковалентным, поэтому они плохо диссоциируют на алкоголят - анионы, оказывающие побочное осмоляющее действие:
3R2C O + Al OCH(CH3)2 3 (R2CH)3Al 3(CH3)2C O
Этот метод известен как реакция Меервейна - Понндорфа - Оппеанауэра – Верлея.
в) Восстановление неорганическими гидридами.
Исключительно важное препаративное значение при восстановлении карбонильных соединений приобрели неорганические гидриды – литий алюминий-гидрид LiAlH4 и натрий боргидрид NaBH4. Эти реагенты находят широкое применение, особенно в случае неустойчивых и дорогостоящих карбонильных производных. Хорошим примером может служить восстановление циклобутанона в циклобутанол.

При действии гидридов металлов ключевая стадия состоит в переносе гидрид-иона к карбонильному углероду восстанавливаемого соединения:
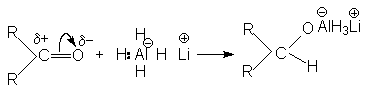
В таких превращениях могут быть использованы все четыре водорода, связанные с алюминием:

или суммарно:
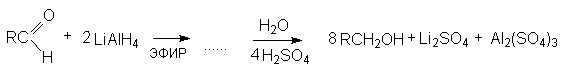
Избыточный литийалюминий гидрид разлагается при действии водной кислоты с выделением водорода:
2LiAlH4 + 4H2SO4 Li2SO4 + Al2(SO4)3 + 4H2
Литийалюминийгидрид обычно восстанавливает карбонильные группы, не затрагивая двойные углерод-углеродные связи. Он, кроме того, является эффективным восстановителем карбонильных групп карбоновых кислот и сложных эфиров, например:
![]()
В отличие от карбоновых кислот сложные эфиры реагируют без выделения водорода

Натрийборгидрид более мягкий восстанавливающий агент: он восстанавливает альдегиды и кетоны, но не кислоты и сложные эфиры. Он сравнительно медленно реагирует с водой в нейтральном или щелочном растворе, что позволяет проводить восстановление в водном растворе без сколько-нибудь значительного гидролиза восстанавливающего агента
NaBH4 + 4CH2=O + 3H2O 4CH3OH + NaH2BO3
5. Взаимодействие карбонильных соединений с реактивом Гриньяра
![]()
Можно видеть, что используя в качестве реагента формальдегид получают первичные спирты, содержащие на один атом углерода больше, чем исходное карбонильное соединение.
б) В то же время, конденсация альдегидов (кроме формальдегида) с реактивами Гриньяра с последующим гидролизом приводит к образованию вторичных спиртов.
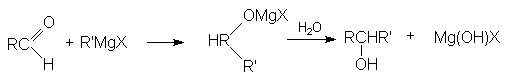
в) В свою очередь, конденсация кетонов с реактивами Гриньяра и последующий гидролиз приводит к образованию третичных спиртов.
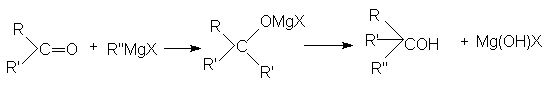
6. Синтез спиртов из синтез-газа
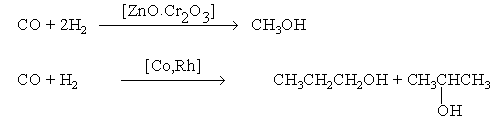
Физические свойства алканолов
Алканолы являются бесцветными жидкостями или кристаллическими веществами с характерным запахом. Первые члены ряда имеют приятный запах, для бутанолов и пентанолов запах становится неприятным и раздражающим. Высшие алканолы имеют приятный ароматический запах.
Отличительная черта алканолов - более высокая температура кипения, чем для соответствующих хлор-, бром- и иодалканов, несмотря на то, что молекулярные массы галогеналканов выше.
Это явление обусловлено сильными межмолекулярными взаимодействиями в спиртах за счет образования водородных связей.

Алканолы содержат две полярные связи С +О и O H . Диполи этих связей направлены навстречу друг другу. Однако результирующий дипольный момент направлен от группы R.
Потенциал ионизации алканолов ниже, чем у воды, что обусловлено +I - эффектом алкильной группы.
Спектры поглощения.
Алканолы в электронных спектрах поглощения являются “прозрачными”. Слабое поглощение наблюдается только в дальней УФ - области (170-180нм), что связано с переходом n неподеленной пары электронов кислорода.
В ИК - спектрах характерные колебания связи ОН в разбавленных растворах углеводородов или галогенуглеводородов наблюдаются в области 3580 - 3650 см1. В концентрированных растворах образуются водородные связи
О H О, поэтому валентные колебания связи О Н смещается в область 3200-3500 см-1.
В спектрах ПМР сигнал группы ОН наблюдается в широком интервале =2 - 4,5 м.д. в зависимости от типа растворителя и концентрации вещества. Характерные сигналы протонов Н С О при = 3,5 - 3,8 м.д.
Химические свойства
Кислотность
Спирты являются слабыми ОН - кислотами, которые проявляются во взаимодействии с сильными основаниями.
ROH + ОН RO + H2O
Это равновесие существенно смещено в левую сторону, т.к. RO- дестабилизирован из-за положительного индуктивного эффекта алкильной группы. Обычно для получения алкоголятов применяют реакцию активного металла с безводным спиртом.
2ROH + 2Na 2RONa + H2
6ROH + 2Al 2Al(OR)3 + 3H2
Высокая основность алкоголятов используется для успешного осуществления реакций дегидрогалогенирования и генерирования карбанионов и других анионов, играющих ключевую роль в реакциях конденсации органических соединений
![]()
В тоже время алкоголят-анионы являются достаточно сильными нуклеофилами, что позволяет использовать их в качестве реагентов в некоторых важных реакциях нуклеофильного замещения, например, в синтезе простых и сложных эфиров.
RHal + R ONa R OR + NaHal

Основность
Неподеленная электронная пара на кислородном атоме гидроксильной группы обуславливает возможность взаимодействия его с электрофильными реагентами с образованием донорно-акцепторной связи, при этом кислородный атом приобретает положительный заряд и образуются оксониевые соединения:
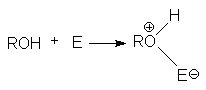
где E - кислота Льюиса, например BF3, AlCl3, PCl3, SOCl2, TiCl4, SnCl4, H+, NO2 и др.
Алканолы являются слабыми основаниями
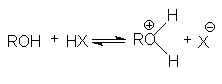
В присутствии сильных концентрированных кислот равновесие в достаточной степени смещено в правую сторону.
Последняя реакция обусловливает легкое отщепление уходящей группы, H2O, и это создает благоприятные условия для реакции нуклеофильного замещения, например, при синтезе простых эфиров.

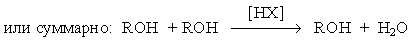
при замещении гидроксильной группы на галоген или другой кислотный остаток

или суммарно:
ROH + HX RX + H2O
при алкилировании аренов спиртами

или суммарно:
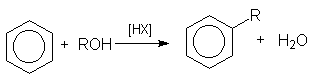
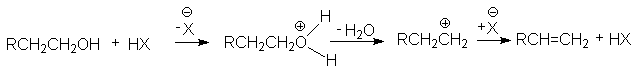
в реакции дегидратации спиртов
в различных перегруппировках, связанных с перегруппировками карбкатиона
а) миграция алкильных групп
б) миграция водорода
в) аллильная перегруппировка
(Подробно о перегруппировках а), б) и в) см. лекцию №23)
г) ретропинаколиновая перегруппировка
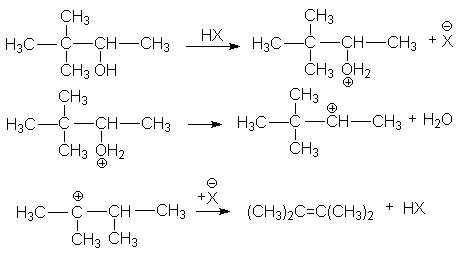
или суммарно:
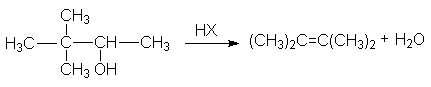
Нуклеофильные свойства спиртов
Нуклеофильные свойства спиртов проявляются при их взаимодействии с галогенангидридами карбоновых и неорганических кислот, которые обладают высокореакционноспособным реакционным центром. Так, при замещении ОН-группы на галоген тионилхлоридом:
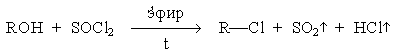
cпирт успешно атакует положительно заряженный атом серы. Последующее отщепление аниона хлора облегчается его протонированием
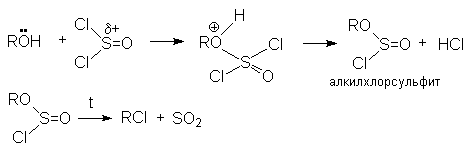
Реакция интересна тем, что она протекает с сохранением конфигурации карбкатионного атома углерода.
Объясняется это тем, что в алкилхлорсульфите конфигурация та же что и в исходном спирте. При нагревании алкилхлорсульфит распадается на ионную пару.
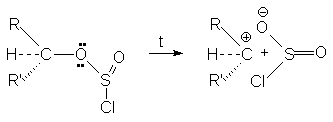
Поскольку анион SO2Cl может атаковать карбкатион с той же стороны, то конфигурация сохраняется. Механизм этих реакций обозначают символом SN i -внутримолекулярное нуклеофильное замещение (substitution nucleofilic intramolecula)
Взаимодействие с галогенидами фосфора
3ROH + PBr3 3RBr + H3PO3
Механизм реакции включает первоначальную атаку бромида фосфора спиртом
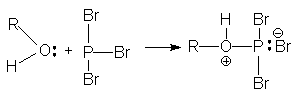
Затем следует SN1 или SN2 замещение фосфорсодержащего фрагмента бромид-анионом.
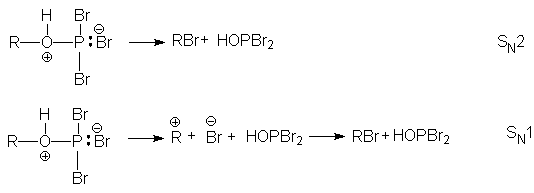
Реакции этерификации
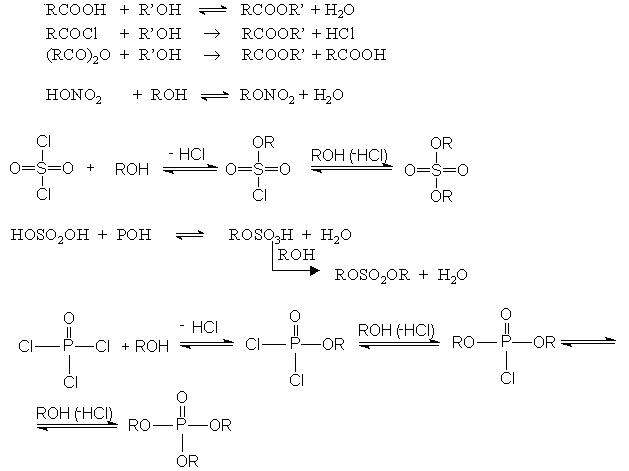
Вследствие большой реакционной способности фосфатов, сульфатов и сульфонатов их используют, если нужно превратить соединение ROH в соединение R - X, где Х - хорошая уходящая группа.
Окисление спиртов
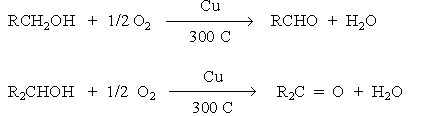
Аналогичный результат получают при действии CrO3 в кислой среде K2Cr2O7, KMnO4 в кислой и нейтральных средах, MnO2 в кислой среде.
Лекция №27
МНОГОАТОМНЫЕ СПИРТЫ. ДИОЛЫ
План
Классификация. Номенклатура.
Способы получения.
Химические свойства.
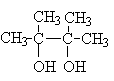
Многоатомные спирты – производные алканов, в которых два или большее число атомов водорода при различных углеродных атомах замещены на гидроксильную группу. Если многоатомные спирты содержат две гидроксильные группы, то они называются диолами или гликолями. Если они содержат три гидроксильные группы, то они называются триолами. Общее название многоатомных спиртов – полиолы. Наиболее важными из многоатомных спиртов являются диолы.
Диолы. Классификация. Номенклатура
В зависимости от взаимного расположения гидроксильных групп различают 1,2– диолы, 1,3–диолы, 1,4–диолы и т.д. У 1,2–диолов группы ОН расположены у двух соседних углеродных атомов, например,

У 1,3–диолов группы ОН расположены при атомах углерода, находящихся в 1,3–положении по отношению друг к другу, например, HOCH2CH2CH2OH. У 1,4– диолов группы ОН расположены при атомах углерода, находящихся в 1,4–положении по отношении друг к другу. 1,2- ,1,3– и 1,4–диолы иногда называют - , - и - гликолями соответственно.
При образовании названий диолов используют номенклатуру IUPAC и тривиальную номенклатуру. В системе IUPAC пользуются общими правилами этой номенклатуры, в тривиальной номенклатуре диолы часто называют гликолями.
Примеры названий диолов представлены ниже.
Структурные формулы |
Название по номенклатуре IUPAC |
Тривиальное название |
HOCH2CH2OH HOCH2CH2CH2OH HOCH2CH2CH2CH2OH
|
Этандиол - 1,2 Пропандиол – 1,3 Бутандиол – 1,4 2,3 – диметилбутандиол – 2,3 |
Гликоль, этиленгликоль 1,3 – пропиленгликоль 1,4 – бутиленгликоль Пинакон |
Способы получения гликолей
Гидролиз дигалогеналканов или галогенгидринов

Гидратация циклических эфиров
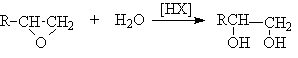
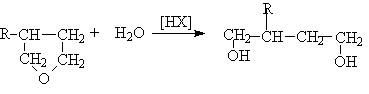
Окисление алкенов пероксидом водорода или перманганатом калия
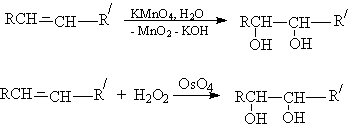
Каталитическое восстановление эфиров дикарбоновых кислот.

Физические свойства гликолей
Низшие члены ряда – густые жидкости, высшие – кристаллические вещества. Температуры кипения гликолей выше, чем температуры кипения спиртов близкой молекулярной массы. Низшие гликоли хорошо растворимы в воде. Растворимость гликолей в воде выше, чем растворимость близких им по молекулярной массе спиртов. Эти факты объясняются двумя причинами. Во–первых, наличие двух спиртовых функций обусловливает большее число межмолекулярных водородных связей, образуемых молекулами гликолей, во–вторых, эти связи прочнее, так как одна спиртовая группа действует на другую как акцептор, увеличивая ее кислотность. Гликоли имеют сладковатый вкус, плотность большинства из них больше 1.
Химические свойства гликолей
Химические свойства гликолей аналогичны свойствам одноатомных спиртов. Они могут вступать в химические взаимодействия как одной, так и двумя гидроксильными группами.
1) Кислотность
Гликоли обладают более высокой кислотностью по сравнению с одноатомными спиртами. Поэтому они также, как и последние, легко вступают во взаимодействие со щелочными металлами,
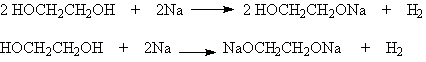
и в отличие от одноатомных спиртов, реагируют со щелочами
![]()
и некоторыми основными гидроксидами
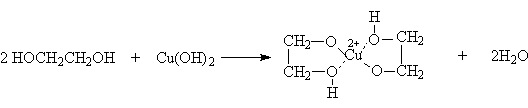
Последняя реакция легко наблюдается как растворение Сu(OH)2 с образованием синего раствора. Эта реакция является качественной на многоатомные спирты.