
- •Содержание курса лекций «Теоретические и экспериментальные методы исследования в химии. (Электрохимические методы исследования)»
- •4. Титрование по диффузионному току, обусловленному продуктом реакции титрования.
- •Метод инверсионной вольтамперометрии
- •Метод вращающегося дискового электрода
- •Потенциометрия
- •1. Электрическая проводимость растворов
- •2. Прямой кондуктометрический метод анализа
- •3. Кондуктометрическое титрование.
- •3.4 Реакции кислотно-основного взаимодействия
- •4. Высокочастотное титрование
- •5. Приборы для определения электрической проводимости
- •7. Общая характеристика метода.
1. Электрическая проводимость растворов
Электрической проводимостью называют способность вещества проводить электрический ток под действием внешнего электрического поля.
Перенос электричества в проводниках первого рода – металлах – осуществляется движением электронов по проводнику в направлении от отрицательного полюса источника тока к положительному. В проводниках второго рода – растворах электролитов
– перенос электричества осуществляется движением ионов. Анионы движутся к аноду, катионы – к катоду. Если к двум платиновым электродам, помещенным в раствор электролита, приложить разность потенциалов от внешнего источника тока, то через раствор потечет ток. Сила протекающего через электролит тока определяется как приложенным напряжением Е, так и сопротивлением R раствора, заключенного между электродами. Это отношение математически выражается законом Ома: I = E/R
Электропроводность (электрическая проводимость) раствора – это величина, обратная его сопротивлению. Если сопротивление раствора R, то его электропроводность W будет равна:
W = I/R
Единицей измерения электропроводности является Ом-1 или См (Сименс).
Электропроводность растворов зависит:
От числа ионов в единице объема раствора, т.е. от концентрации С
От подвижности l этих ионов, т.е. от легкости, с которой они движутся в электрическом поле
От расстояния между электродами L (обратно пропорциональная зависимость)
От площади электродов S
Математически эта зависимость выражается формулой:
W = kSCl/L
Для конкретной пары электродов при неизменном расстоянии между ними L и S
постоянны. После объединения всех постоянных величин в одну константу k получим:
W = kCl
Электропроводность раствора прямо пропорциональна концентрации и подвижности ионов в растворе.
Если в растворе одновременно присутствуют несколько ионов, то его электропроводность будет величиной аддитивной (суммарной) и пропорциональной сумме произведений концентраций отдельных ионов (катионов и анионов) на их подвижность:
W = k(C1l1 + C2l2 + ……Cnln)
Иногда приходится сравнивать значения электропроводности, полученные с различными парами электродов. В этом случае пользуются удельной электропроводностью (удельной электрической проводимостью) æ.
Удельная электрическая проводимость равна электрической проводимости раствора, находящегося между параллельными электродами площадью 1 м2 при расстоянии между ними 1 м, или, другими словами – это электрическая проводимость столба раствора длиной 1 м и площадью поперечного сечения 1 м2.
æ = WR / S
Единицей измерения удельной электропроводности растворов является См/м.
Удельная электропроводность раствора, так же как и электропроводность, зависит от концентрации раствора, природы электролита и температуры: электропроводность увеличивается приблизительно на 2% при повышении температуры на 1 С. Поэтому при точных измерениях сосуды для измерения электропроводности следует помещать в термостат с постоянной температурой.
В разбавленных растворах æ с увеличением концентрации растет, при некоторой достаточно высокой концентрации достигает максимума и затем уменьшается.
Возрастание æ с ростом концентрации в растворах умеренно высоких концентраций
происходит вследствие увеличения числа ионов.
В концентрированных растворах возрастают силы межионного взаимодействия, вследствие чего происходит образование межионных ассоциатов или ионных пар, увеличивается вязкость раствора. Как суммарный результат действия этих факторов на кривой электрической проводимости возникает максимум.
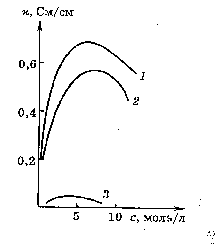
Для аналитических измерений обычно используют область разбавленных и умеренно концентрированных растворов.
При измерениях иногда бывает удобнее пользоваться эквивалентной электропроводностью (эквивалентной электрической проводимостью) λ.
Эквивалентная электрическая проводимость – проводимость раствора, содержащего
1 кмоль эквивалента вещества, и заключенного между двумя параллельными
электродами, находящимися друг от друга на расстоянии 1 м.
Единицей измерения эквивалентной электрической проводимости λ является
См·м2/(кмоль- экв). Можно встретить обозначение См·м2/(кг- экв).
Эквивалентная и удельная электрические проводимости связаны между собой соотношением:
λv = æ · V
V - разведение раствора электролита, величина, обратная молярной концентрации эквивалентов СN
V = 1/ СN
Единицы измерения разведения м3/кг-экв или м3/кмоль-экв.
Эквивалентная электрическая проводимость также зависит от температуры,
концентрации и природы вещества.
В области сравнительно невысоких концентраций эквивалентная электрическая проводимость электролитов обычно растет с уменьшением концентрации раствора и
повышением температуры.
У полностью диссоциированных (так называемых сильных) электролитов в области
разбавленных растворов (≤ 0,001М) концентрационная зависимость проводимости обычно выражается уравнением:
λ = λ∞ - а√С
λ∞ - предельная эквивалентная электрическая проводимость сильного электролита при бесконечном разведении;
а – константа.
С уменьшением концентрации электролита эквивалентная электрическая проводимость возрастает и в области больших разбавлений стремится к предельному значению λ∞, характеризующему электрическую проводимость гипотетически бесконечно разбавленного раствора.
Константа а нашла объяснение в теории Дебая - Хюккеля, развитой Онзагером. Уменьшение эквивалентной электрической проводимости теория Дебая - Онзагера объясняет эффектами электрофоретического и релаксационного торможения. Оба эффекта связаны с существованием вокруг иона ионной атмосферы из противоположно заряженных ионов. Электрофоретический эффект вызывается тем, что центральный ион под действием электрического поля движется в одном направлении, а ионная атмосфера, имеющая противоположный заряд, - в противоположном и тормозит движение иона. Релаксационное торможение обусловлено процессами разрушения и формирования ионной атмосферы при движении иона. Концентрационная зависимость эквивалентной электрической проводимости в этой теории дается уравнением:
λ = λ∞ - (А λ∞ + В)√С ,
где А – коэффициент, характеризующий электрофоретический эффект;
В – коэффициент, характеризующий релаксационный эффект.
Величины А и В определяются температурой, вязкостью и диэлектрической проницаемостью растворителя и вычисляются теоретически.
Предельная эквивалентная электрическая проводимость λ∞ является суммой предельных электрических проводимостей или предельных подвижностей ионов (катионов и анионов).
λ∞ = λ∞(+) + λ∞(-)
где λ∞(+) и λ∞(-) – предельная эквивалентная электрическая проводимость или предельная подвижность соответственно катиона и аниона.
λ∞ = l(+) + l(-)
где l(+) и l(-) – подвижности катиона и аниона соответственно, См · м2/кг-экв.
Закон аддитивности электрической проводимости растворов при бесконечном разведении установлен Ф. Кольраушем в 1879 г еще до появления теории электролитической диссоциации. Его называют также законом независимого движения ионов.
Значения подвижностей некоторых ионов приведены в таблице1.
Подвижности ионов при 18 °С
Таблица 1
Катионы |
l(+),См · м2/кг-экв. |
Анионы |
l(-),См · м2/кг-экв. |
Н+ |
31,50 |
OH- |
17,40 |
К+ |
6,37 |
1/2SO42- |
6,87 |
NH4+ |
6,36 |
Br- |
6,82 |
1/2Pb2+ |
6,10 |
I- |
6,68 |
1/2Ba2+ |
5,44 |
Cl- |
6,63 |
Ag+ |
5,32 |
NO3- |
6,26 |
1/2Ca2+ |
5,04 |
1/2CO32- |
6,00 |
1/2Cu2+ |
4,53 |
CH3COO- |
3,50 |
1/2Zn2+ |
4,50 |
|
|
1/2Mg2+ |
4,46 |
|
|
Na+ |
4,26 |
|
|
Концентрационная зависимость электрической проводимости слабых электролитов имеет более сложный характер, чем у сильных электролитов. Это объясняется тем, что на электрическую проводимость слабых электролитов влияют не только электрофоретический и релаксационный эффекты, но и увеличение степени диссоциации электролита с разбавлением раствора. В области разбавленных растворов это вызывает более быстрое, чем у сильных электролитов, увеличение электрической проводимости.
Электрическая проводимость неводных растворов имеет ряд особенностей. Существенное влияние на электрическую проводимость оказывает диэлектрическая проницаемость растворителя. Концентрационная зависимость электрической проводимости в растворах с высокой диэлектрической проницаемостью аналогична соответствующей зависимости для водных растворов. На кривой электрической проводимости растворов с малой диэлектрической проницаемостью растворителя –
хинолине, пиридине и др. – образуются минимумы и максимумы, что объясняется сложным характером взаимодействия ионов с растворителем и между собой. Чаще всего в аналитической химии используют диоксан, имеющий низкую диэлектрическую проницаемость (~2) и смешивающийся с водой в любых соотношениях.
Электрическая проводимость растворов с ростом температуры повышается. В водных растворах повышение составляет 2 – 2,3 % на градус. Температурную зависимость предельной подвижности ионов часто выражают уравнением:
λ∞(t) = λ∞(25°C)[(1 + α)(t – 25)],
где α – эмпирический коэффициент, зависящий от природы ионов и растворителя.
Степень электролитической диссоциации α слабых и сильных электролитов зависит от эквивалентной электрической проводимости λv
α = λv/ λ∞
Это позволяет по закону разбавления Оствальда рассчитывать константу диссоциации слабых электролитов по электрической проводимости их растворов.
α2
КD = ---------- C,
1 – α
где С – концентрация раствора электролита.
Этот метод определения константы диссоциации слабых электролитов – один из наиболее точных.
Следует отметить, что закон разведения Оствальда выполняется на 100 % только для слабых электролитов, диссоциирующих с образованием двух ионов.
