
- •Л.А.Ковалева физика нефтегазового пласта
- •Предисловие
- •Часть 1. Петрофизика
- •1.1. Породы - коллектры нефти и газа
- •1.1.1. Горные породы - коллекторы нефти и газа.
- •1.1.2. Залежи нефти и газа. Классификация запасов.
- •1.1.3. Отбор и подготовка кернов к исследованию. Экстрагирование.
- •1.1.4. Водонасыщенность горных пород
- •1.2. Коллекторские свойства горных пород.
- •1.2.1. Структура пористых сред.
- •1.2.2. Гранулометрический состав горных пород
- •1.2.1. Коэффициент неоднородности горных пород.
- •1.2.4. Карбонатность горных пород.
- •3. Удельная поверхность и пористость горных пород.
- •1.3.1. Удельная поверхность горных пород.
- •1.3.2. Емкость пустот пород. Пористость.
- •1.3.3. Пористость фиктивного грунта. Связь между пористостью и удельной поверхностью.
- •Методы определения пористости горных пород.
- •Емкость трещиноватых и кавернозных пород.
- •Определение средней пористости нефтегазового пласта.
- •1.4. Проницаемость горных пород
- •1.4.1. Понятие и виды проницаемости горных пород.
- •1.4.2. Линейный закон фильтрации (закон Дарси)
- •1.4.3. Связь проницаемости с другими параметрами пористой среды
- •1.4.4. Методы определения проницаемости пород.
- •1.5.1. Фазовая и относительная проницаемости пород.
- •1.5.2. Относительные проницаемости в двухфазных потоках.
- •Порода: 1 - гидрофильная; 2 - гидрофобная .
- •И газа от водонасыщенности.
- •1.5.3. Аппроксимация кривых относительных фазовых проницаемостей.
- •Система «жидкость - жидкость»
- •Система «жидкость - газ»
- •1.5.4. Относительные проницаемости в трехфазных газожидкостных потоках.
- •Для нефти (а), газа (б) и воды (в) по данным:
- •1.5.5. Лабораторные методы определения фазовой проницаемости пород.
- •Вопросы для закрепления
- •1.6. Физико-механические свойства горных пород.
- •1.6.1. Напряженное состояние горных пород.
- •Касательных напряжений.
- •1.6.2. Упругие свойства горных пород.
- •1.6.4. Твердость и крепость горных пород.
- •1.6.5. Набухание и размокание глинистых пород.
- •1.6.6. Классификация горных пород по механическим свойствам.
- •1.7. Теплофизические свойства горных пород
- •1.7.1. Тепловые характеристики горных пород.
- •Коэффициент теплопроводности горных пород – очень низкая по сравнению, например, с металлами величина и лежит в пределах:
- •1.7.2. Физический механизм теплопередачи в горных породах
- •1.7.3. Связь теплопроводности с другими петрофизическими величинами
- •1.7.4. Зависимость теплопроводности и теплоемкости пород от температуры и давления
- •1.8. Электрические характеристики горных пород
- •Виды поляризации горных пород.
- •И при наличии (б) внешнего поля
- •И при наличии (б) внешнего поля
- •3) Миграционная поляризация предполагается у пород, проводящие компоненты которых разделены непроводящими или воздухом (рис.1.8.3).
- •Диэлектрическая проницаемость горных пород.
- •1.8.3. Электропроводность горных пород.
- •Удельное электрическое сопротивление горных пород.
- •От концентрации растворенных солей
- •1.8.5. Зависимость удельного сопротивления от пористости и водонасыщенности.
- •1.8.6. Зависимость удельного сопротивления от температуры.
- •1.8.7. Анизотропия горных пород по электрическим свойствам
- •1.9. Магнитные свойства нефтесодержащих пород
- •1.9.1. Основные магнитные характеристики горных пород.
- •1.9.2. Магнитные свойства ферро- и ферримагнитных минералов
- •1.9.3. Магнитные свойства насыщенных горных пород.
- •1.10. Радиоактивность горных пород
- •1.10.1. Типы радиоактивных распадов.
- •1.10.2. Естественная радиоактивность горных пород.
- •1.10.3. Радиоактивность жидкой и газовой фаз.
- •1.10.4. Взаимодействие γ-квантов с горными породами.
- •1.10.5. Нейтронная активность горных пород.
- •Практическое использование
- •Часть 2. Физика насыщенных пористых сред.
- •2.1. Физико-химические свойства природных флюидов
- •2.1.1. Виды залежей природных флюидов
- •2.1.2. Пластовые жидкости и газы
- •2.1.3. Состав и классификация нефтей
- •4) Другие органические соединения.
- •5) Неорганические соединения.
- •2.1.4. Состав и классификация природных газов
- •2.1.5. Физические свойства нефтей
- •2.1.6. Свойства природных газов
- •Дроссельный эффект
- •Вязкость газов.
- •2.1.7. Коэффициент сверхсжимаемости природных газов
- •2.2. Физические свойства пластовых углеводородов
- •2.2.1. Растворимость газов в нефти.
- •Различных нефтях (т, с, р, н) при температуре 500с.
- •2.2.2. Давление насыщения нефти газом.
- •2.2.3. Физические свойства нефти в пластовых условиях.
- •2.2.4. Растворимость газов в воде.
- •2.3. Фазовые состояния и превращения углеводородных систем
- •2.3.1. Законы фазовых превращений многофазных систем
- •2.3.2. Фазовые превращения однокомпонентных систем
- •2.3.3. Фазовые превращения двухкомпонентных систем
- •2.3.4. Фазовые превращения бинарных и многокомпонентных систем в критической области.
- •2.3.5. Определение состава двух- и более компонентных систем.
- •2.4. Молекулярно-поверхностные свойства системы пластовых флюидов в пористой среде
- •2.4.1. Поверхностное натяжение.
- •Правило Антонова
- •2.4.2. Смачивание и краевой угол.
- •Избирательное смачивание.
- •2.4.3. Работа адгезии и теплота смачивания
- •Теплота смачивания.
- •2.4.4. Статический гистерезис смачивания.
- •2.4.5. Кинетический гистерезис смачивания.
- •2.4.6. Капиллярные явления в насыщенных пористых средах.
- •2.4.7. Роль капиллярных явлений в процессах вытеснения нефти водой.
- •Вопросы для закрепления.
- •2.5. Адсорбционные процессы в насыщенных пористых средах.
- •Общие представления об адсорбции.
- •2.5.2. Значение адсорбции в нефтегазовых пластах.
- •Исторические сведения об адсорбции.
- •2.5.4. Природа адсорбционых сил.
- •2.5.5. Уравнение адсорбции Гиббса
- •2.5.6. Теплота адсорбции.
- •2.5.7. Изотермы адсорбции.
- •Дополнительный материал к главе 1.1. А. Основные принципы бурения скважин.
- •В. Определение водонасыщенности горных пород.
- •1. Методы определения водонасыщенности горных пород
- •2. Определение водо- и нефтенасыщенности образца пористой среды на аппарате Закса.
- •Подготовка аппаратуры к анализу
- •Подготовка образцов к анализу
- •Проведение анализов
- •Вычисление результатов
- •3. Определение водо- и нефтенасыщенности в аппарате Дина и Старка
- •4. Определение остаточной водонасыщенности образца пористой среды методом Мессера.
- •Дополнитнльный материал к главе 1.2. Методы определения карбонатности горных пород.
- •Дополнитнльный материал к главе 1.3. Определение пористости по Преображенскому.
- •Дополнитнльный материал к главе 1.4. Лабораторные методы определения проницаемости пород.
- •1. Проницаемость, как характеристика горных пород.
- •2. Лабораторные методы определения проницаемости пород.
- •3. Прибор Товарова.
- •4. Выполнение работы.
- •Вязкость воздуха в сантипуазах при различной температуре
- •Дополнитнльный материал к главе 1.5. Лабораторные методы определения проницаемости пород на установке уипк-1м.
- •Дополнитнльный материал к главе 1.8. Электрические свойства горных пород а. Определение удельного электрического сопротивления максимально влажных пород мостовым способом переменного тока.
- •Б. Электометрия скавжин.
- •1. Типы зондов кс
- •Градиент – зонды Потенциал - зонды Последовательные Обращенные Последовательные Обращенные
- •2 Электрическая характеристика объекта исследований.
- •Диаграмма1. Теоретические кривые для пласта бесконечной мощности.
- •3 Метод сопротивления экранированного заземления.
- •Дополнительный материал к главе 2.2. А. Определение плотности нефти и нефтепродуктов
- •Ареометрический способ
- •Взвешивание на весах Вестфаля-Мора Весы Вестфаля-Мора (рис.2) представляют собой разновидность ареометра с постоянным объемом.
- •Метод взвешенных капель
- •Методом взвешенных капель
- •Пикнометрический метод
- •Метод гидростатического взвешивания
- •Б. Определение коэффициента динамической вязкости
- •Описание лабораторной установки впж-2
- •Дополнительный материал к главе 2.4. А. Лабораторное измерение поверхностного натяжения на границе раздела жидкости методом счета капель
- •Б. Определение высоты поднятия жидкости в капиллярной трубке и поверхностного натяжения.
- •Рекомендуемая литература
- •Часть 1. Петрофизика
- •1.4. Проницаемость горных пород………………39
- •1 5. Фазовая проницаемость горных пород……50
- •1.7. Теплофизические свойства горных пород………………… ………………………………………97
- •Часть 2. Физика насыщенных пористых сред.
- •2.1.2. Пластовые жидкости и газы
- •2.4. Молекулярно-поверхностные свойства системы пластовых флюидов в пористой среде
2.5.4. Природа адсорбционых сил.
Адсорбция пористым телом внешне выглядит как поглощение в объеме пор, но при этом не происходит внедрение сорбируемого вещества внутрь соседней фазы, происходит лишь накопление его у поверхности. В строгом определении адсорбции она рассматривалась как избыток вещества вблизи поверхности по сравнению с равным объемом вдали нее. В ряде случаев удобнее рассматривать не избыток вещества, а все количество адсорбата вблизи поверхности. Это количество обозначают символом a и называют полным содержанием или просто адсорбцией. Так как для пористых твердых тел бывает затруднительно знать величину поверхности, то часто адсорбцию относят не к единице поверхности, а к единице массы (моль/кг или моль/г).
Можно дать и такое определение адсорбции: "Явление изменения концентрации вещества у поверхности раздела фаз по сравнению с объемной фазой называется адсорбцией". Адсорбционные явления многообразны, так как многообразны возможные сочетания агрегатного состояния и состава пограничных фаз.
Дж. Гиббс сформулировал более строгое определение понятия адсорбции: "Адсорбцией данного компонента на границе раздела двух фаз называется разность между фактическим количеством этого компонента в системе и тем его количеством, которое было бы в системе, если бы концентрации в обеих сосуществующих фазах были постоянны вплоть до некоторой геометрической поверхности разделяющей их". Эта разность может быть положительной или отрицательной, обозначается символом и имеет размерность [моль/м]. Величину еще называют избыточной адсорбцией по Гиббсу.
Хотя в приведенном определении адсорбция отнесена к геометрической поверхности, не имеющей толщины (что особенно удобно при выводе уравнений), фактически, конечно, граница между фазами представляет собой очень тонкий (поверхностный) слой, в котором все свойства отличаются от свойства объемных фаз и изменяются не скачкообразно, а непрерывно. На рис.2.5.1, например, показано возможное изменение концентрации вблизи границы раздела.
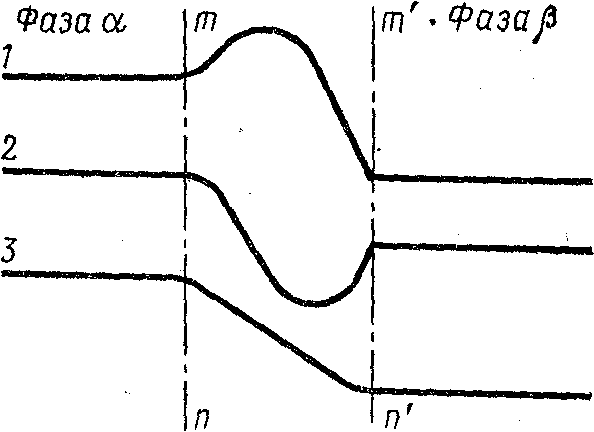
Рис.2.5.1. Изменение концентрации компонентов у границы раздела фаз:
mm’-поверхностный слой
Концентрация компонента может быть как выше концентраций в обеих фазах (1),так и ниже (2) или иметь промежуточное значение (3). Эта область (на рисунке между линиями mn и m’n’) может рассматриваться как поверхностный слой. Таким образом, изучая границу раздела фаз, нужно рассматривать состояние трех фаз: двух объемных и одной поверхностной.
Если происходит адсорбция молекул, то этот процесс называется молекулярной адсорбцией. Ионная адсорбция - это изменение концентрации ионов на поверхности раздела фаз.
2.5.5. Уравнение адсорбции Гиббса
Уравнение, устанавливающее связь между всеми параметрами адсорбции - величиной поверхностного натяжения , концентрацией компонента C в одной из фаз, его адсорбцией Г, было выведено Дж. Гиббсом в 1876 г. Оно является общим термодинамическим уравнением, справедливым для любых составов и природы поверхности раздела фаз:
![]() ,
,
где С - концентрация компонента, σ - поверхностное натяжение.
Это уравнение показывает, что если при адсорбции поверхностное натяжение уменьшается с ростом концентрации C, т.е. d/dC<0, то адсорбция Г>0. Это соответствует поверхностно-активным веществам. Наоборот, если растет с ростом C, то d/dC>0 и Г<0. Это соответствует поверхностно-инактивным веществам. Кроме того, если известна зависимость от C (т.е. изотерма поверхностного натяжения =(C)), то можно для каждого значения концентрации найти d/dC и по уравнению Гиббса вычислить значение Г, т.е. построить изотерму адсорбции Г=f(C). Схема этого расчета показана на рис.2.5.2.
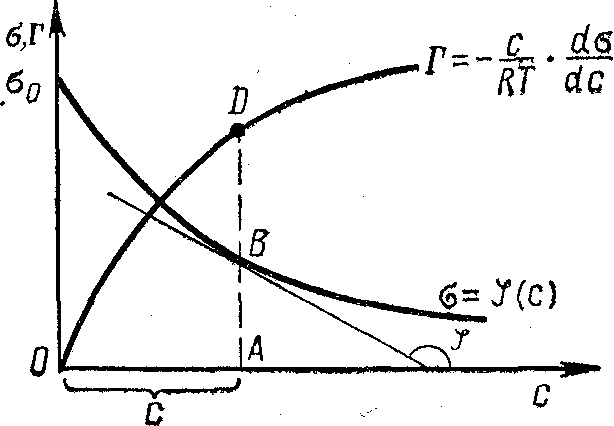
Рис.2.5.2. Изотерма поверхностного натяжения и изотерма адсорбции.
Растворение веществ в жидкостях обычно сопровождается изменением поверхностного натяжения. Так, при растворении неорганических солей в воде поверхностное натяжение на границе водный раствор—воздух незначительно повышается, а при растворении органических веществ (спирта и др.) оно значительно понижается. Вещества, понижающие поверхностное натяжение раствора, называются поверхностно активными. Они адсорбируются поверхностным слоем, т.е. сосредоточиваются в поверхностном слое в большей концентрации, чем в основном объеме раствора. Понижение поверхностного натяжения растворов обусловлено тем, что притяжение растворенных молекул к молекулам растворителя меньше, чем взаимное притяжение последних. При таком соотношении молекулярных сил молекулы растворенного вещества выталкиваются из объема на поверхность фазового раздела, т.е. происходит адсорбция его из раствора, что и вызывает понижение свободной поверхностной энергии или поверхностного натяжения. С увеличением концентрации поверхностно активного вещества в растворе адсорбционный слой уплотняется, что сопровождается понижением поверхностного натяжения. На рис. 2.5.3 показаны ненасыщенный и насыщенный адсорбционные слои.
![]()
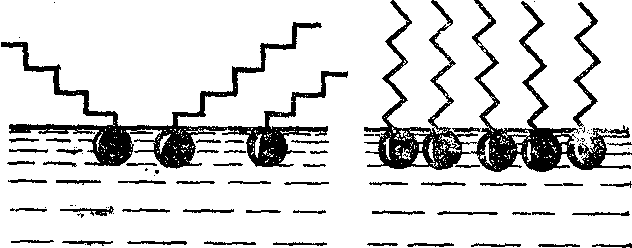
![]()
Рис.2.5.3. Ненасыщенный (а) и насыщенный (б) адсорбционный слой
