
- •Лекция № 30 Патология нервной системы
- •Соотношение процессов возбуждения и торможения в нервной системе
- •Растормаживание (дефицит торможения)
- •Энергетический дефицит и функции нейрона
- •Гипоксия, ишемия и функции нейрона
- •Функциональная активность мозга
- •Расстройства нервной трофики
- •Двигательные расстройства в зависимости от уровня поражения:
- •Поражение экстрапирамидной системы
- •Нарушения координации движений
- •Для поражения мозжечка или его связей характерно:
- •Классификация видов чувствительности:
- •Типы нарушений чувствительности:
- •Виды чувствительных расстройств:
- •Чувствительные расстройства, в зависимости от уровня поражения
- •Нарушения сегментарного отдела внс
- •Нарушения надсегментарного отдела внс
- •Этиология неврозов
- •Основные формы неврозов
- •Фармакотерапия нарушений психоэмоциональной сферы и внд
Функциональная активность мозга
Электрическая активность мозга отображает градуальные колебания соматодендритных потенциалов, соответствующих ВПСП и ТПСП.
Электроэнцефалограмма (ЭЭГ) является результатом сложной суммации электрических потенциалов многих нейронов, работающих в значительной степени независимо. Отклонения от случайного распределения событий будут зависеть от функционального состояния мозга (сон, бодрствование) и от характера процессов, вызывающих элементарные потенциалы (спонтанная или вызванная активность).
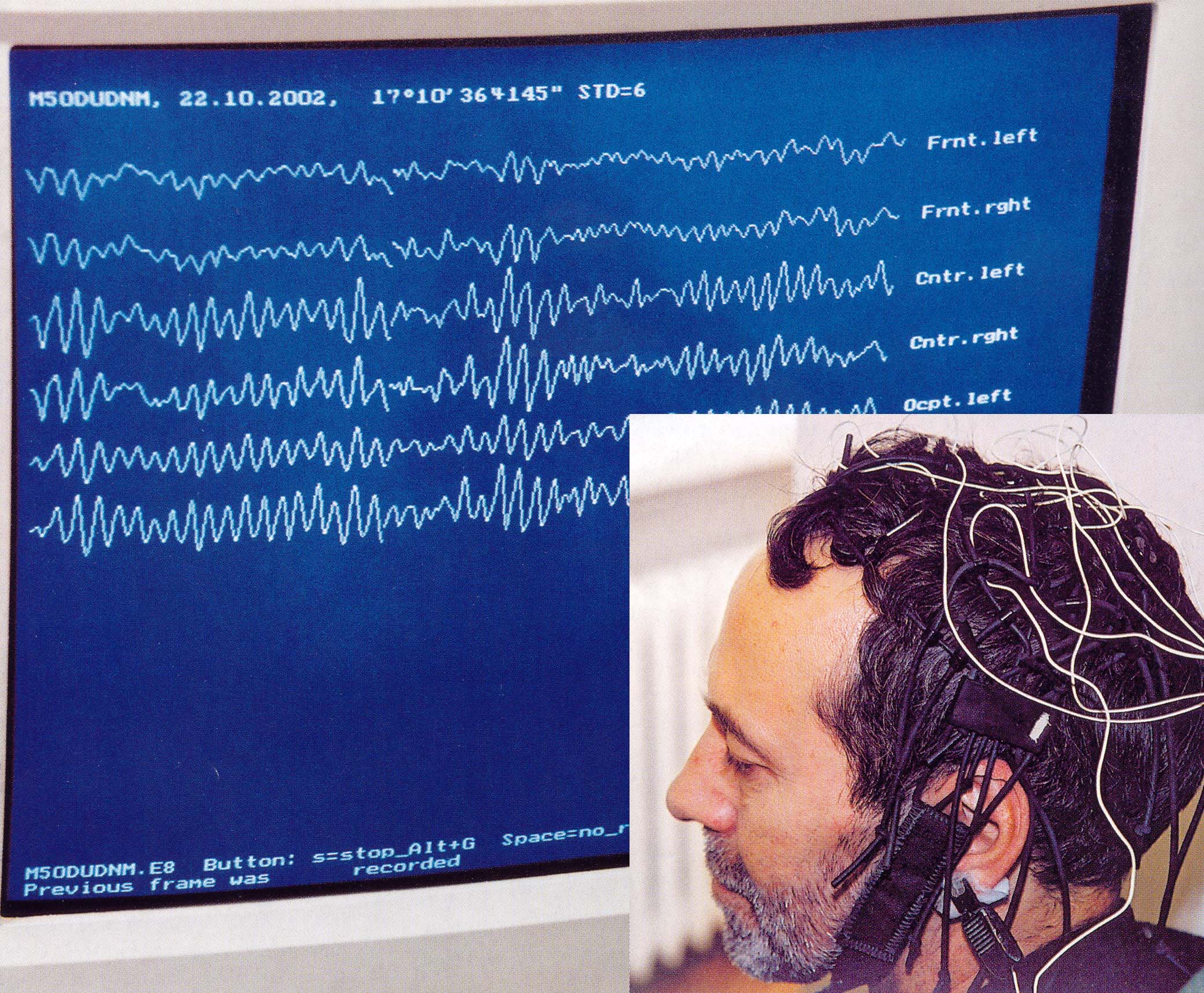
Электрическая активность отдельных нервных клеток отражает их функциональную активность по переработке и передаче информации. Отсюда можно сделать заключение, что суммарная ЭЭГ также в преформированном виде отражает функциональную активность, но уже не отдельных нервных клеток, а их громадных популяций, т.е., функциональную активность мозга.
Возбуждение активирующих ретикулокортикальных систем приводит к десинхронизации на ЭЭГ, выражающейся появлением высокочастотной, низкоамплитудной, нерегулярной по частоте электрической активности.
Высокий уровень функциональной активности мозга, соответствующий эмоциональному напряжению, направленному вниманию, выполнению новой задачи, требующей интеллектуальной мобилизации, характеризуется повышением объема воспринимаемой и перерабатываемой мозгом информации, требований к гибкости и мобильности мозговых систем. Для всего этого необходима большая автономия нейронов в осуществлении их функций, что соответствует большей информационной содержательности процессов, в них происходящих. Это повышение свободы и автономности активности отдельных нейронов во времени и проявляется десинхронизацией в суммарной электрической активности.
Снижение уровня функциональной активности сопровождается сокращением афферентного притока и большей зависимостью организации нейронной активности мозга от эндогенных механизмов. В этих условиях отдельные нейроны, объединяясь в большие синхронизированные группы, оказываются в большей зависимости от деятельности связанных с ними больших популяций нейронов. Мозговые системы работают в этих условиях как бы на резонансных режимах, в связи с чем ограничиваются возможности включения нейронов в новую активность и возможности их реагирования на поступающие извне стимулы. Такая синхронизированная активность, отражающаяся на ЭЭГ регулярными высокоамплитудными, но медленными колебаниями, соответствует меньшей информационной содержательности процессов мозга, характерной для сна без сновидений, наркоза или глубокой комы.
Принципы фармакологической коррекции патологии нейрона
Расстройства функции нейронов центральной нервной системы, особенно клеток головного мозга, часто являются следствием нарушений кровообращения и последующей гипоксии. Нейроны являются наиболее чувствительным к гипоксии типом клеток, поэтому важным подходом к лечению является улучшение мозговой гемодинамики. Подробно фармакотерапевтические варианты влияния на мозговой кровоток рассмотрены выше. Коротко напомним, что оптимальными вариантами в случае ишемических нарушений является применение препаратов, прямо влияющих на стенку сосуда, поскольку известна малая зависимость тонуса последних от влияния вегетативной нервной системы. Широко применяется группа спазмолитических сосудорасширяющих препаратов, действующих на гладкие мышцы различным путем, например, стимулируя образование или тормозя распад цАМФ, или наподобие эндогенных спазмолитических метаболитов типа аденозина, или - действия на уровне ионных мембранных каналов или внутриклеточных посредников. Ряд препаратов расслабляет гладкие мышцы сосудов путем усиления выработки эндогенных вазодилататоров (типа NО) эндотелием сосудов.
Для ликвидации расстройств функции нейронов, особенно коры головного мозга, применяют препараты, нормализующие мембранные процессы на уровне самого нейрона. Прежде всего, это вещества метаболического действия ‑ препараты АТФ или ее обломков, как субстратов для синтеза последней (АТФ, фосфаден, рибоксин), препараты, содержащие аминокислоты (глютамат, гистидин, глицин) или белковые гидролизаты, особенно гидролизаты мозговой ткани (церебролизин, аминотроф, инфузамин), редкие формы необходимых липидов ‑ сфинголипиды, цереброзиды, ганглиозиды (липоцеребрин, церебролецитин), витаминные препараты, особенно тех витаминов, которые участвуют в синтезе нейромедиаторов (тиамин, кокарбоксилаза, пиридоксальфосфат). Для улучшения взаимодействия нейронов, особенно в восстановительные периоды после острых расстройств (травмы, геморрагические или ишемические инсульты) в инволюционные периоды (у лиц старческого возраста) применяют препараты, влияющие на симпатическую передачу. В зависимости от клинического состояния пациента, назначают аналоги нейромедиаторов, возбуждающие рецепторы нейронов (адрено-, дофамино-, холино, серотонино-, ГАМК-, глицино-пурино-, глютамино-, бенздиазепино- чувствительных и других) или блокирующие. В зависимости от того, каким эффектом обладает естественный медиатор, добиваются возбуждающего (от легкого психостимулирующего до мощного аналептического) или угнетающего (от седативного и успокаивающего при неврозах до нейролептического при психозах) действия.
Патологическая характеристика денервационного синдрома. Трофические расстройства. Деафферентация.
Денервационный синдром - комплекс изменений, возникающих в постсинаптических нейронах, органах и тканях в связи с выпадением нервных влияний на эти структуры.
Денервация может возникать не только после перерыва нерва, но и при многих формах патологии, под влиянием фармакологических средств, нарушающих нервные влияния, блокады нейрорецепторов.
В мышце денервационный синдром проявляется исчезновением концевой пластики на мышечном волокне, где сосредоточен весь холинергический аппарат, и появлением вместо нее ацетилхолиновых рецепторов на всем протяжении мышечного волокна чувствительность волокна к ацетилхолину реакция мышечных волокон на поступающий к ним из разных источников ацетилхолин фибриллярные подергивания денервированной мышцы
При денервации имеет место своеобразный «возврат» мышечной ткани к эмбриональным стадиям развития. Отсутствие концевой пластинки и наличие множественных рецепторов на мышечном волокне - явления, которые имеют место на ранних стадиях развития нервно-мышечного аппарата. Кроме того, в денервированной мышце появляется спектр ферментов эмбрионального типа. Этот эффект является результатом выпадения контролирующих, трофических влияний нерва, вследствие чего происходит растормаживание генетического аппарата мышечных волокон.
Общей закономерностью денервационного синдрома является повышение чувствительности денервированных структур, причем не только к медиаторам, но и к другим биологически активным веществам, а также к фармакологическим средствам.
Денервационный синдром во внутренних органах менее выражен, поскольку эти органы, в частности сердце, обладают достаточной автономией. Однако реактивные способности денервированных органов и диапазон их регуляции изменены. Эти особенности отмечаются в трансплантированных органах.
Деафферентация нейрона - выключение афферентации (импульсации, поступающей в нейрон, из какого бы источника она ни происходила), является по существу денервацией нейрона.
Полной деафферентации нейрона не происходит, так как нейроны ЦНС обладают огромным количеством входов, по которым поступает импульсация из различных источников.
Однако и при частичной деафферентации возникает повышение возбудимости нейрона и нарушение тормозных механизмов.
В эпилептических очагах имеется значительное количество деафферентированных нейронов. Деафферентация группы нейронов является одним из механизмов образования генераторов патологически усиленного возбуждения. Деафферентация, обусловленная перерезкой седалищного нерва, ведет к образованию первичного генератора в дорсальных рогах спинного мозга, что связано с деафферентацией вышележащих уровней ЦНС.
Под феноменом деафферентации часто, особенно в клинике, подразумевают синдромы, связанные с выпадением чувствительности в связи с отсутствием стимуляции с периферии. При этих условиях могут наблюдаться также изменения локомоции в виде нарушения точности движений. Кроме того, как показано в эксперименте, при обширной деафферентации конечность может двигаться в такт с дыханием, глотанием и пр. Это явление связано с нарушением торможения, растормаживанием и повышением возбудимости деафферентированных спинальных нейронов.
При обширном выпадении нескольких видов чувствительности (например, зрения, обоняния и слуха) у больного может возникнуть практически постоянный сон.
