
- •1 Классификация материалов. Требования к конструкционным материалам.
- •2 Металлы, их свойства. Кристаллическое строение металлов и типы кристаллических решеток металлов.
- •4 Реальное кристаллическое строение металлов. Закон процесса кристаллизации
- •5.Методы изучения структур металлов.
- •11 Остаточные напряжения. Наклёп.
- •12 Основные случаи взаимодействия компонентов в сплавах (механические смеси, твердые растворы, химические соединения).
- •14 Диаграмма состояния сплавов II рода. Неограниченная растворимость.
- •15.Связь между характером взаимодействия компонентов в двойных сплавах и их свойства (закон Курнакова).
- •16 Диаграмма состояния сплавов «железо-углерод». Характер взаимодействия железа с углеродом. Основные линии диаграммы.
- •17 Особенности кристаллизации и вторичные превращения в сталях.
- •18 Кристаллизация и вторичные превращения в чугунах
- •Превращения, происходящие в твердом состоянии, называются вторичной кристаллизацией.
- •19 Классификация углеродистых сталей (углеродистые обыкновенного качества, конструкционные качественные стали, инструментальные стали).
- •21 Чугуны. Классификация чугунов (серый, белый, ковкий, высокопрочный).
- •22 Основные методы упрочнения стальных изделий. Термическая обработка сталей.
- •23 Отпуск стали. Отжиг стали. Нормализация стали.
- •24 Закалка стали. Выбор охлаждающих средств для закалки. Виды закалки сред.
- •25 Прокаливаемость и закаливаемость стали. Поверхностная закалка стали.
- •26 Термомеханическая обработка.
- •27 Химико-термическая обработка (цементация, азотирование, цианирование, диффузионная металлизация).
- •28 Легированные стали. Классификация, маркировка. Причины высокой прочности сталей по сравнению с углеродистыми.
- •30.Цветные металлы и сплавы. Медь и ее сплавы. Алюминий и его сплавы. Титан.
- •31 Неметаллические материалы. Резина, пластмассы. Классификация и основные части пластмасс.
- •36 Электрофизические и электрохимические способы обработки металлов.
- •Часть 2:
- •7.Классификация и основные свойства проводниковых и полупроводниковых материалов.
- •1.1. Проводниковые материалы
- •1.2 Электроизоляционные материалы
- •9) Классификация материалов по агрегатному состоянию, по химическому составу и функциональному назначению.
- •10) Зависимость технологических и эксплуатационных свойств от химического состава.
- •11) Технология получения материалов высокой проводимости
- •14 Проводниковые материалы
- •15 Магнитные материалы
- •16 Полупроводниковые материалы и изделия
- •18 Стали и сплавы с особыми физическими свойствами
14 Диаграмма состояния сплавов II рода. Неограниченная растворимость.
Оба компонента неограниченно растворимы в жидком и твердом состояниях и не образуют химических соединений.
Компоненты: А, В.
Фазы: L, α.
Если два компонента неограниченно растворяются в жидком и твердом состояниях, то возможно существование только двух фаз — жидкого раствора L и твердого раствора α. Следовательно, трех фаз быть не может, кристаллизация при постоянной температуре не наблюдается и горизонтальной линии на диаграмме нет.
Диаграмма, изображенная на рис. 1, состоит из трех областей: жидкость, жидкость + твердый раствор и твердый раствор.
Линия АmВ является линией ликвидус, а линия АnВ — линией солидус. Процесс кристаллизации изображается кривой охлаждения сплава (рис. 2).
Точка 1 соответствует началу кристаллизации, точка 2 — концу. Между точками 1 и 2 (т. е. между линиями ликвидус и солидус) сплав находится в двухфазном состоянии. При двух компонентах и двух фазах система моновариантна (с = k—f+1 = 2 — 2 + 1 = 1), т. е. если изменяется температура, то изменяется и концентрация компонентов в фазах; каждой температуре соответствуют строго определенные составы фаз. концентрация и количество фаз у сплава, лежащего между линиями солидус и ликвидус, определяются правилом отрезков. Так, сплав К в точке а состоит из жидкой и твердой фаз.Состав жидкой фазы определится проекцией точки b, лежащей на линии ликвидус, а Состав твердой фазы — проекцией точки с, лежащей на линии солидус. Количество жидкой и твердой фаз определяется из следующих соотношений: количество жидкой фазы ac/bc, количество твердой фазы ba/bc.
Во всем интервале кристаллизации (от точки 1до точки 2) из жидкого сплава,
и
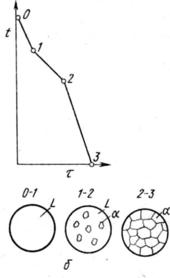
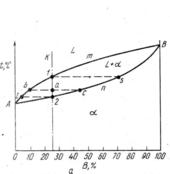 меющего
исходную концентрацию К,выделяются
кристаллы, более богатые тугоплавким
компонентом. Состав первых кристаллов определится
проекцией s. Закончиться кристаллизация сплава К должна
в точке 2,
когда последняя капля жидкости,
имеющая Состав l, затвердеет.
Отрезок, показывающий количество твердой
фазы, равнялся нулю в точке /,
когда только началась кристаллизация,
и количеству всего сплава в точке 2,
когда кристаллизация закончилась. Состав жидкости
изменяется по кривой 1 — l, аСостав кристаллов —
по кривой s—
2, и в момент окончания кристаллизации
Состав кристаллов такой
же, как и Состав исходной
жидкости.
меющего
исходную концентрацию К,выделяются
кристаллы, более богатые тугоплавким
компонентом. Состав первых кристаллов определится
проекцией s. Закончиться кристаллизация сплава К должна
в точке 2,
когда последняя капля жидкости,
имеющая Состав l, затвердеет.
Отрезок, показывающий количество твердой
фазы, равнялся нулю в точке /,
когда только началась кристаллизация,
и количеству всего сплава в точке 2,
когда кристаллизация закончилась. Состав жидкости
изменяется по кривой 1 — l, аСостав кристаллов —
по кривой s—
2, и в момент окончания кристаллизации
Состав кристаллов такой
же, как и Состав исходной
жидкости.
15.Связь между характером взаимодействия компонентов в двойных сплавах и их свойства (закон Курнакова).
Свойства сплавов зависят от взаимодействия компонентов, т.е. структуры. Диаграмма состояния характеризует взаимодействие компонентов и показывают, какая структура получается в зависимости от состава сплава.
Следовательно, существует связь между свойствами и типом диаграммы состояния.

16 Диаграмма состояния сплавов «железо-углерод». Характер взаимодействия железа с углеродом. Основные линии диаграммы.
Диаграмма состояния – это графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов в условиях равновесия.
Компоненты системы – железо Fe и углерод С (рис. 7.1).
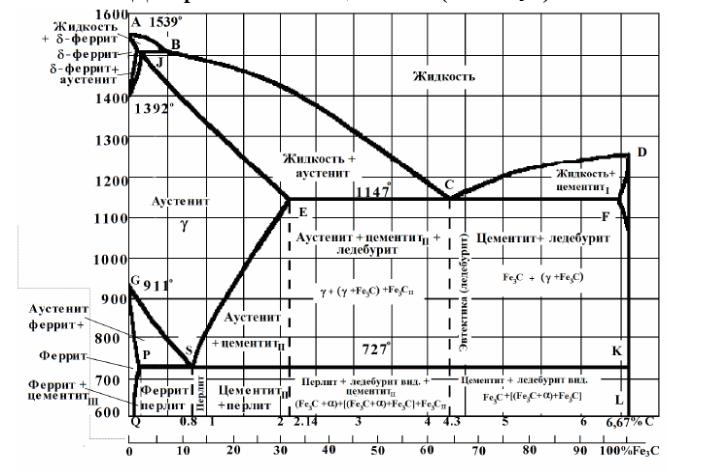
Рис. 7.1. Диаграмма состояния «Железо – карбид железа» (Fe – Fe3C)
Особенности диаграммы определяются полиморфизмом железа и углерода, а также ферромагнетизмом железа:
- от 1539 – 1392 оС железо имеет решетку ОЦК, такая модификация железа называется (Fe);
- от 1392 – 911 оС железо имеет решетку ГЦК, такая модификация железа называется (Fe);
- ниже 911 оС железо имеет решетку ОЦК, такая модификация называется (Fe);
- при температуре 768 оС железо теряет магнитные свойства, и эта температура называется точкой Кюри.
В каждой модификации железа растворяется строго определенное количество углерода с образованием твердых растворов внедрения:
- - феррит – раствор углерода в (Fe) с ОЦК решеткой. Максимальная растворимость углерода в (Fe) составляет 0,1 % при температуре 1499 оС;
- аустенит – твердый раствор углерода в (Fe) с ГЦК решеткой. Максимальная растворимость углерода в (Fe) составляет 2,14 % при температуре 1147 оС;
- - феррит – твердый раствор углерода в (Fe) с ОЦК решеткой. Максимальная растворимость углерода в (Fe) составляет 0,025 % при температуре 727 оС.
Кроме указанных выше твердых растворов в системе Fe – С образуются две высокоуглеродистые фазы:
- цементит – химическое соединение Fe3С со сложной орторомбической решеткой, которое содержит 6,67 % углерода и имеет температуру плавления Тпл = 1260 оС . Эта фаза метастабильная, способная к распаду (Fe3С 3Fe + Сгр);
- графит – модификация углерода с ГПУ решеткой. Эта фаза стабильная, состоит на 100 % из углерода и имеет температуру плавления Тпл = 3600 оС.
В дополнение к фазам в виде твердых растворов на диаграмме имеются области существования механических смесей:
- перлит – механическая смесь (эвтектоид) феррита и цементита, содержащая 0,8 % С (рис. 7.1, точка S);
- ледебурит – механическая смесь (эвтектика) аустенита и цементита в интервале температур 1147 – 727 оС или перлита и цементита при температурах ниже 727 оС, содержащая 4,3 % углерода (рис. 7.1, точка С).
Сплошными линиями изображена диаграмма Fe – Fe3C, штриховыми – диаграмма Fe – С (рис.7.1). Основной является диаграмма Fe – Fe3С. Однофазные области диаграммы:
выше линии ABCD (линия ликвидус) – жидкость (L);
область AHN – область - феррита;
область NJESG – область аустенита;
область GPQ – область - феррита;
линия LD или KD – область цементита Fe3C.
Остальные области диаграммы (рис. 7.1) – двухфазные: ледебурит, перлит и их комбинации.
7.1. Характеристика линий и точек диаграммы Fe – Fe3C
Линия АВСD - линия ликвидус – линия начала кристаллизации сплава и состоит она из трех частей:
AB – начало образования - феррита;
BC – начало кристаллизации аустенита;
CD – начало кристаллизации цементита Fe3C.
Линия AHJECF – линия солидус – линия конца кристаллизации сплава и состоит она из нескольких частей:
AH – конец кристаллизации - феррита;
JE – конец кристаллизации аустенита;
HJB - линия перитектического превращения:
Жв + FeH 1499 FeJ или ЖВ + ФH 1499 A аусJ
ECF – линия эвтектического превращения:
Жс 1147 Е + Fe3CF или Жс 1147 АЕ + ЦI
Остальные линии соответствуют превращениям в твердом состоянии:
NH и NJ (А4) – линии начала и конца полиморфного превращения Fe Fe;
- GS (А3) и GP – линии начала и конца полиморфного превращения Fe Fe;
ES(Аст) – линия выделения вторичного цементита из аустенита (Fe3CII) за счет изменения растворимости углерода в -железе. Эта линия называется линия сольвиус;
PQ – линия выделения третичного цементита (Fe3CIII) за счет изменения растворимости углерода в - железе;
PSK (А1) – линия эвтектоидного превращения во всех сплавах независимо от содержания углерода:
FeS 727 FeP + Fe3Ck или Ауст ФР + ЦII
KD – линия существования химического соединения Fe3C (цементит);
MO (А2) – 768 оС - линия магнитного превращения феррита (потеря магнитных свойств железа).
Физический смысл точек диаграммы:
A – температура плавления и кристаллизации чистого железа;
B – перитектическая точка;
C – эвтектическая точка;
D – температура плавления и кристаллизации цементита;
N и G - температуры полиморфных превращений чистого железа;
H – предельная растворимость углерода в - железе;
E – предельная растворимость углерода в - железе;
S – эвтектоидная точка;
P и Q – точки предельной растворимости углерода в - железе;
M – точка магнитного превращения железа (точка Кюри).
А1, А2, А3, А4 – принятые условные обозначения фазовых превращений.
