
- •Знайомимося з електролітами
- •Електричний струм в електролітах
- •Закони Фарадея
- •Застосування електролізу
- •Несамостійний і самостійний розряди
- •Іонізація електронним ударом
- •Умови існування струму у вакуумі.
- •Вакуумні прилади
- •Напівпровідники
- •Власна провідність напівпровідників.
- •Домішкова провідність напівпровідників.
- •Електронно-дірковий перехід.
- •Принцип роботи напівпровідникового діода.
- •Застосування напівпровідникових діодів.
- •Будова транзистора.
- •Принцип роботи транзистора.
- •Застосування транзисторів.
- •Термістори.
- •Фоторезистори.
- •Якісні питання
лекція 9
Тема. Електричний струм у різних середовищах
Мета: роз'яснити учням фізичну природу електропровідності рідин, газів. сформувати уявлення про вільні носії електричного заряду в напівпровідниках і про природу електричного струму в чистих напівпровідниках з точки зору електронної теорії. Роз’яснити принцип роботи напівпровідникового діода. Ознайомити із принципом роботи транзистора.
План
Знайомимося з електролітами
Електричний струм в електролітах
Закони Фарадея
Застосування електролізу
Іонізація газів.
Несамостійний і самостійний розряди
Іонізація електронним ударом
Плазма
Поняття вакууму.
Умови існування струму у вакуумі.
Вакуумні прилади.
Напівпровідники
Власна провідність напівпровідників.
Домішкова провідність напівпровідників.
Електронно-дірковий перехід.
Принцип роботи напівпровідникового діода.
Застосування напівпровідникових діодів.
Будова транзистора.
Принцип роботи транзистора.
Застосування транзисторів.
Термістори.
Фоторезистори.
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
Знайомимося з електролітами
Чи Поняття вакууму. проводять рідини електричний струм? Розглянемо дослід. У посудину з дистильоУмови існування струму у вакуумі. ваною водою опустимо два електроди. Зберемо коло із джерела струму, ключа, лампочкиВакуумні прилади. та чутливого амперметра. Якщо замкнути коло, то стрілка амперметра не відхилиться. Це означає, що дистильована вода не містить вільних носіїв заряду й у колі немає струму.
У такий-же спосіб можна переконатися, що суха кам'яна сіль так само є діелектриком.
А тепер «об'єднаємо» ці два діелектрики: насиплемо у посудину з водою дві-три ложки кам'яної солі. Ми побачимо, що лампочка загориться, причому в міру розчинення солі розжарення лампи збільшується.
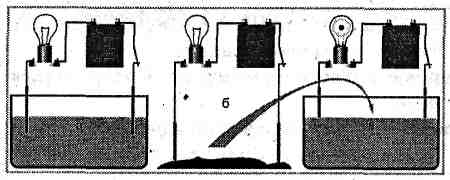
Цей дослід доводить, що підсолена вода є провідником, причому носії заряду з'являються під час розчинення солі у воді.
За допомогою подібних дослідів можна визначити, що практично усі водні розчини солей, кислот і лугів є провідниками електричного струму.
Електролітами називаються речовини, розчини яких проводять електричний струм.
Речовини поділяються на електроліти і неелектроліти. Електроліти характеризуються тим, що їхні розчини або розплави є провідниками електричного струму. Розчини або розплави неелектролітів не проводять електричний струм.
Загалом, електричний струм отримують, коли під дією певної різниці потенціалу (U=∆φ) електричного поля ті чи інші носії електричного заряду приходять у стан напрямленого упорядкованого руху в межах замкненого електричного кола.
Якщо в металах рухомими, у міжатомному просторі, можуть бути лише електрони, то в рідинах може вільно пересуватись будь - яка молекула. І коли в певну рідину занурити два електрода з різницею потенціалів між ними, то можна очікувати упорядкований зустрічний рух позитивних іонів до негативного полюса і, одночасно, негативних іонів до позитивного полюса. Адже між різнойменними зарядами діють сили протягування. До того ж виявляється, що молекули розчинів кислот, лугів та солей, самі по собі, навіть без зовнішнього електричного поля, можуть дисоціювати, тобто перетворюватись на електрично-заряджені іони.
Електричний струм в електролітах
Молекули солей, кислот і лугів утворені позитивними й негативними йонами, що утримуються силами електростатичного притягування. Наприклад, у молекулах кам'яної солі NaCl позитивно заряджений іон натрію Na+ притягується до негативного йона хлору СГ. У водяному розчині молекули води послаблюють зв'язок між іонами:

При зіткненнях, обумовлених тепловим рухом, молекула розпадається на позитивні й негативні йони, що стають носіями заряду в електроліті.
Таким чином, носіями заряду в електролітах є йони, тобто електроліти мають іонну провідність.
Процес виділення речовини на електродах при проходженні електричного струму через електроліт називають електролізом.
На аноді негативно заряджені йони віддають свої зайві електрони (у хімії цей процес називається окисною реакцією), а на катоді позитивні йони одержують електрони, яких не вистачає (відновна реакція).
Електролітична дисоціація - це процес розщеплення нейтральних молекул на позитивні та негативні іони під дією полярних молекул води. Одночасно завжди існує зворотній процес рекомбінації окремих іонів у нейтральні молекули.
H2SO4 = 2H+ + SO42- NaCl = Na+ + Cl-
Між процесами електролітичної дисоціації й рекомбінації йонів за незмінних умов установлюється динамічна рівновага, за якої число молекул, що розпадаються на йони за одиницю часу, дорівнює числу пар іонів, що за цей час з'єднуються в нейтральні молекули.
Іони в електролітах рухаються хаотично доти, поки в рідину не опускаються електроди. Тоді на хаотичний рух іонів накладається їхній упорядкований рух до відповідних електродів, і в рідині виникає електричний струм.
За йонної провідності проходження струму пов'язане з переносом речовини. На електродах відбувається виділення речовин, що входять до складу електролітів,
При цьому у формуванні іонів важлива роль належить так званим валентним електронам.
А +
- анод, К-
- катод
+
- анод, К-
- катод
Потік іонів, що і являє електричний струм в електролітах.
Тобто – електроліти для розведених у просторі цієї рідини анода та катоду електричне коло не розмикають. Електроліт – це провідник електричного струму.
Зрозуміло, що при підвищенні температури опір електролітів зменшується на відміну від температурної залежності опору металевих провідників, бо підвищується рухомість носіїв електричних зарядів.
Іони для електролітичного струму іноді отримують не тільки з середовища самого електроліту, а подеколи і з самих електродів (аноду). Тому, що серед іонів електроліту не всі вони є електрохімічно активними, коли, наприклад, наявні негативні іони не здатні у даному середовищі віддати свої „надлишкові” електрони. А якщо не буде замкненого потоку електронів на відрізку зовнішнього з’єднання аноду та катоду з джерелом струму, то не буде і електролітичного струму в середині рідини.
На практиці під час електролізу наявного розчину біля електродів замість іонів, що там з’явилися, утворюються вже електрично-нейтральні молекули газу чи шар чистого металу, що складається з нейтральних атомів. Це прояв так званих реакцій відновлення. Основа їхньої сутності у поведінці вільних електронів, яку визначають іони та електричний заряд електрода.
От тільки водні розчини солей та кислот з причини широкої універсальності молекули води (H2O→ H++ OН-) містять не два протилежно заряджені іони, а більше (Na+, Cl-, H+, OH-). У такому випадку в електролізній реакції приймають участь лише два іона: один позитивний (найбільш активний) і один негативний (також найбільш активний). Інші іони участі у реакції не приймають. Їх називають пасивними.
Наведемо кілька прикладів.
Електроліт-водний розчин НС1.
Дисоціація: НС1<=> Н+ + С1-.
Анод: 2 С1- -2е- →С12.
Катод: 2Н+ + 2е-→Н2.
Як бачимо, у даному разі витрачається розчинена речовина, а на електродах виділяються газоподібні водень і хлор. Вторинних реакцій не виявлено.
2. Водний розчин H2S04.
Дисоціація: H2S04 <=> 2Н+ + S042-.
Анод: 40Н- - 4 е-→2Н20 + 02.
Катод: 2Н+ +2е- → Н2.
У розчині залишається: S042- + 2Н+ —> H2S04. Ця реакція відбувається, якщо електроди виготовлено з платини чи нікелю. Кисень виділяється на аноді.
3. Електроди мідні. Водний розчин CuS04.
Дисоціація: CuS04 <=> Cu2+ +S042 Н20 <=> Н++ОН-.
Катод: Cu2+ +2e- →Cu° -мідь виділяється на катоді.
Анод: 40Н- +4e- →2Н20 + 02 - кисень виділяється на аноді.
Є спеціальний розділ фізики, який вивчає ці властивості рідини дуже детально. Такі пізнання широко використовуються у біотехнологіях. Останні поступово займають у житті сучасного суспільства лідируюче положення і є однією з цеглин нового суспільства ЗНАНЬ, що приходить на зміну ще актуального для України індустріального періоду.
Дуже часто саме за рахунок реакцій електролізу отримують цінні хімічні продукти, що вкрай тяжко добути прямим природнім шляхом. Так у „доелектролізні” часи алюміній був настільки дорогий, що прикраси з нього могли собі дозволити жінки лише з дуже багатих сімей. Тому для Дмитра Івановича Менделєєва було приємним отримати пам’ятну медаль Французької академії наук саме з алюмінію.
Як правило, електроліз – це явище проходження електричного струму у рідинах, при якому сама рідина не „переживає” ніяких перетворень своєї сутності. Всі реакції відбуваються виключно біля електродів, а у рідини змінюється лише концентрація компонентів.
Зрозуміло, що маса продуктів електролізу залежить від величини заряду, що пронизує розчин.
Ступінь дисоціації залежить від:
а) температури,
б) концентрації розчину,
в) діелектричної проникливості розчинника.
Електроліз — це процес виділення на електродах речовин внаслідок відновлювально-окислювальних реакцій, що відбуваються на електродах.
