
Вопрос №5
А
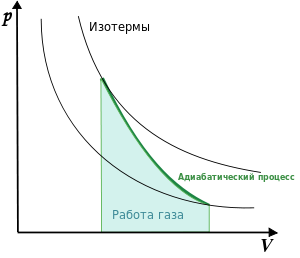 диабата
идёт круче, чем изотерма, потому что в
адиабатическом процессе меняются всё
три параметра.
диабата
идёт круче, чем изотерма, потому что в
адиабатическом процессе меняются всё
три параметра.
— давление газа; — объём.
Вопрос №6
См вопрос №4 (дополнения).
Вопрос №7
Теплоёмкость – величина, которая зависит от вида процесса.
Теплоемкость идеального газа — это отношение количества теплоты, сообщенного газу, к изменению температуры δТ, которое при этом произошло.
![]()
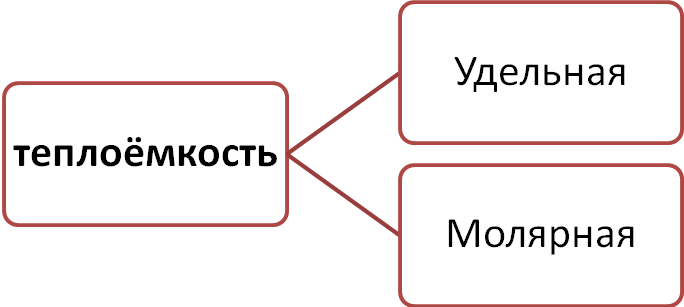
Удельная теплоёмкость (Удельная теплота нагревания на один градус, С уд.) вещества - количество тепловой энергии, необходимой для повышения температуры одного килограмма вещества на один градус. (Дж/(кг ·К)).
Формула
расчёта удельной теплоёмкости:
![]() .,
.,
где
![]() —
удельная теплоёмкость,
—
удельная теплоёмкость,
![]() —
количество
теплоты, полученное веществом при
нагреве (или выделившееся при охлаждении),
—
количество
теплоты, полученное веществом при
нагреве (или выделившееся при охлаждении),
— масса нагреваемого (охлаждающегося) вещества,
![]() —
разность
конечной и начальной температур вещества.
—
разность
конечной и начальной температур вещества.
Молярная теплоёмкость (Сμ) — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. (Дж/(моль·К)).
Формула
расчёта молярной теплоёмкости:
![]() .
.
Удельная
и молярная теплоемкости связаны
соотношением:
![]() ,
где
,
где
М — молярная масса (масса одного моля вещества).
Чаще всего работаем с молярной теплоёмкостью!
Вопрос №8
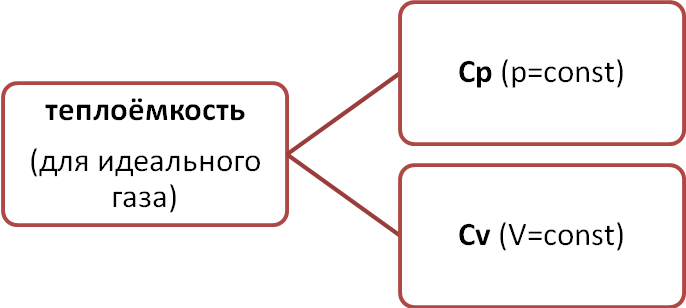
Сp – теплоёмкость вещества при постоянном внешнем давлении.
Cv – теплоёмкость вещества при постоянном внешнем объёме.
Для газа Cp>Cv, так как в случае постоянного давления тепло идёт как нагревание газа, так и на совершение работы расширяющимся газом против внешних сил, а в случае постоянного объёма тепло идёт только на нагревание газа.
Из кинетической теории известно, что
Вопрос №9
Q = dU
![]() *dT
= (i/2)*
*dT
= (i/2)*![]() *R*dT
*R*dT
![]() = (i/2)*R
= (i/2)*R
![]() =
+
R = (i/2) + R = ((i+2)/2)*R
=
+
R = (i/2) + R = ((i+2)/2)*R
![]() =
((i+2)/2)*R
=
((i+2)/2)*R
![]() = (i/2)*R
= (i/2)*R
Вопрос №10
(лучше конечно, ответ на этот вопрос посмотреть в 81 методичке на странице 83)
Цель работы: изучение различных изопроцессов протекающих в газах, экспериментальное определение СP/СV для воздуха.
Приборы и принадлежности: прибор Клемана – Дезорма манометр, насос, секундомер.
Теоретическое введение: Теплоёмкостью какого-либо тела Сm называется величина, численно равная количеству теплоты Q, которое требуется сообщить этому телу для повышения его температуры на 1 кельвин.
![]()
Удельной теплоёмкостью Суд. называется теплоёмкость единицы массы вещества. Молярной теплоёмкостью вещества называется С – называется теплоёмкость вещества взятого в количестве одного моля. Из определения С следует, что С = Суд, где - молярная масса вещества.
Согласно основному закону термодинамики количество теплоты Q, переданное газу, затрачивается на увеличение его внутренней энергии dU и на совершении газом работы A.
Q = dU + A;
Внутренняя энергия системы является функцией её состояния, а количество теплоты и работа являются функцией процесса.
Из определения теплоёмкости имеем формулу:
![]()
Теплоёмкость С так же является функцией процесса так, как передаваемая газу количество теплоты Q способа нагрева газа.
Состояние газа, как термодинамической системы определяется следующими параметрами: давлением p, объёмом V и температурой T. Связь данных параметров определяется Уравнением состояния идеального газа – уравнением Менделеева-Клайперона:
pV = RT.
Где R – универсальная газовая постоянная.
Процессы, протекающие в газе при неизменном значении одного из термодинамических параметров его состояния, называются изопроцессами.
Изохорный
процесс протекает при V = const.
Уравнение изохоры имеет вид:
![]() const
(закон Шарля). В данном случае dV = 0, A
= pdV = 0. Тогда из уравнения (2) получаем:
const
(закон Шарля). В данном случае dV = 0, A
= pdV = 0. Тогда из уравнения (2) получаем:
![]()
Изобарный
процесс протекает при p = const.
Уравнение изобары имеет вид:
![]() const
(закон Гей-Люссака). Теперь уравнения
(2) имеет вид:
const
(закон Гей-Люссака). Теперь уравнения
(2) имеет вид:
![]()
Тогда из уравнения (3) получаем:
![]()
При p = const получим pdV = RdT, подставим его в (5) и учтя выражение (4) имеем следующее выражение (уравнение Майера):
Cp = CV + R;
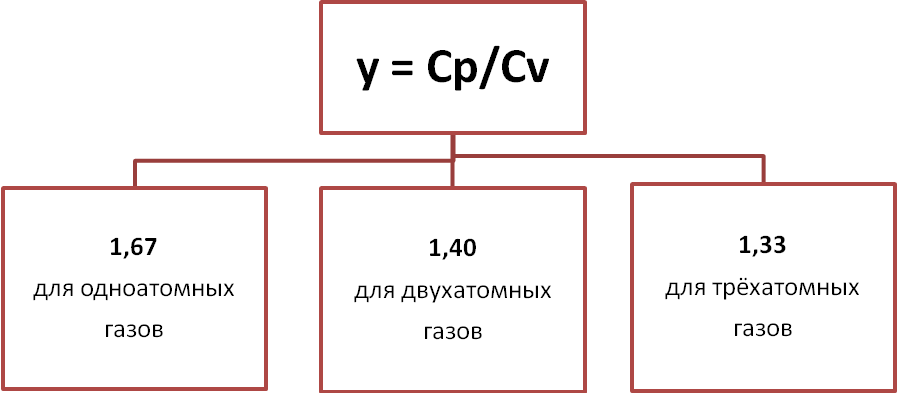
Молярные теплоёмкости Cp и CV идеального газа зависят от числа степеней свободы i его молекулы. Атом одноатомного газа имеет i = 3 (X, Y, Z). Молекулы 2-ух атомного газа имеют i = 5 (3 – степени свободы поступательного движения и 2 вращательного). Молекулы состоящие из 3-ёх и более атомов имеют 6 степеней свободы (i = 6).
При высоких температурах кроме поступательного и вращательного движения молекулы (атома) необходимо учитывать и её колебательное движение (около положения равновесия) т. е. У двухатомной молекулы – 1 колебательная степень свободы, у многоатомных молекул 3N – 6, где N – число атомов в молекуле. На каждую степень свободы приходится примерно одинаковое количество кинетической энергии, равное kT/2, где k – постоянная Стефана – Больцмана. Тогда внутренняя энергия одного моля идеального газа равна:
![]() ,
,
где i – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы.
Из уравнений (4), (7) и (8) следует, что:
![]() ,
,
![]() .
.
Изотермический
процесс протекает при T = const.
Уравнение изотермы имеет вид:
![]() const
(закон Бойля - Мариотта). Следовательно:
const
(закон Бойля - Мариотта). Следовательно:
dT = 0, dU = 0, Q =A.
Адиабатный процесс протекает при Q = 0. Следовательно: dU + A = 0. От сюда получаем выражение:
A = -dU.
Из данного выражения получаем уравнение адиабаты:
pdV = -CVdV (уравнение Пуассона).
Из вышеприведённых уравнений (6), (7) и (11) следует, что:
![]() ,
,
где
![]() .
.
Интегрируя и потенцируя (12), получим уравнение Пуассона:
pV = const.

В данной работе требуется определить СP/СV = , для этого в течение всего эксперимента газ (в установке) последовательно будет проходить через 3 состояния (рис. 1): 1-2 адиабатное расширение, 2-3 изохорный процесс.
Для адиабатного перехода 1-2 справедливо уравнение Пуассона:
![]()
Первое и третье состояние газа принадлежит одной той же изотерме. Применяя к ним закон Бойля – Мариотта, получаем:
p1V1 = p3V2;
Из уравнений (14) и (15) следует, что
 .
.
Прологарифмировав это выражение получим:
![]()
Давление воздуха в баллоне в первом состоянии определяется, как
p1 = p2 + gH,
где - плотность вещества; g – ускорение свободного падения; H – разность уровней жидкости в трубках манометра при измерении p1.
Давление воздуха в баллоне в третьем состоянии определяется, как
p3 = p2 + gh,
где h – разность уровней жидкости в трубках манометра при измерении p3.
Так, как давление p1 и p3 примерно равно атмосферному давлению p2, то формулу (17) можно упростить, использую следующее равенство:
![]() ,
которое выполняется для всех x << 1.
Тогда:
,
которое выполняется для всех x << 1.
Тогда:
![]()
