
Вопрос №1
Идеальный газ – газ, взаимодействием и размерами которого можно пренебречь.
Модель идеального газа удовлетворяет следующим требованиям:
Расстояние между молекулами гораздо больше их размеров (молекулы можно считать материальными точками);
Силами взаимодействия, кроме моментов соударения, можно пренебречь (потенциальная энергия взаимодействия молекул по сравнению с кинетической энергией хаотического движения пренебрежимо мала);
Столкновение молекул друг с другом и со стенками абсолютно упругое;
Движение каждой молекулы подчиняется классическим законам динамики Ньютона.
Реальный разреженный газ приблизительно ведет себя как идеальный газ.
Основное уравнение молекулярно-кинетической теории идеального газа
Основное уравнение молекулярно-кинетической теории идеального газа устанавливает связь между макроскопической величиной - давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
![]()
где р - давление, m0- масса молекулы, п - концентрация (число молекул в единице объема), v2 - средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы
![]()
можно записать:
![]()
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
Вопрос №2
Уравнение состояния идеального газа (уравнение Клапейрона или уравнение Менделеева — Клапейрона)
![]()
где
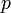 —
давление,
—
давление,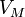 —
молярный
объём,
—
молярный
объём,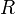 —
универсальная
газовая постоянная
—
универсальная
газовая постоянная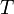 —
абсолютная
температура, К.
—
абсолютная
температура, К.
Так
как
![]() ,
где
,
где
![]() —
количество вещества, а
—
количество вещества, а
![]() ,
где
,
где
![]() —
масса,
—
масса,
![]() —
молярная
масса, уравнение состояния можно
записать:
—
молярная
масса, уравнение состояния можно
записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
![]() —
закон
Бойля — Мариотта.
—
закон
Бойля — Мариотта.
![]() —
Закон
Гей-Люссака.
—
Закон
Гей-Люссака.
![]() —
закон
Шарля
(второй закон Гей-Люссака, 1808 г.)
—
закон
Шарля
(второй закон Гей-Люссака, 1808 г.)
А
в форме пропорции
![]() этот
закон удобен для расчёта перевода газа
из одного состояния в другое.
этот
закон удобен для расчёта перевода газа
из одного состояния в другое.
Универсальная газовая постоянная (физический смысл) —величина численно равна работе, которую необходимо совершить, чтобы нагреть 1 моль вещества на 1 К при постоянном давлении.
В Международной системе единиц (СИ) универсальная газовая постоянная равна 8,31441 Дж/(моль*К)
Постоянная
Больцмана
(![]() или
или
![]() ) —
физическая постоянная, определяющая
связь между температурой и энергией.
) —
физическая постоянная, определяющая
связь между температурой и энергией.
![]() Дж/К
Дж/К
Универсальная
газовая постоянная определяется как
произведение постоянной Больцмана на
число Авогадро,
![]() .
.
Вопрос №3
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными.
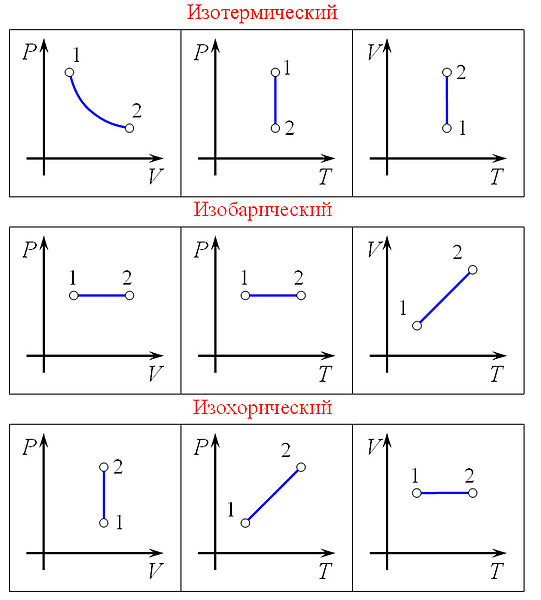
Изобарный
процесс—
процесс изменения состояния
термодинамической системы при постоянном
давлении (![]() )
)
![]()
При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
