
- •2. Биосинтез днк, характеристика этапов
- •4. Где синтезируется, чем и где активируется карбоксипептидаза?
- •5. Гниение белков в кишечнике. Как обезвреживаются продукты гниения белков. Привести примеры.
- •10. Каков состав желудочного сока и какое количество его образуется за сутки в желудке?
- •11. Какова роль витамина в6 в обмене белков? Приведите конкретные примеры.
- •19.. Назовите виды рнк и какова их роль в биосинтезе белков
- •21. Назовите конечный продукт обмена пуринов у здоровых людей. Назовите заболевание
- •26. Назовите факторы, определяющие состояние белкового обмена у человека
- •27. Назовите экзогенные и эндогенные факторы, определяющие состояние белкового обмена у человека.
- •28. Написать все виды реакций дезаминирования аминокислот. Характеристика ферментов, катализирующие эти реакции
- •30. Напишите реакцию обезвреживания фенола. Где и из чего образуется фенол
- •51. Обмен серусодержащих аминокислот
- •54.Объясните механизм активации протеолитических ферментов.
- •58Переваривание белков. Характеристика ферментов желудочно-кишечного тракта.
- •Представления о механизме биосинтеза белка.
- •76 Биосинтез рнк
- •77Синтез заменимых аминокислот в организме. Привести примеры.
58Переваривание белков. Характеристика ферментов желудочно-кишечного тракта.
Пищевые белки химически представляют собой длинные цепи аминокислот, соединенных друг с другом пептидными связями. Характеристика каждого белка определяется типом аминокислот в молекуле белка и последовательностью расположения этих аминокислот.
Переваривание белков в желудке. Пепсин — важный фермент желудка, расщепляющий белки. Он наиболее активен при рН 2,0-3,0 и не активен при рН выше 5,0. Вследствие этого для проявления расщепляющего действия белка ферментом желудочный сок должен быть кислым. Как объяснено в главе 64, железы желудка секретируют большое количество соляной кислоты. Эта кислота секретируется париетальными (кислотопродуцирующими) клетками желез при рН, равным приблизительно 0,8. К моменту, когда кислота смешивается с желудочным содержимым и секретом из некислотопродуцирующих железистых клеток желудка, рН уже составляет в среднем 2,0-3,0, что чрезвычайно благоприятно для активности пепсина.
Одной из важных переваривающих особенностей пепсина является его способность переваривать белок коллаген — альбуминоподобный тип белка, который лишь незначительно расщепляется под действием других пищеварительных ферментов. Коллаген — главная составляющая часть межклеточной соединительной ткани мяса; поэтому для расщепления белков мяса ферментами пищеварительного тракта прежде всего необходимо переварить коллагеновые нити. В связи с этим у индивида, у которого отмечается недостаток пепсина в желудочном соке, съеденное мясо хуже подвергается обработке другими пищеварительными ферментами и, следовательно, может хуже перевариваться.Пепсин только начинает процесс переваривания белка, обычно обеспечивая только 10-20% полного переваривания белков и превращение их в альбумозы, пептоны и мелкие полипептиды. Это расщепление белков происходит в результате гидролиза пептидной связи между аминокислотами.
Переваривание белков секретами поджелудочной железы. Переваривание белка преимущественно происходит в верхних отделах тонкого кишечника, в двенадцатиперстной кишке и тощей кишке под воздействием протеолитических ферментов, секретируемых поджелудочной железой. Частично расщепленные продукты белковой пищи, поступая в тонкий кишечник из желудка, подвергаются воздействию главных протеолитических панкреатических ферментов: трипсина, хемотрипсина, карбоксиполипептидазы и проэластазы.
Трипсин и хемотрипсин расщепляют молекулы белка на небольшие полипептиды; карбоксиполипептидаза отщепляет отдельные аминокислоты от карбоксильного конца полипептидов. Проэластаза, в свою очередь, превращается в эластазу, которая затем переваривает эластические волокна, частично содержащиеся в мясных продуктах. Под действием панкреатического сока небольшой процент белков переваривается до аминокислот. Большинство белков расщепляется до дипептидов и трипептидов.
Переваривание белков пептидазами энтероцитов, встроенных в ворсинки тонкого кишечника. Заключительный этап переваривания белков в просвете кишечника обеспечивается энтероцитами тонкого кишечника, которые покрыты ворсинками, преимущественно в двенадцатиперстной кишке и тощей кишке. Эти клетки имеют щеточную каемку, которая состоит из сотен микроворсинок, выступающих над поверхностью клетки. В мембране каждой из этих микроворсинок содержатся многочисленные пептидазы, которые выступают над мембраной, где они взаимодействуют с кишечной жидкостью.
Наиболее важны два типа пептидаз: аминополипептидаза и некоторые дипептидазы. Они доводят расщепление оставшихся крупных полипептидов до дипептидов, трипептидов и меньшего числа аминокислот. И аминокислоты, и дйпептиды с трипептидами свободно транспортируются сквозь мембрану микроворсинок во внутреннюю часть энтероцита.Наконец, внутри цитозоля энтероцитов находятся другие многочисленные пептидазы, которые специфичны для оставшихся связей между аминокислотами. В течение нескольких минут практически все оставшиеся дипептиды и трипептиды перевариваются до конечной стадии в форме отдельных аминокислот; далее они выходят через другую сторону энтероцита, а отсюда — в кровь.
Более 99% конечных продуктов переваривания белков, которые всасываются, являются одиночными аминокислотами. Очень редко происходит всасывание пептидов и чрезвычайно редко всасывается целая молекула белка. Даже крайне малое число всосавшихся молекул цельного белка может иногда вызывать серьезные аллергические или иммунологические нарушения
59. Перечислите пути обезвреживания аммиака в организме
Один
из путей связывания и обезвреживания
аммиака в организме, в частности в мозге,
сетчатке, почках, печени и мышцах,– это
биосинтез глутамина (и, возможно,
аспарагина)

Биосинтез
аспарагина протекает несколько отлично
и зависит от природы ферментов и донора
аммиака. Так, у микроорганизмов и в
животных тканях открыта специфическая
аммиакзависимая аспарагинсинтетаза,
которая катализирует синтез аспарагина
в две стадии:
а) Асп + Е + АТФ –>
Е-аспартил~АМФ + PPi;
б) Е-аспартил~АМФ
+ NН3 –> Асн + Е + АМФ.
Суммарная
ферментативная реакция синтеза аспарагина
может быть представлена в следующем
виде:
Асп + АТФ + NН3 (или Глн) –> Асн
+ АМФ + РРi + (Глу).
Часть аммиака легко
связывается с α-кетоглутаровой кислотой
бла-годаря обратимости глутаматдегидрогеназной
реакции. Если учесть свя-зывание одной
молекулы аммиака при синтезе глутамина,
то нетрудно видеть, что в организме
имеется хорошо функционирующая система,
связывающая две молекулы аммиака:
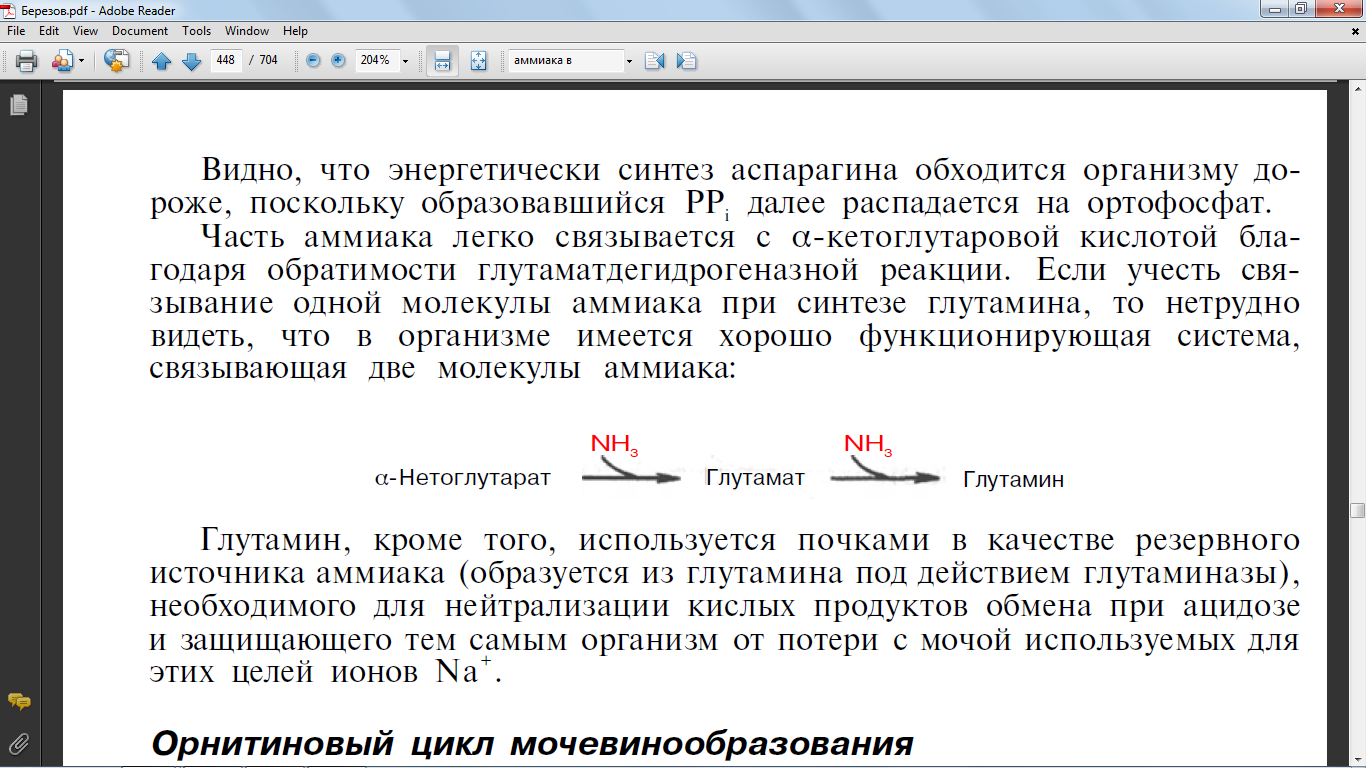
60. Перечислите основные пути превращения безазотистого остатка аминокислот. Приведите конкретные примеры
Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот. Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называюткетогенными. Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, или гликокетогенными.
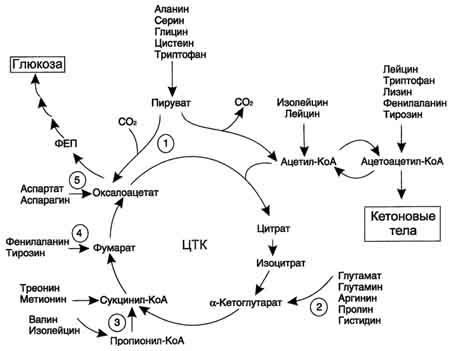
Безазотистые
остатки аминокислот используются для
восполнения того количества метаболитов
общего пути катаболизма, которое
затрачивается на синтез биологически
активных веществ. Такие реакции называют
а![]() наплеротическими.
На рисунке выделены пять анаплеротических
реакций:
наплеротическими.
На рисунке выделены пять анаплеротических
реакций:
1. Фермент пируваткарбоксилаза (кофермент - биотин), катализирующий эту реакцию, обнаружен в печени и мышцах.
2. Аминокислоты → Глутамат → α-Кетоглутарат. Превращение происходит во многих тканях под действием глутаматдегидрогеназы или аминотрансфераз.
 3.
3.
Пропионил-КоА, а затем и сукцинил-КоА могут образоваться также при распаде высших жирных кислот с нечётным числом атомов углерода (см. раздел 8).
4. Аминокислоты → Фумарат
5. Аминокислоты → Оксалоацетат
Реакции 2, 3 происходят во всех тканях (кроме печени и мышц), где отсутствует пируваткарбоксилаза, а реакции 4 и 5 - в основном в печени. Реакции 1 и 3 (рис. 9-22) - основные анаплеротические реакции.
61. Представление об оперонах, обеспечивающих репрессию синтеза белка
теория оперона объясняет следующим образом: при отсутствии в среде Гис или Три регуляторный белок-репрессор не имеет сродства к оператору и происходит синтез ферментов, осуществляющих образование этих аминокислот. Когда в среду добавляют, например, Гис, то эта небольшая молекула, получившая название "корепрессор", присоединяется к белку-репрессору. В результате конформационных изменений в молекуле репрессора комплекс бел-ка-репрессора и корепрессора (Гис) приобретает сродство к оператору, присоединяется к нему, и транскрипция оперона прекращается, т.е. прекращается считывание информации о строении 10 ферментов, участвующих в синтезе этой аминокислоты.
62. Реакции трансаминирования аминокислот, характеристика ферментов, катализирующие эти реакции. Биологическое значение реакций трансаминирования.
Под
трансаминированием подразумевают
реакции межмолекулярного переноса
аминогруппы (NH2—) от аминокислоты на
α-кетокислоту без промежуточного
образования аммиака.Для реакций
трансаминирования характерен общий
механизм. Специфичность трансаминаз
обеспечивается белковым компонентом.
Ферменты трансаминирования катализируют
перенос NH2-группы не на α-кетокислоту,
а сначала на кофермент пиридоксаль-фосфат.
Образовавшееся промежуточное соединение
(шиффово основание) подвергается
внутримолекулярным превращениям
(лабилизация α-водородного атома,
перераспределение энергии связи),
приводящим к освобождению α-кетокислоты
и пиридоксаминфосфата; последний на
второй кетокислотой, что через те же
стадии образования промежуточных
соединений (идущих в обратном направлении)
приводит к синтезу новой аминокислоты
и освобождению пиридоксальфосфата.
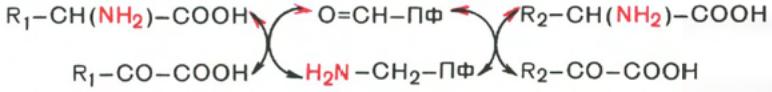
Сущность его сводится к восстановительному аминированию α-кетоглутаровой кислоты с образованием глутаминовой кислоты (реакцию катализирует НАДФ-зависимая глутаматдегидрогеназа, работающая в режиме синтеза) и к последующему трансаминированию глутамата с любой α-кетокислотой. В результате образуется L-аминокислота, соответствующая исходной кетокислоте, и вновь освобождается α-кетоглутаровая кислота, которая может акцептировать новую молекулу аммиака.
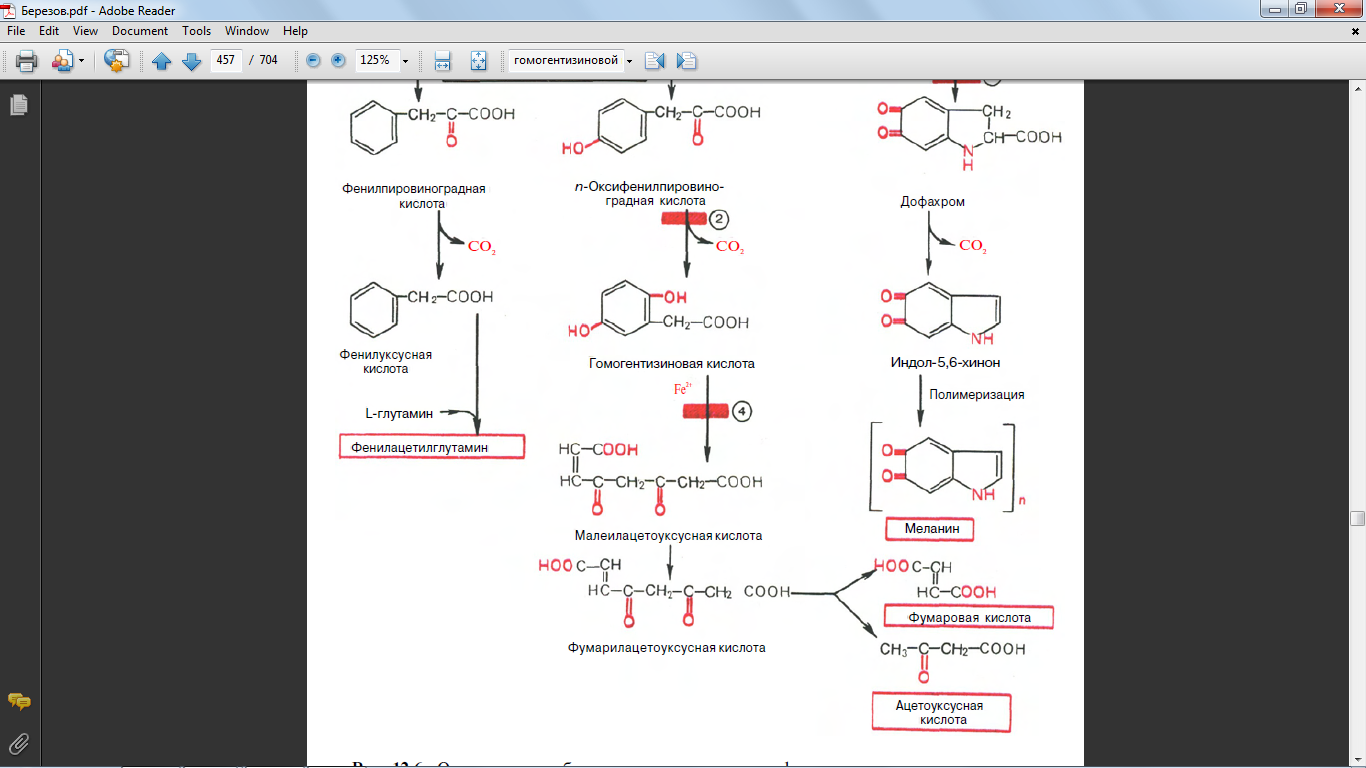
63. синтез из гомогентизиновой кислоты
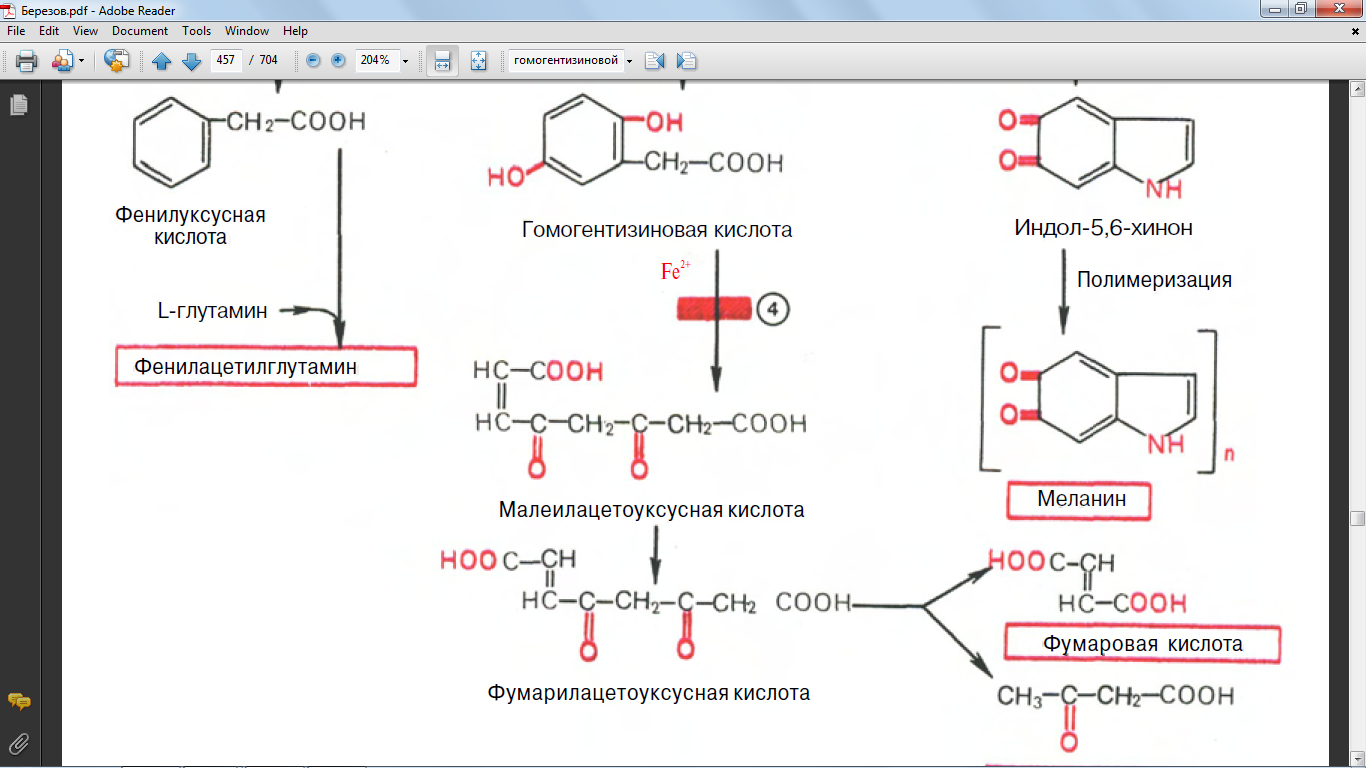
64. синтез из оксифенилпировиноградной кислоты
65. Что такое азотистый баланс? Виды азотистого баланса, приведите примеры
Азотистый баланс – разница между введением с пищей азота и выведением его в виде конечных продуктов азотистого обмена.
Различают 3 вида азотистого баланса:
Положительный – количество выводимого из организма азота меньше количества азота, вводимого с пищей. Азот остается в организме и расходуется на синтез белков. Характерен для растушего организма и во время беременности.
Отрицательный – количество выделяемого азота превышает количество азота, поступающего в течение суток. Встречается при голодании, белковой недостаточности, тяжелых заболеваниях, когда происходит интенсивный распад белков тела. Отрицательный азотистый баланс наблюдается у пожилых людей.
Азотистое равновесие – количество азота выводимого из организма, равно количеству получаемого с пищей азота. Характерно для здорового взрослого человека.
66. Что такое альбуминурия (истинная, ложная, физиологическая, патологическая, почечная
Альбуминурия — выделение белка с мочой, признак нарушения нормальной деятельности почек. Истинная возникает при дегенеративных процессах в мембранах почечных клубочков (гломерулонефрит, амилоидоз почек, нефроз и др.); ложная зависит от примеси в моче большого количества эритроцитов и лейкоцитов, белок которых переходит в мочу. К физиологической альбуминурии относятся случаи временногo появления белка в моче, не связанного с заболеваниями организма. Такая альбуминурия может встречаться у здоровых людей после приема пищи, богатой неденатурированными белками (сырое молоко, сырые яйца и др.). Патологическая или почечная альбуминурия является более важной из всех видов наличия белка в моче, ибо ее появление связано с патологией почки.
67. Что такое и чему равен физиологический минимум белка? Назовите нормы белка в питании
физиологический минимум белка — наименьшее количество вводимого с пищей белка, при котором сохраняется азотистое равновесие. Для взрослых достаточно 1–1,5 грамма белка в день на 1 килограмм веса тела.
68. Что такое кислотность желудочного сока? Чему она равна в норме и как изменяется при различных патологиях
Кисло́тность желу́дочного со́ка — характеристика концентрации кислоты в желудочном соке. Измеряется в единицах рН. Нормальная кислотность в просвете тела желудка натощак: 1,5 — 2,0 рН В лаборатории кислотность желудочного сока определяют титрованием его раствором едкого натра (NaOH) с участием различных химических индикаторов, меняющих свой цвет в зависимости от кислотности среды. Разделяют понятия общей кислотности желудочного сока, свободной и связанной кислотности. Кислотность желудочного сока выражают или в титрационных единицах (количестве мл едкого натра, необходимого для нейтрализации кислоты в 100 мл желудочного сока) или в ммоль/л HCl на 1 л желудочного сока. Численно эти значения совпадают. Обычно при титровании используют 5 мл желудочного сока. Поэтому, после титрования, нейтрализованное количество NaOH умножают на 20.
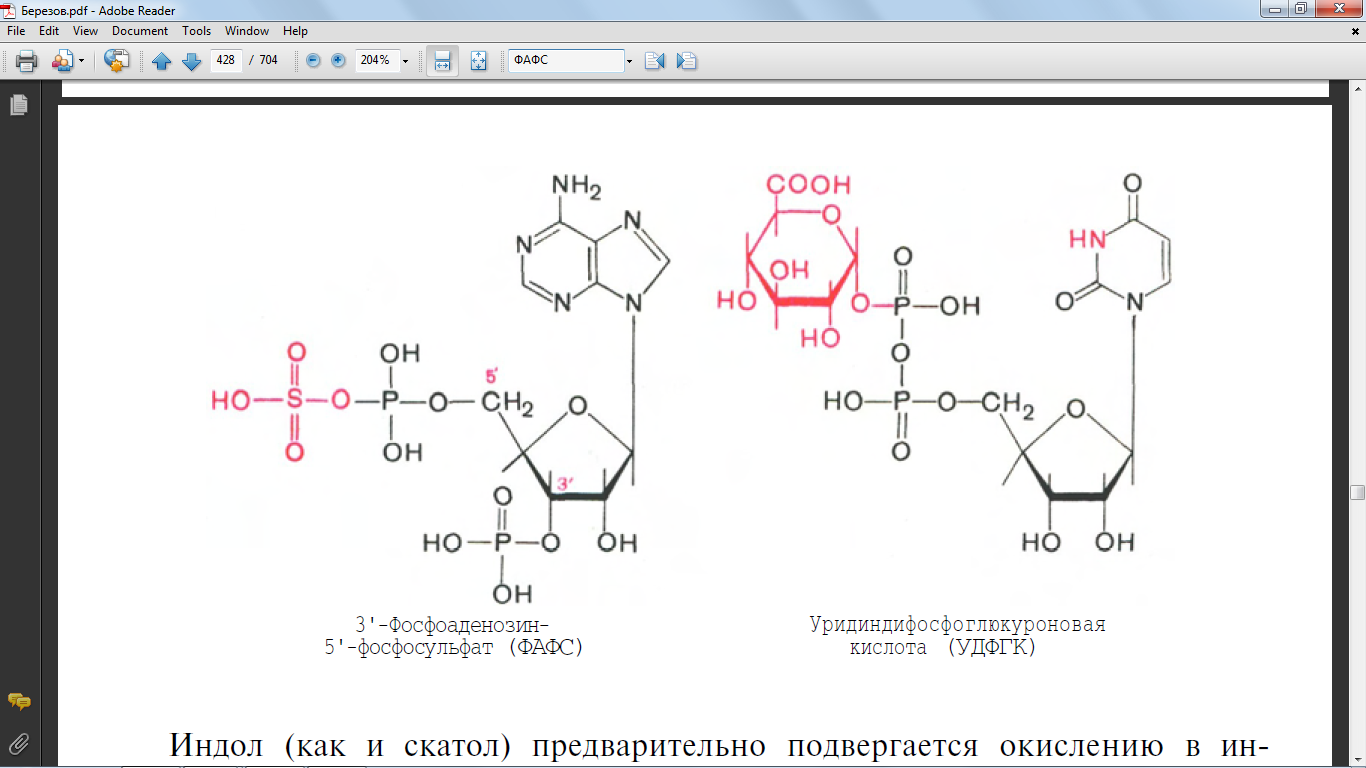
70. Напишите формулу 3-фосфоаденозин-5-фосфосульфат (ФАФС
71. Переваривание белков в кишечнике. Характеристика ферментов, участвующих в этом процессе
Трипсин и химотрипсин действуют на белки аналогично пепсину, разрывают другие внутренние пептидные связи; оба фермента наиболее активны в слабощелочной среде (рН 7,2–7,8). Благодаря гидролитическому действию на белки всех трех эндопептидаз (пепсин, трипсин, химотрипсин) образуются различной длины пептиды и некоторое количество свободных аминокислот. Дальнейший гидролиз пептидов до свободных аминокислот осуществляется под влиянием группы ферментов – пептидаз. Помимо панкреатической карбоксипептидазы, на пептиды действуют кишечная аминопептидаза и разнообразные дипептидазы. Точкой приложения аминопептидазы является пептидная связь с N-конца пептида. Карбоксипептидаза разрывает пептидную связь с противоположного С-конца пептида. Эти ферменты отщепляют по одной аминокислоте от полипептида. В итоге остаются дипептиды, на которые действуют специфические дипептидазы, при этом образуются свободные аминокислоты, которые затем всасываются. Из других ферментов протеолиза следует упомянуть об эластазе и коллагеназе поджелудочной железы, гидролизующих соответственно эластин и коллаген. Топографически основные процессы гидролиза белков, как и углеводов и жиров, протекают на поверхности слизистой оболочки кишечника.
