
- •Випарні апарати й установки
- •Загальні поняття про випарювання
- •3.2 Тепловіддача випарних апаратів
- •3.2 Класифікація випарних апаратів й установок, їх застосування
- •3.3 Конструкція випарних апаратів
- •3.4. Сепарація вторинної пари у випарних установках
- •3.5 Принципові схемі багатокорпусних випарних установок безперервної дії
Випарні апарати й установки
Загальні поняття про випарювання
Випарювання - термічний процес концентрування (згущення) розчину, що полягає у видаленні рідкого розчинника шляхом його випару. Іншими словами, це процес кипіння розчину з виділенням пар розчинників чистому виді, при цьому розчинна нелетуча речовина (тверде тіло, наприклад, сіль або грузла рідина, наприклад вазелін) залишається в концентрованому виді в апарату. Одержувані при випарюванні пари віддаляються в атмосферу або в пристрій, що конденсує.
У технологічних процесах у різних галузях промисловості випарюються в основному водяні розчини різних нелетучих речовин. В елементарному виді процес випарювання можна здійснити в простій відкритій або закритій посудині, наповненій розчином, при підведенні йому тепла для кипіння й відводі пар, що утворяться, в атмосферу або в пристрій, що конденсує.
За принципом роботи й конструкції випарні апарати мають багато загального з випарниками, у яких відбувається процес кипіння чистої води. Однак існує й принципова відмінність цих двох процесів (випарювання й випар). Припускаємо, що є дві відкритих посудини, що обігрівають пором через парові сорочки. У першій посудині перебуває чиста вода, в іншому – 70%ный водяний розчин аміачному селітри NH4NO3 . Нехай тиск пари, що гріє, буде однаковим 4 105 Па. Вода закипить при t~100°С, розчин при тім же атмосферному тиску тільки при t~120°С. Однак водяні пари, що утворяться із цього° розчину, будуть мати t ту ж, що й у випадку кипіння чистої води,°тобто t~100 С. Зниження температури t° водяних пар, що утворяться з розчину, у° порівнянні з t кипіння розчину називають фізико-хімічною депресією (Δ1):
Δ1 = tр – υ – тэта,
де tр - t° кипіння розчину, °С
υ - t° пар, що утворяться, води (або, у загальному випадку, розчинника),С.
Фізико-хімічна температурна депресія різна для різних розчинів. Вона більше з розчинів речовин з малою молекулярною вагою. Для розчину того самого речовини фізико-хімічна температурна депресія збільшується з підвищенням його концентрації.
Під концентрацією розчину розуміють відношення маси сухої речовини в розчині до загальної маси розчину виражене в %:

де b - масова концентрація розчину, % ;
W - кількість розчинника або води в розчині, кг;
Gсух - кількість розчиненої або сухої речовини в розчині, кг.
При випарюванні вага сухої речовини в розчині залишається постійним, а кількість розчинника (води) змінюється; отже, при цьому концентрація розчину збільшується фізико-хімічна температурна депресія для різних розчинів може бути визначена по довідниках. Довідкові дані звичайно ставляться до умов кипіння рідини при атмосферному тиску. На практиці випарювання часто ведуть і під вакуумом, і під тиском.
У таких випадках розрахункова фізико-хімічна температурна депресія може бути обчислена по формулі И.А. Тищенко:

 табличне значення
фізико-хімічної температурної депресії
при тиску 760 мм.рт.ст.
табличне значення
фізико-хімічної температурної депресії
при тиску 760 мм.рт.ст.
T - температура кипіння чистого розчинника;
r - скрита теплота паротворення для води при тиску випарювання, кДж/кг.
Процес випарки характерний не тільки наявністю фізико-хімічної температурної депресії, але й значною зміною фізичних констант розчину, пов'язаних зі зміною його концентрації. З ростом концентрації розчину збільшується його в'язкість, щільність і знижується теплоємність і теплопровідність.
Питому теплоємність розчину визначають по формулі
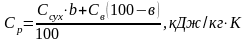 ,
,
де Ссух - питома теплоємність безводної нелетучої речовини, розчин якого випарюється (визначають по довіднику), кДж/кг;
Св - теплоємність води, кДж/кгК;
в - процентний вміст речовини в розчині.
Внаслідок збільшення в'язкості розчинів і зниження їхньої теплопровідності й теплоємності зменшується й коефіцієнт тепловіддачі від стінки, що гріє, до киплячого розчину.
