
- •2. Биосинтез днк, характеристика этапов
- •4. Где синтезируется, чем и где активируется карбоксипептидаза?
- •5. Гниение белков в кишечнике. Как обезвреживаются продукты гниения белков. Привести примеры.
- •10. Каков состав желудочного сока и какое количество его образуется за сутки в желудке?
- •11. Какова роль витамина в6 в обмене белков? Приведите конкретные примеры.
- •19.. Назовите виды рнк и какова их роль в биосинтезе белков
- •20. Назовите компоненты белок-синтезирующей системы
- •21. Назовите конечный продукт обмена пуринов у здоровых людей. Назовите заболевание
- •26. Назовите факторы, определяющие состояние белкового обмена у человека
- •27. Назовите экзогенные и эндогенные факторы, определяющие состояние белкового обмена у человека.
- •28. Написать все виды реакций дезаминирования аминокислот. Характеристика ферментов, катализирующие эти реакции
- •30. Напишите реакцию обезвреживания фенола. Где и из чего образуется фенол
26. Назовите факторы, определяющие состояние белкового обмена у человека
Направление и интенсивность обмена белков в первую очередь определяются физиологическим состоянием организма и несомненно регулируются, как и все другие виды обмена, нейрогормональными факторами. Синтез белка подчиняется закону «все или ничего» и осуществляется при условии наличия в клетке полного набора всех 20 аминокислот. Даже при поступлении всех аминокислот с пищей организм может испытывать состояние белковой недостаточности, если всасывание какой-либо однойаминокислоты в кишечнике замедлено или если она разрушается в большей степени, чем в норме, под действием кишечной микрофлоры. Таким образом, состояние белкового обмена определяется множеством факторов, как экзогенных (окружающая среда, характер питания и др.), так и эндогенных (физиологическое состояние организма, включающее нервно-гормональный статус, ферментная оснащенность и др.). Любые отклонения от нормального физиологического состояния организма отражаются на азотистом обмене.
27. Назовите экзогенные и эндогенные факторы, определяющие состояние белкового обмена у человека.
экзогенных (окружающая среда, характер питания и др.), так и эндогенных (физиологическое состояние организма, включающее нервно-гормональный статус, ферментная оснащенность и др.)
28. Написать все виды реакций дезаминирования аминокислот. Характеристика ферментов, катализирующие эти реакции


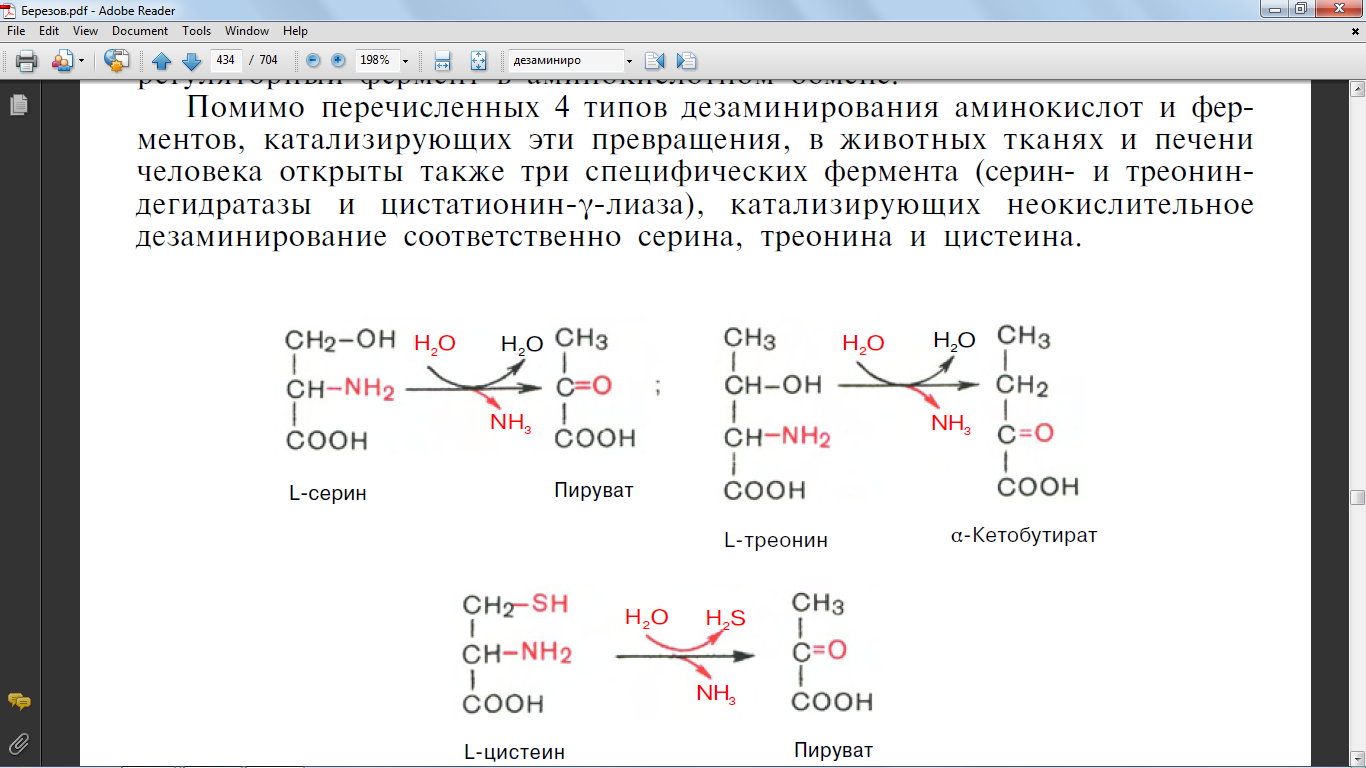
29. Написать все виды реакций декарбоксилирования аминокислот. Характеристика ферментов, катализирующие эти реакции. Биогенные амины: серотонин, гистамин, гамма-аминомаслянная кислота, их биологическая роль.

Серотонин регулирует артериальное давление, температуру тела,
дыхание, почечную фильтрацию и является медиатором нервных процессов
в ЦНС. Некоторые авторы считают серотонин причастным к развитию
аллергии, демпинг-синдрома, токсикоза беременных, карциноидного син-
дрома и геморрагических диатезов.
гистамин участвует в секреции соляной кислоты в желудке, что широко используется в клинике при изучении секреторной деятельности желудка (гистаминовая проба). Он имеет прямое отношение к явлениям сенсибилизации и десенсибилизации.
При повышенной чувствительности к гистамину в клинике используют
антигистаминные препараты (санорин, димедрол и др.), оказывающие
влияние на рецепторы сосудов. Гистамину приписывают также роль ме-
диатора боли.
Интерес к ГАМК объясняется ее тормозящим действием на деятельность ЦНС.
30. Напишите реакцию обезвреживания фенола. Где и из чего образуется фенол

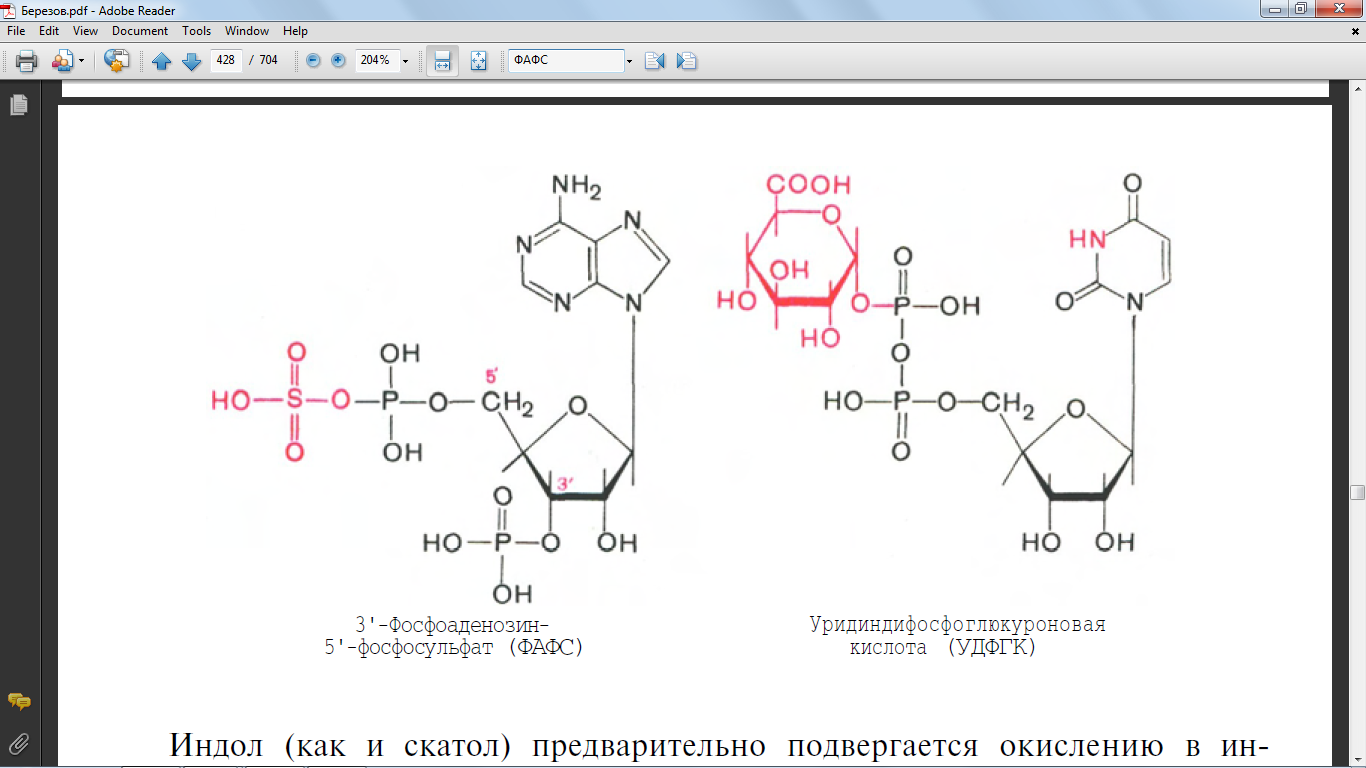
Под действием ферментов бактерий из аминокислоты тирозина может образовываться фенол путём разрушения боковых цепей аминокислот микробами. Всосавшиеся продукты по воротной вене поступают в печеНb, где обезвреживание фенола может происходить путём конъюгации с сернокислотным остатком (ФАФС) или с глюкуроновой кислотой в составе УДФ-глюкуроната. Реакции конъюгации фенола с ФАФС катализирует фермент сульфотрансфераза. Конъюгация глюкуроновых кислот с фенолом происходит при участии фермента УДФ-глюкуронилтрансферазы.
31. Напишите схематично общие пути распада аминокислот в тканях до конечных продуктов. Напишите реакции распада аланина до конечных продуктов
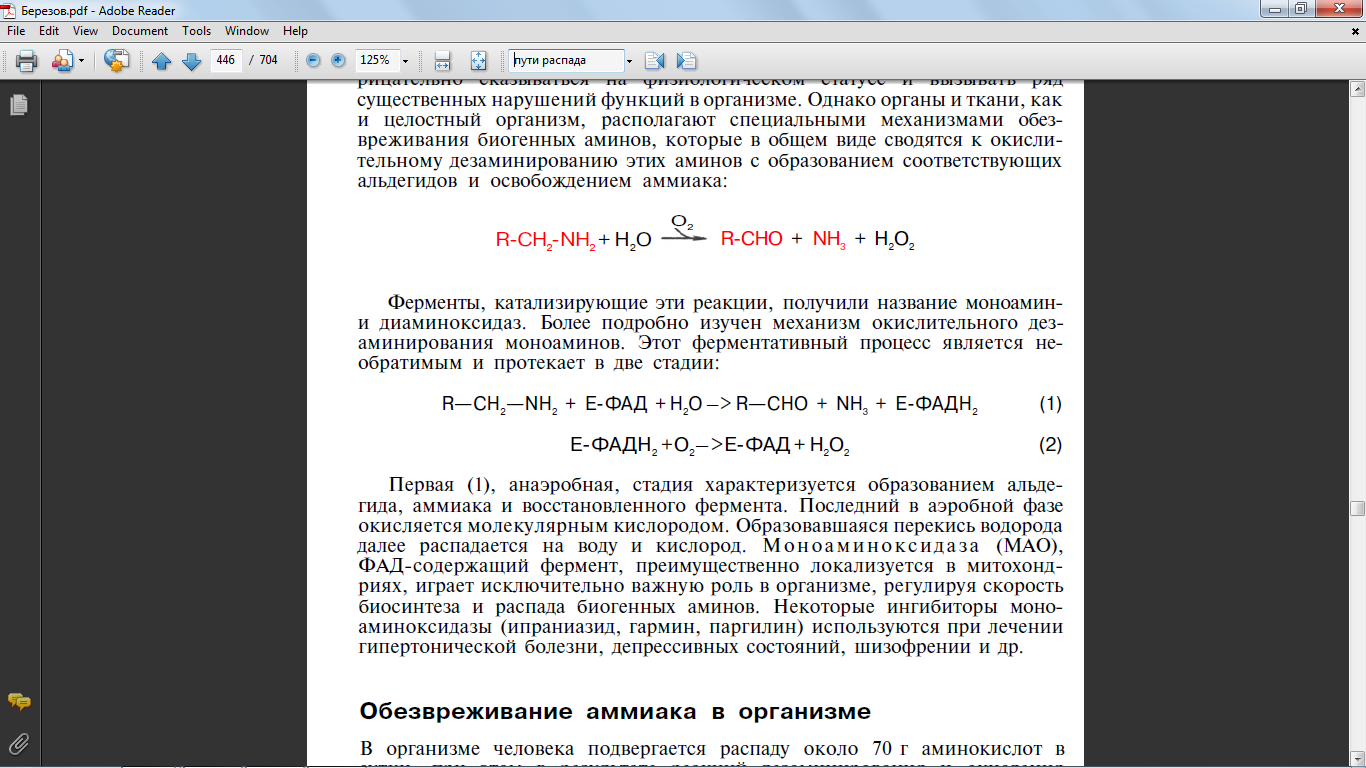
32,36,37 Напишите реакции распада пиримидиновых нуклеотидов
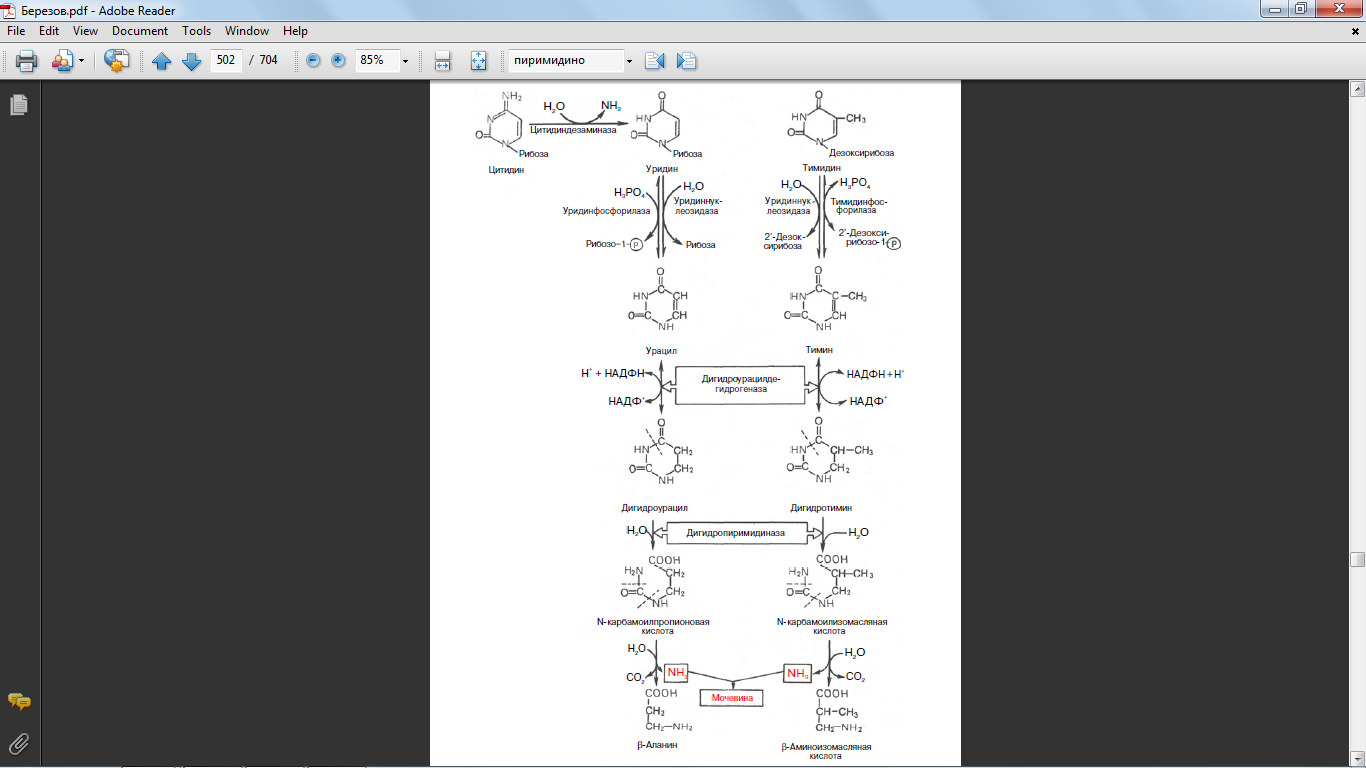
33,38 Напишите реакции распада пуриновых нуклеотидов, укажите ферменты, катализирующие этот процесс
34,35 Напишите реакции синтеза креатина, укажите ферменты. Где протекают эти реакции
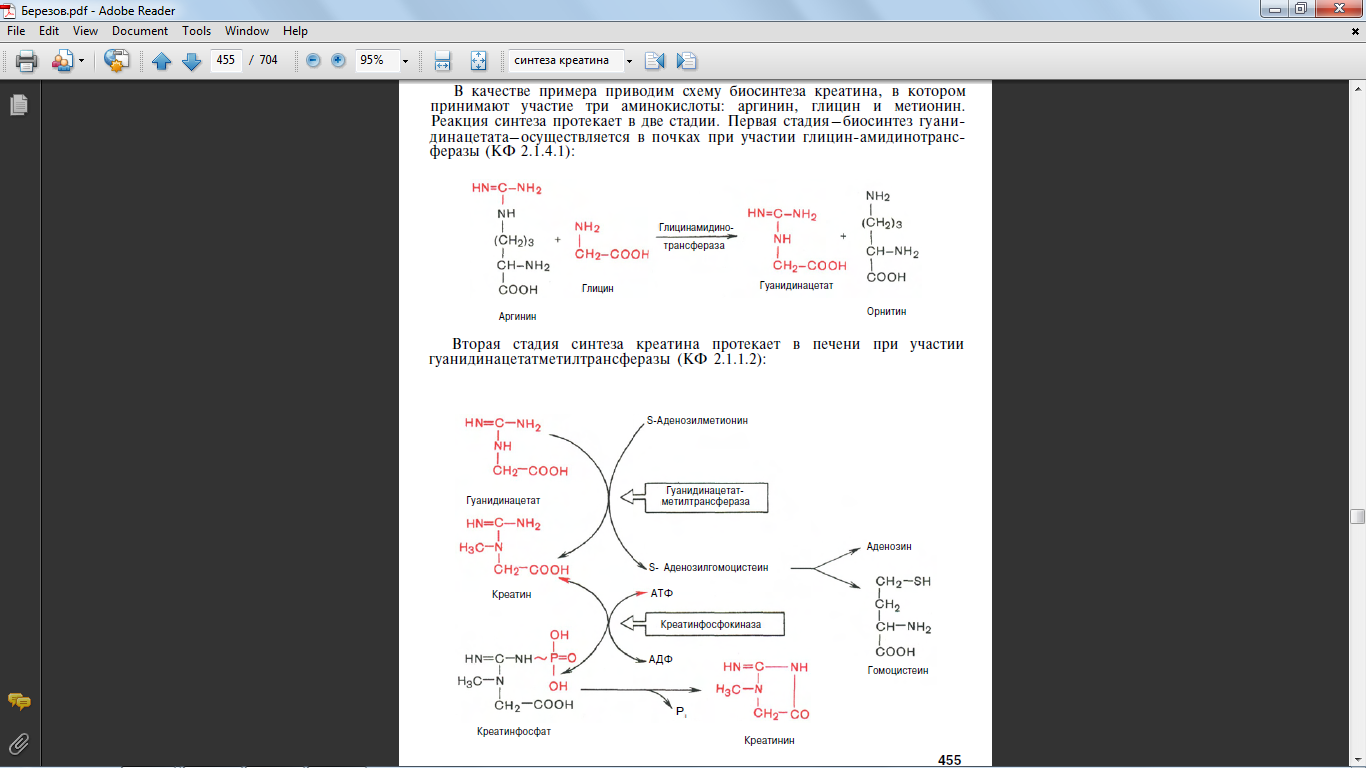
39 Напишите реакцию образования гиппуровой кислоты. Где протекает эта реакция. в печени
40. Напишите реакцию синтеза дезокси-ТМФ, укажите фермент. Какова роль тетрагидрофолиевой кислоты в этом процессе
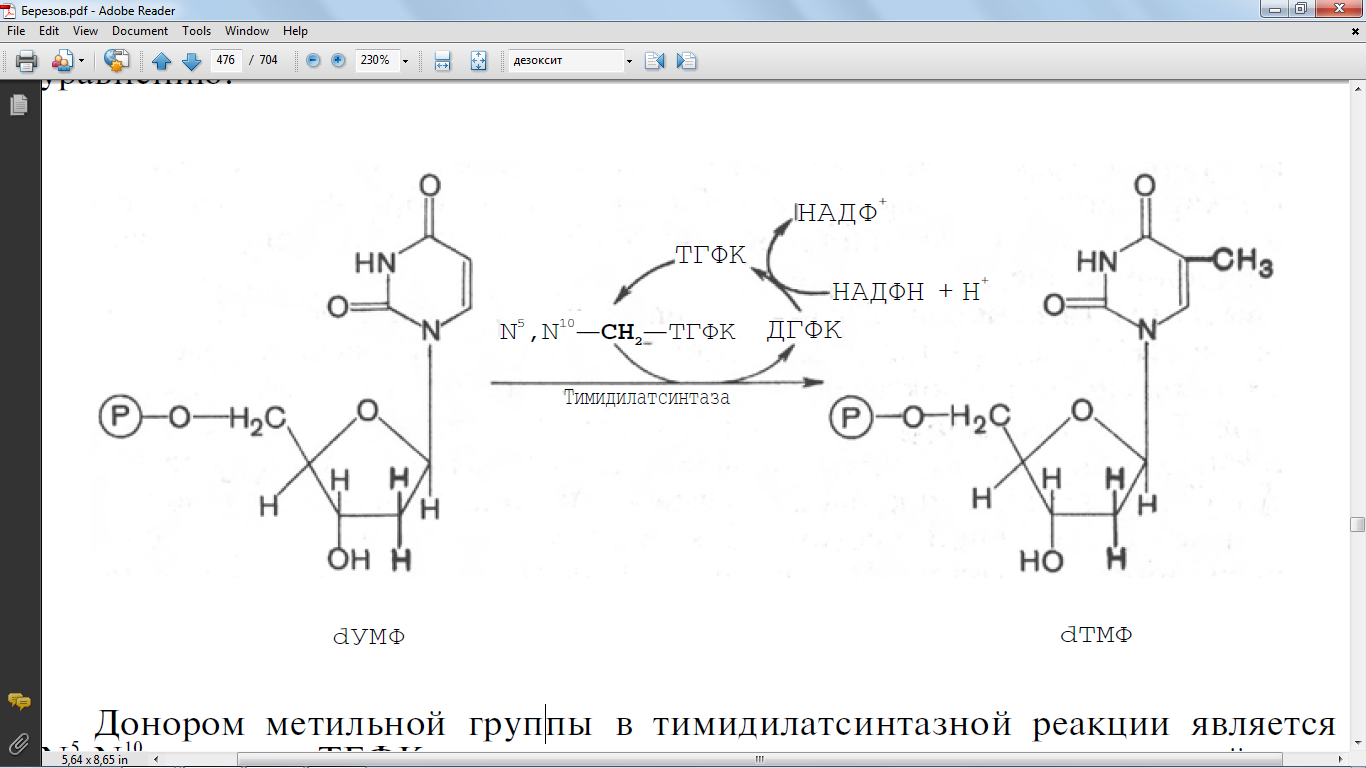
Донором метильной группы в тимидилатсинтазной реакции является
N5,N10-метилен-ТГФК, которая одновременно отдает и водородный про-
тон, поэтому одним из конечных продуктов реакции является не тетра-
гидро-, а дигидрофолиевая кислота (ДГФК). Последняя вновь восста-
навливается до ТГФК под действием НАДФН-зависимой дигидрофолат-
редуктазы.
41. Напишите схематически формулу амино-ацил-аденилата. Назовите фермент, катализирующий эту реакцию

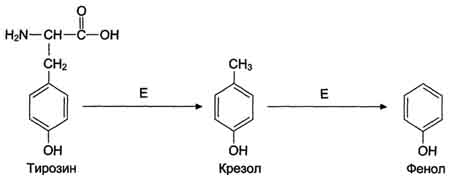
42. Напишите формулами реакции образования крезола и фенола из тирозина
Под
действием ферментов бактерий из
аминокислоты тирозина могут образовываться
фенол и крезол путём разрушения боковых
цепей аминокислот микробами.
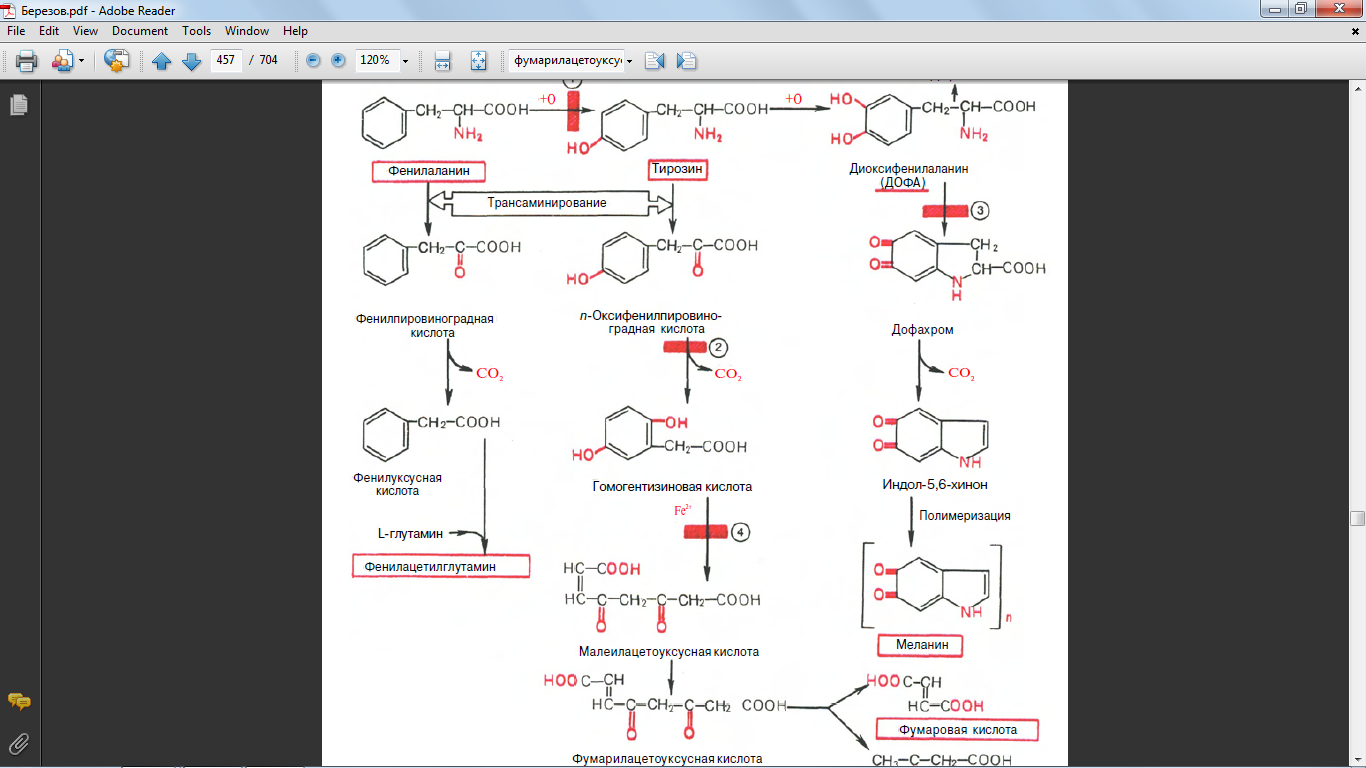
43. Напишите формулами реакцию образования фумарилацетоуксусной кислоты
44. Напишите формулами реакцию образования 5-фосфорибозил-1-пирофосфата (ФРПФ) из рибозо-5-фосфата
45. Напишите формулами реакцию образования гомогентизиновой кислоты
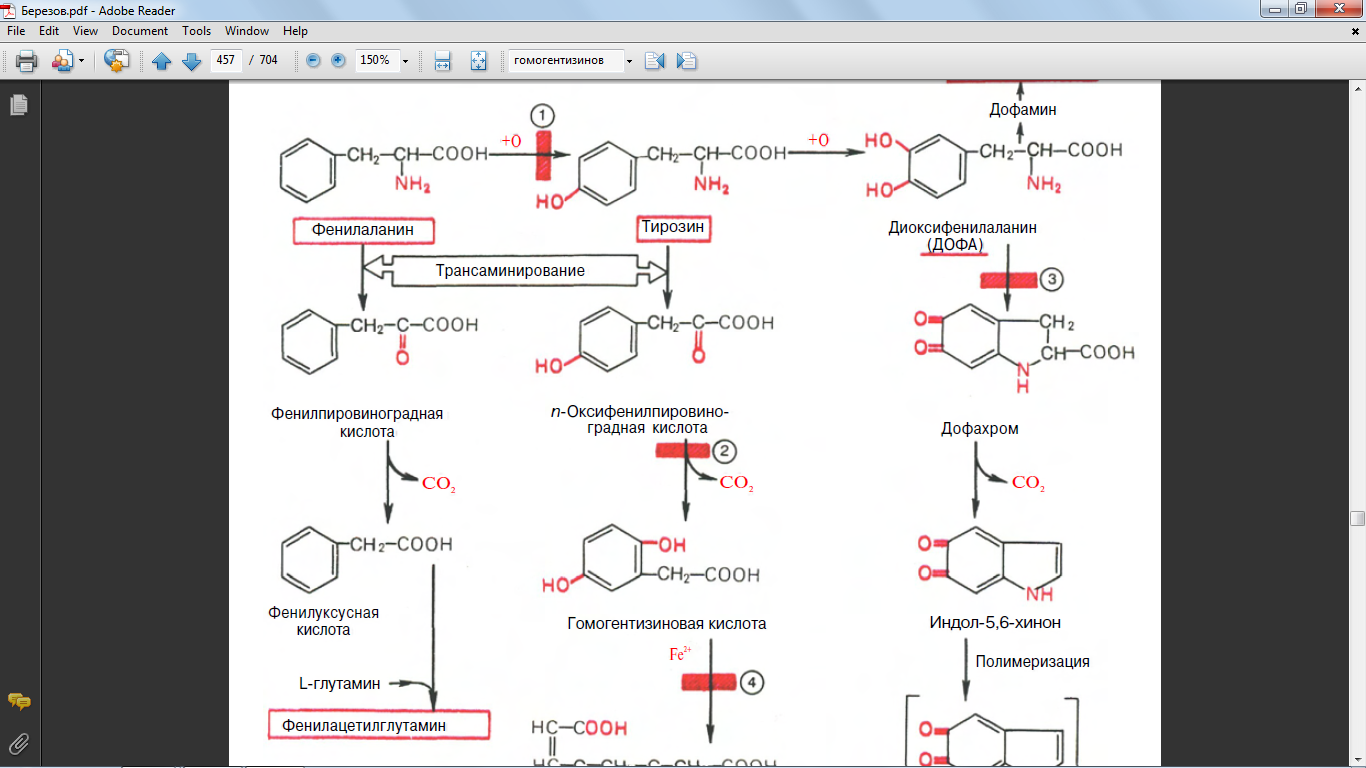
46. Напишите формулами реакцию образования из фенилаланина фенилпировиноградной кислоты
47. Напишите формулами реакцию образования серина из глицина. Какова роль тетрагидрофолиевой кислоты (ТГФК) в этой реакции?

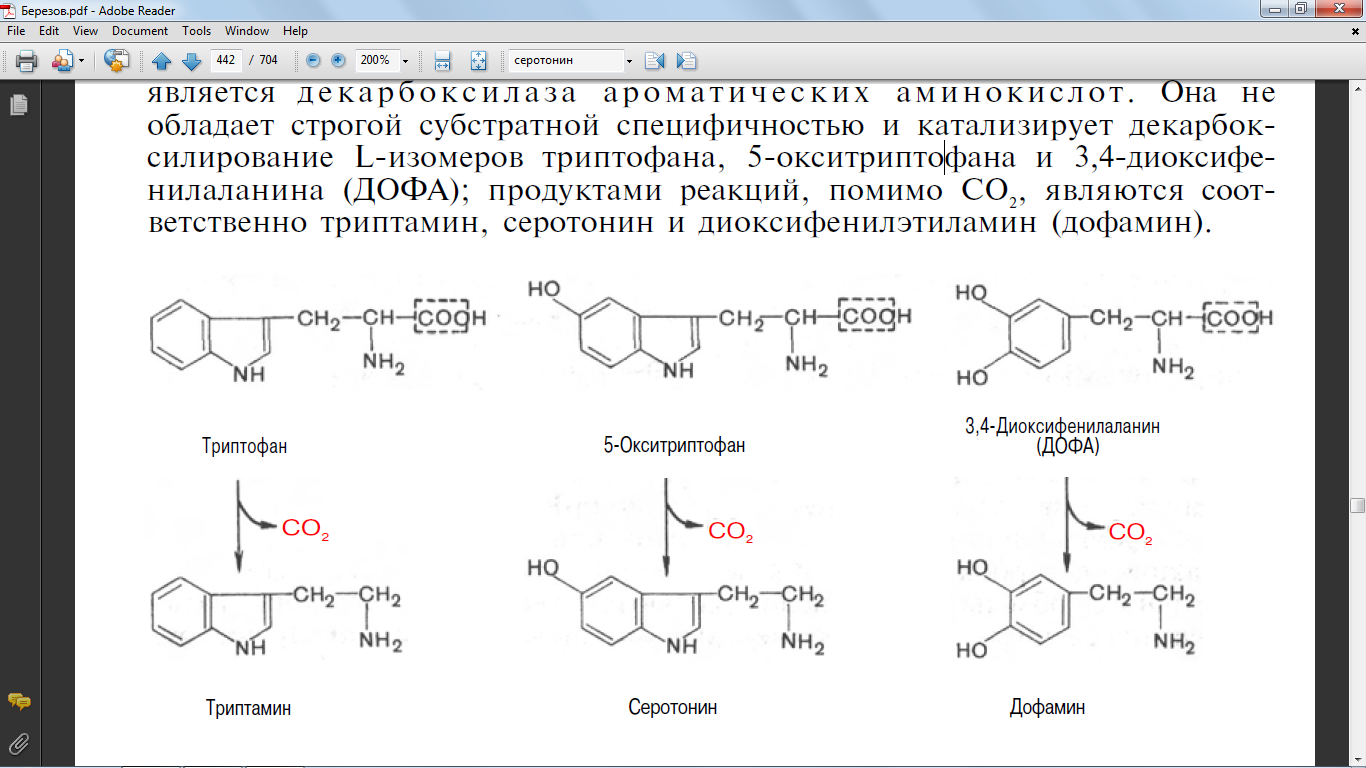
48. Напишите формулами реакцию образования серотонина, укажите ферменты.
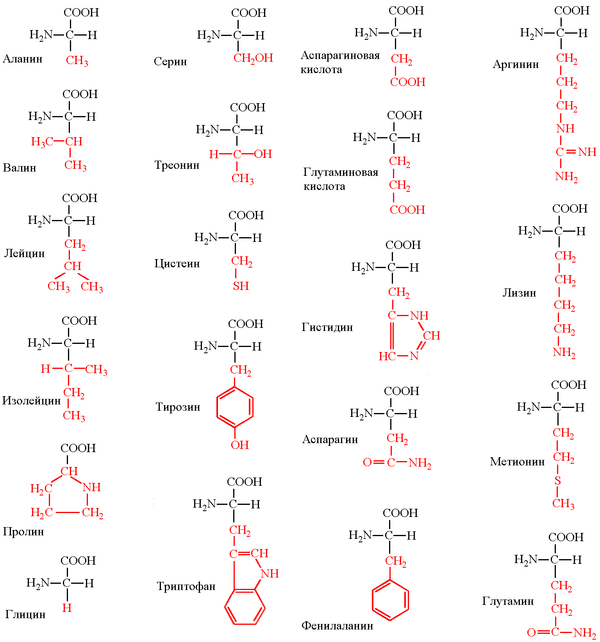
49. Напишите формулы заменимых аминокислот
50. Нарушение обмена пуриновых нуклеотидов. Подагра
Нарушение обмена пуриновых оснований — это избыточное образование и накопление мочевой кислоты в виде солей – уратов. Проявляется нарушением содержания в крови мочевой кислоты (гиперурикемией). Типичное заболевание, связанное с гиперурикемией – подагра. Нарушение пуринового обмена сопровождается и нарушением жирового обмена. Поэтому у многих больных увеличивается масса тела, прогрессирует атеросклероз аорты и коронарных артерий, развивается ишемическая болезнь сердца, стойко повышается артериальное давление. Подагра – хроническое заболевание, протекающее с повторными приступами острого артрита, кристаллиндуцированными синовитами, отложением уратов в тканях. Подагра чаще развивается в течение пятого десятилетия жизни. Распространенность подагры составляет 0.1%. Мужчины болеют в 20 раз чаще, чем женщины. Различают первичную и вторичную подагру. Первичная подагра — самостоятельное заболевание при котором повышение уровня мочевой кислоты обусловлено генетическими нарушениями. Вторичная подагра — проявление других болезней (миелолейкозы, псориаз, ХПН, гемоглобинопатии, врожденные пороки сердца с эритроцитозом) или следствие применения лекарственных средств (рибоксин, цитостатики, салуретики и др.).
51. Обмен серусодержащих аминокислот
Метионин -
незаменимая аминокислота. Она необходима
для синтеза белков организма, участвует
в реакциях дезаминирования, является
источником атома серы для синтеза
цистеина. Метионил-тРНК участвует в
инициации процесса трансляции.
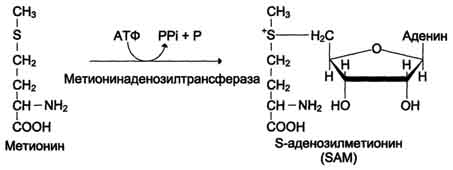 Для
синтеза цистеина необходимы 2
аминокислоты:
Серин -
источник углеродного скелета;
Метионин -
первичный источник атома S (см. схему
А).
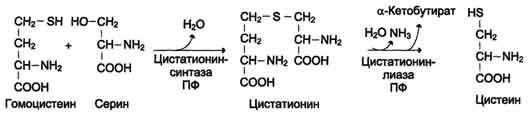
Синтез цистеина из гомоцистеина
происходит в 2 стадии под действием
пиридоксальзависимых ферментов
цистатионинсинтазы и цис-татионинлиазы.
Для
синтеза цистеина необходимы 2
аминокислоты:
Серин -
источник углеродного скелета;
Метионин -
первичный источник атома S (см. схему
А).
Синтез цистеина из гомоцистеина
происходит в 2 стадии под действием
пиридоксальзависимых ферментов
цистатионинсинтазы и цис-татионинлиазы.
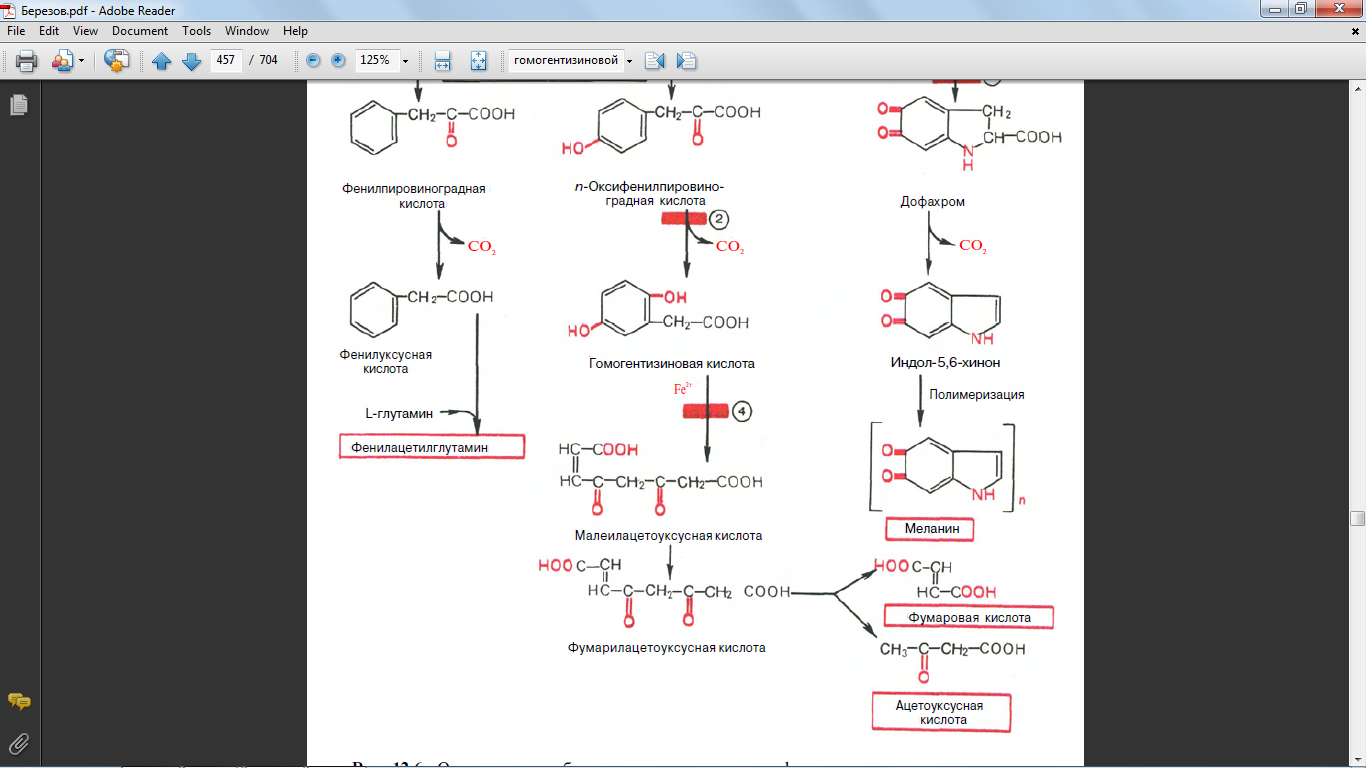
52. Обмен фенилаланинина и тирозина. Биохимические дефекты
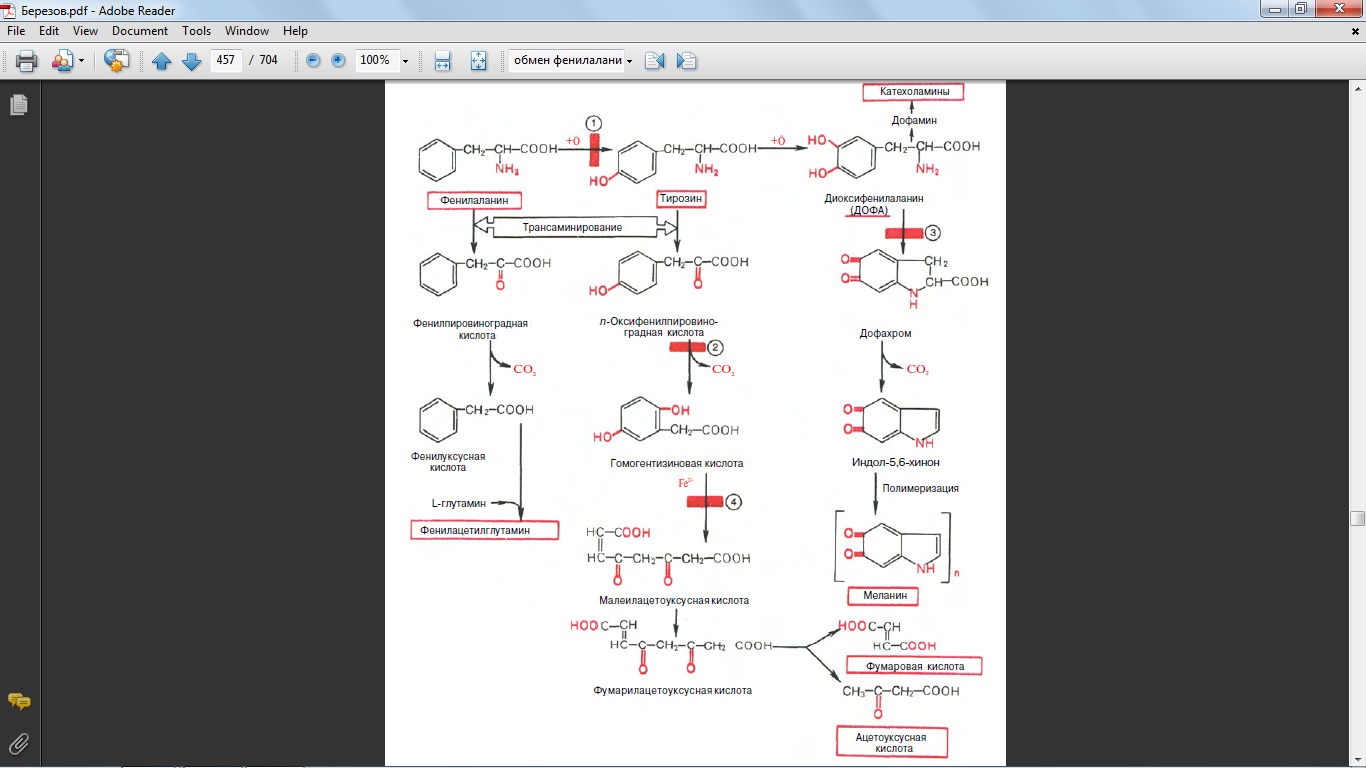
Фенилаланин и тирозин являются также предшественниками меланинов. В этом важном биологическом процессе, обеспечивающем пигментацию кожи, глаз, волос, активное участие принимает фермент тирозиназа.
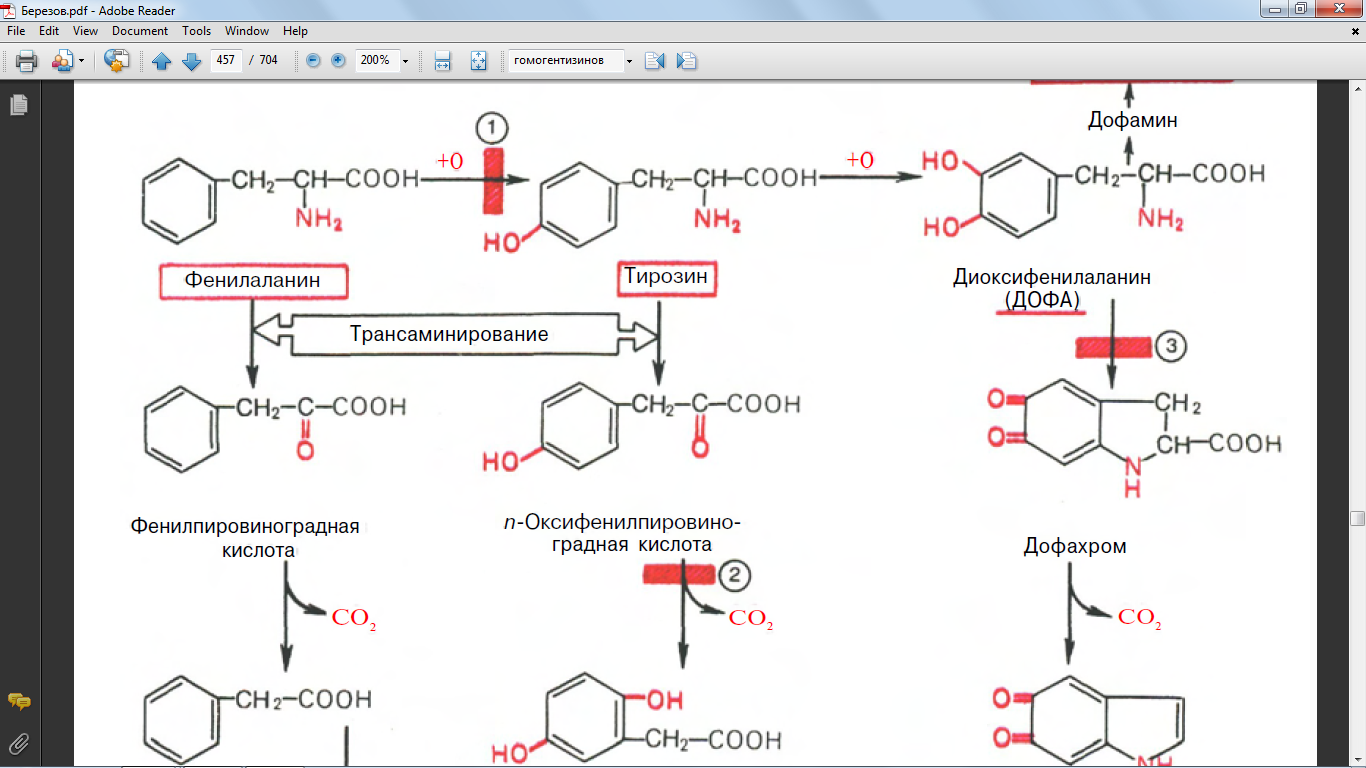
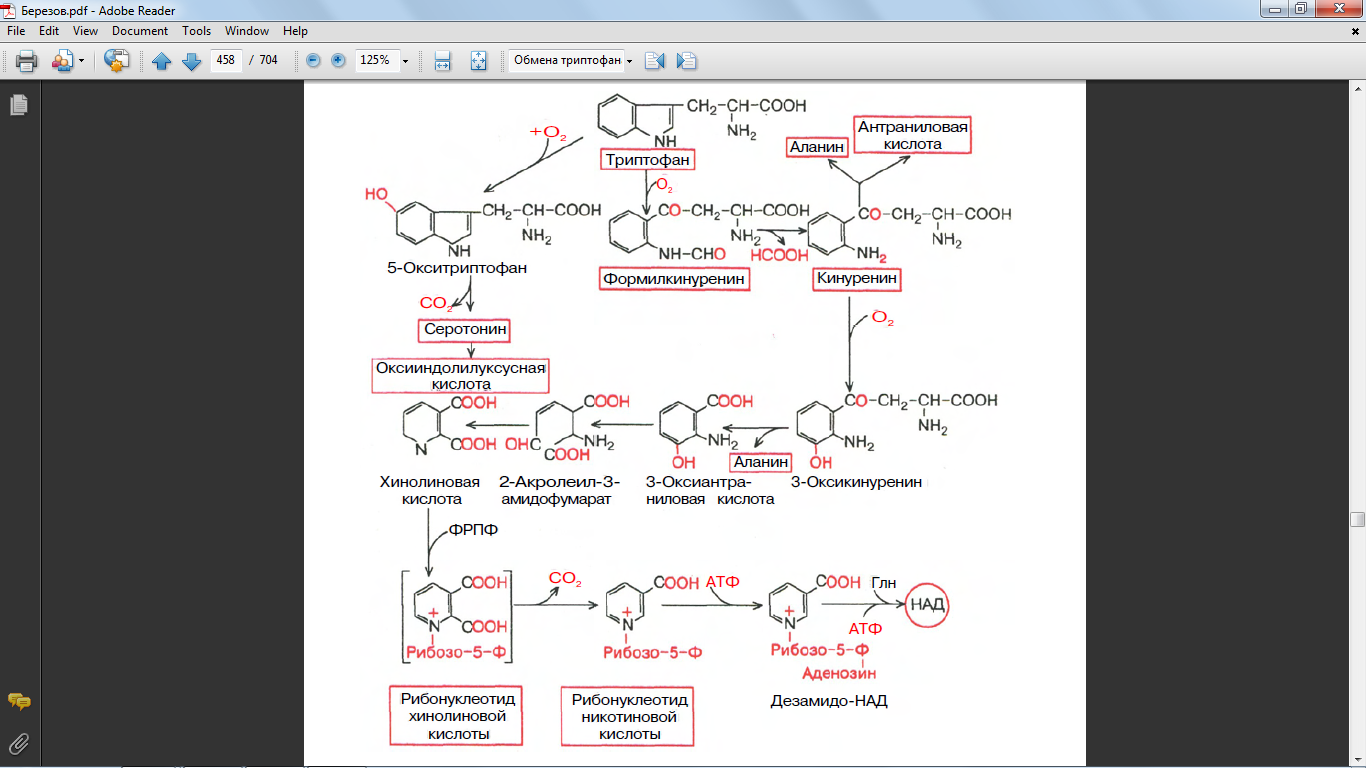
53. Обмена триптофана (кинурениновый путь писать в виде схемы)
56. Объясните что такое индукция и репрессия синтеза белка
“Включение” синтеза белка называется индукцией, репрессия – выключение
57. Переваривание белков в желудке. Характеристика ферментов, участвующих в этом процессе
В желудке имеются все условия для переваривания белков. Во-первых, в желудочном соке содержится активный фермент пепсин. Во-вторых, благодаря наличию в желудочном соке свободной соляной кислоты для действия пепсина создается оптимальная среда (рН 1,5–2,5). Следует особо указать на существенную роль соляной кислоты в переваривании белков: она переводит неактивный пепсиноген в активный пепсин, создает оптимальную среду для действия пепсина; в присутствии соляной кислоты происходят набухание белков, частичная денатурация и, возможно, гидролиз сложных белков. Кроме того, соляная кислота стимулирует выработку секретина в двенадцатиперстной кишке, ускоряет всасывание железа и оказывает бактерицидное действие.
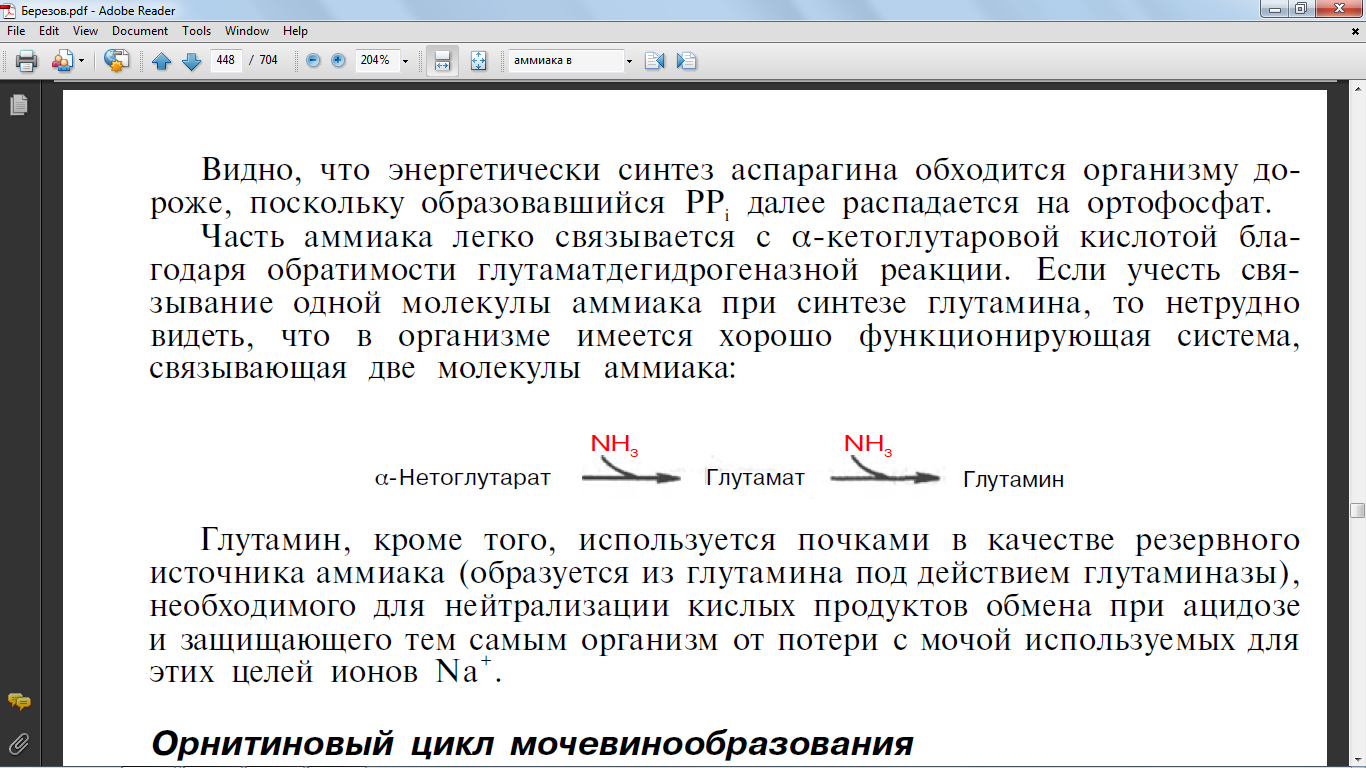
59. Перечислите пути обезвреживания аммиака в организме
Один
из путей связывания и обезвреживания
аммиака в организме, в частности в мозге,
сетчатке, почках, печени и мышцах,– это
биосинтез глутамина (и, возможно,
аспарагина)

Биосинтез
аспарагина протекает несколько отлично
и зависит от природы ферментов и донора
аммиака. Так, у микроорганизмов и в
животных тканях открыта специфическая
аммиакзависимая аспарагинсинтетаза,
которая катализирует синтез аспарагина
в две стадии:
а) Асп + Е + АТФ –>
Е-аспартил~АМФ + PPi;
б) Е-аспартил~АМФ
+ NН3 –> Асн + Е + АМФ.
Суммарная
ферментативная реакция синтеза аспарагина
может быть представлена в следующем
виде:
Асп + АТФ + NН3 (или Глн) –> Асн
+ АМФ + РРi + (Глу).
Часть аммиака легко
связывается с α-кетоглутаровой кислотой
бла-годаря обратимости глутаматдегидрогеназной
реакции. Если учесть свя-зывание одной
молекулы аммиака при синтезе глутамина,
то нетрудно видеть, что в организме
имеется хорошо функционирующая система,
связывающая две молекулы аммиака:
60. Перечислите основные пути превращения безазотистого остатка аминокислот. Приведите конкретные примеры
Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь катаболизма: пируват, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат, оксалоацетат Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе гликогенных аминокислот. Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Такие аминокислоты называюткетогенными. Ряд аминокислот используется и для синтеза глюкозы, и для синтеза кетоновых тел, так как в процессе их катаболизма образуются 2 продукта - определённый метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Такие аминокислоты называют смешанными, или гликокетогенными.
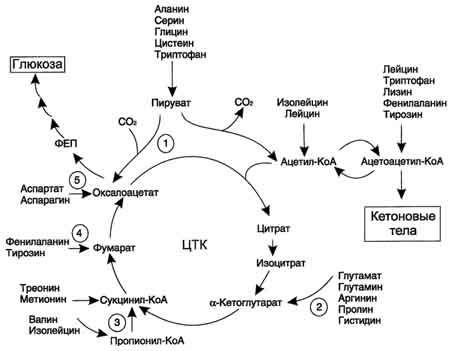
Безазотистые остатки аминокислот используются для восполнения того количества метаболитов общего пути катаболизма, которое затрачивается на синтез биологически активных веществ. Такие реакции называют анаплеротическими. На рисунке выделены пять анаплеротических реакций:
1. ![]()
Фермент пируваткарбоксилаза (кофермент - биотин), катализирующий эту реакцию, обнаружен в печени и мышцах.
2. Аминокислоты → Глутамат → α-Кетоглутарат
Превращение происходит во многих тканях под действием глутаматдегидрогеназы или аминотрансфераз.
3. 
Пропионил-КоА, а затем и сукцинил-КоА могут образоваться также при распаде высших жирных кислот с нечётным числом атомов углерода (см. раздел 8).
4. Аминокислоты → Фумарат
5. Аминокислоты → Оксалоацетат
Реакции 2, 3 происходят во всех тканях (кроме печени и мышц), где отсутствует пируваткарбоксилаза, а реакции 4 и 5 - в основном в печени. Реакции 1 и 3 (рис. 9-22) - основные анаплеротические реакции.
61. Представление об оперонах, обеспечивающих репрессию синтеза белка
теория оперона объясняет следующим образом: при отсутствии в среде Гис или Три регуляторный белок-репрессор не имеет сродства к оператору и происходит синтез ферментов, осуществляющих образование этих аминокислот. Когда в среду добавляют, например, Гис, то эта небольшая молекула, получившая название "корепрессор", присоединяется к белку-репрессору. В результате конформационных изменений в молекуле репрессора комплекс бел-ка-репрессора и корепрессора (Гис) приобретает сродство к оператору, присоединяется к нему, и транскрипция оперона прекращается, т.е. прекращается считывание информации о строении 10 ферментов, участвующих в синтезе этой аминокислоты.
62. Реакции трансаминирования аминокислот, характеристика ферментов, катализирующие эти реакции. Биологическое значение реакций трансаминирования.
Под
трансаминированием подразумевают
реакции межмолекулярного переноса
аминогруппы (NH2—) от аминокислоты на
α-кетокислоту без промежуточного
образования аммиака.Для реакций
трансаминирования характерен общий
механизм. Специфичность трансаминаз
обеспечивается белковым компонентом.
Ферменты трансаминирования катализируют
перенос NH2-группы не на α-кетокислоту,
а сначала на кофермент пиридоксаль-фосфат.
Образовавшееся промежуточное соединение
(шиффово основание) подвергается
внутримолекулярным превращениям
(лабилизация α-водородного атома,
перераспределение энергии связи),
приводящим к освобождению α-кетокислоты
и пиридоксаминфосфата; последний на
второй кетокислотой, что через те же
стадии образования промежуточных
соединений (идущих в обратном направлении)
приводит к синтезу новой аминокислоты
и освобождению пиридоксальфосфата.
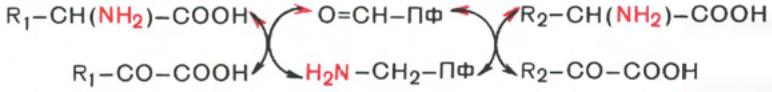
Сущность его сводится к восстановительному аминированию α-кетоглутаровой кислоты с образованием глутаминовой кислоты (реакцию катализирует НАДФ-зависимая глутаматдегидрогеназа, работающая в режиме синтеза) и к последующему трансаминированию глутамата с любой α-кетокислотой. В результате образуется L-аминокислота, соответствующая исходной кетокислоте, и вновь освобождается α-кетоглутаровая кислота, которая может акцептировать новую молекулу аммиака.
63. синтез из гомогентизиновой кислоты

64. синтез из оксифенилпировиноградной кислоты
65. Что такое азотистый баланс? Виды азотистого баланса, приведите примеры
Азотистый баланс – разница между введением с пищей азота и выведением его в виде конечных продуктов азотистого обмена.
Различают 3 вида азотистого баланса:
Положительный – количество выводимого из организма азота меньше количества азота, вводимого с пищей. Азот остается в организме и расходуется на синтез белков. Характерен для растушего организма и во время беременности.
Отрицательный – количество выделяемого азота превышает количество азота, поступающего в течение суток. Встречается при голодании, белковой недостаточности, тяжелых заболеваниях, когда происходит интенсивный распад белков тела. Отрицательный азотистый баланс наблюдается у пожилых людей.
Азотистое равновесие – количество азота выводимого из организма, равно количеству получаемого с пищей азота. Характерно для здорового взрослого человека.
66. Что такое альбуминурия (истинная, ложная, физиологическая, патологическая, почечная
Альбуминурия — выделение белка с мочой, признак нарушения нормальной деятельности почек. Истинная возникает при дегенеративных процессах в мембранах почечных клубочков (гломерулонефрит, амилоидоз почек, нефроз и др.); ложная зависит от примеси в моче большого количества эритроцитов и лейкоцитов, белок которых переходит в мочу. К физиологической альбуминурии относятся случаи временногo появления белка в моче, не связанного с заболеваниями организма. Такая альбуминурия может встречаться у здоровых людей после приема пищи, богатой неденатурированными белками (сырое молоко, сырые яйца и др.). Патологическая или почечная альбуминурия является более важной из всех видов наличия белка в моче, ибо ее появление связано с патологией почки.
67. Что такое и чему равен физиологический минимум белка? Назовите нормы белка в питании
физиологический минимум белка — наименьшее количество вводимого с пищей белка, при котором сохраняется азотистое равновесие. Для взрослых достаточно 1–1,5 грамма белка в день на 1 килограмм веса тела.
68. Что такое кислотность желудочного сока? Чему она равна в норме и как изменяется при различных патологиях
Кисло́тность желу́дочного со́ка — характеристика концентрации кислоты в желудочном соке. Измеряется в единицах рН. Нормальная кислотность в просвете тела желудка натощак: 1,5 — 2,0 рН В лаборатории кислотность желудочного сока определяют титрованием его раствором едкого натра (NaOH) с участием различных химических индикаторов, меняющих свой цвет в зависимости от кислотности среды. Разделяют понятия общей кислотности желудочного сока, свободной и связанной кислотности. Кислотность желудочного сока выражают или в титрационных единицах (количестве мл едкого натра, необходимого для нейтрализации кислоты в 100 мл желудочного сока) или в ммоль/л HCl на 1 л желудочного сока. Численно эти значения совпадают. Обычно при титровании используют 5 мл желудочного сока. Поэтому, после титрования, нейтрализованное количество NaOH умножают на 20.
70. Напишите формулу 3-фосфоаденозин-5-фосфосульфат (ФАФС
71. Переваривание белков в кишечнике. Характеристика ферментов, участвующих в этом процессе
Трипсин и химотрипсин действуют на белки аналогично пепсину, разрывают другие внутренние пептидные связи; оба фермента наиболее активны в слабощелочной среде (рН 7,2–7,8). Благодаря гидролитическому действию на белки всех трех эндопептидаз (пепсин, трипсин, химотрипсин) образуются различной длины пептиды и некоторое количество свободных аминокислот. Дальнейший гидролиз пептидов до свободных аминокислот осуществляется под влиянием группы ферментов – пептидаз. Помимо панкреатической карбоксипептидазы, на пептиды действуют кишечная аминопептидаза и разнообразные дипептидазы. Точкой приложения аминопептидазы является пептидная связь с N-конца пептида. Карбоксипептидаза разрывает пептидную связь с противоположного С-конца пептида. Эти ферменты отщепляют по одной аминокислоте от полипептида. В итоге остаются дипептиды, на которые действуют специфические дипептидазы, при этом образуются свободные аминокислоты, которые затем всасываются. Из других ферментов протеолиза следует упомянуть об эластазе и коллагеназе поджелудочной железы, гидролизующих соответственно эластин и коллаген. Топографически основные процессы гидролиза белков, как и углеводов и жиров, протекают на поверхности слизистой оболочки кишечника.
73. Из каких аминокислот образуется меланин, пигмент кожи и волос
Меланины образуются в цитоплазме меланоцитов путём полимеризации продуктов окисления тирозина или фенилаланина, возникающих под влиянием фермента тирозиназы. Промежуточные продукты образования меланинов без труда соединяются с белками и аминокислотами. В тканях меланины обычно находятся в комплексе с белками.
78. Назовите конечный продукт дезаминирования серина
пируват и α- кетобутират, аммиак и сероводород.
