
- •После изучения темы студент должен
- •Поверхностная энергия и поверхностное натяжение.
- •И на ее поверхности
- •Поверхностно-активные вещества и их свойства.
- •II.Адсорбция на границе раздела твёрдое тело- газ.
- •III. Адсорбция из растворов.
- •Радиус ширина иона
- •IV. Ионная адсорбция.
- •Лабораторная работа.
- •Адсорбция на границе твердое тело-раствор
- •Пример расчета величин для таблицы
- •112 Ммоль – 1000 мл
- •80 Ммоль – 1000 мл
II.Адсорбция на границе раздела твёрдое тело- газ.
Явление концентрирования газов на границе твёрдое тело-газ было открыто в конце XVIII в. независимо шведским химиком и фармацевтом К. Шееле (1742 – 1786) и итальянским профессором Ф. Фонтана (1730 – 1805).
Ф. Фонтана обнаружил, что свеже прокалённый древесный уголь обладает способностью поглощать различные газы в объемах, значительно превосходящих объём.
К. Шееле установил, что в ряде случаев этот процесс обратим: при изменении условий поглощенный газ может выделятся.
Твёрдое тело, на поверхности которого происходит адсорбция, называется адсорбентом; вещество, которое адсорбируется на поверхности адсорбента, называется адсорбтивом или адсорбатом.
Любая твёрдая поверхность при рассмотрении в электронном микроскопе оказывается шероховатой. Наличие таких неровностей (микродефектов) обуславливает некоторый избыточный запас поверхностной энергии Гибса системы. Эта энергия тем больше, чем больше удельная поверхность системы.
Адсорбция обусловлена силами, действующими на поверхности адсорбента. Эти силы имеют ту же природу, что и силы молекулярного притяжения (ван-дер-ваальсовы силы), обусловливающие, например, конденсацию пара в жидкость. Так же, как в жидкости, силовое поле любой молекулярной частицы адсорбента, находящейся в его объеме, полностью компенсировано силовыми полями соседних частиц. Силовые поля частиц адсорбента, расположенных на его поверхности, компенсированы частично. Поэтому, на поверхности адсорбента действуют остаточные силы, способные притягивать молекулы веществ, находящихся в контакте с поверхностью адсорбента. В энергетическом отношении участки поверхности твёрдого тела неравноценны. Адсорбция в первую очередь происходит на участках поверхности с наибольшим локальным запасом поверхностной энергии Гиббса.
Характер адсорбционных явлений на границе твёрдый адсорбент – газ(пар) описывается теорией И. Ленгмюра. И.Ленгмюр исходил из следующих молекулярно-кинетических положений.
1. Адсорбция вызывается силами, близкими к химическим.
2. Адсорбция молекул адсорбата происходит не не всей поверхности адсорбента, а только на вполне определённых её участках, называемых адсорбиционными центрами.
3. Адсорбционный центр удерживает только одну молекулу адсорбата. При больших давлениях адсорбиционных центров образуется мономолекулярный слой, соответствующий адсорбции.
4. Адсорбционный процесс находится в динамическом равновесии с процессом десорбции.
При равновесии скорости адсорбции и десорбции равны.
На основании этих положений Ленгмюр вывел уравнение изотермы адсорбции:
![]() ;
где
;
где
![]() -количество адсорбтива (масса),
адсорбированное единицей массы адсорбента
и соответстующее полному заполнению
всех активных центров;
-количество адсорбтива (масса),
адсорбированное единицей массы адсорбента
и соответстующее полному заполнению
всех активных центров;
К – константа адсорбционного равновесия
![]() или
или ![]()
Где А=1/К
Р – давление газа
Это уравнение хорошо описывает экспериментальные данные, объясняя линейную зависимость адсорбции при малых концентрациях (давлениях):
п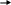 ри
Р 0 , Г=Г
∙
Р
ри
Р 0 , Г=Г
∙
Р
а также адсорбции к насыщению при высоких концентрациях (давлениях) газообразных веществ:
при Р![]() ∞
∞ ![]() и Г = Г
и Г = Г
Адсорбция газов существенно зависит от температуры. Чем выше температура тем меньше адсорбция, поскольку в этом случае молекулы газа обладают большей кинетической энергией и легче отрываются от поверхности адсорбента (рис. 8).

Рис. 8. Зависимость адсорбции от
температуры
(Т1 › Т2 ›Т3)
На практике чаще приходится иметь дело с адсорбцией твёрдым адсорбентом не одного какого-либо газа или пара, а сразу нескольких, поэтому изучение адсорбции из смеси особенно важно. Именно на этом основано применение противогаза, когда через адсорбент должно проходить не только отравляющее вещество, но и в большем количестве кислород и азот воздуха.
На адсорбции из смеси газов основано кондиционирование воздуха.
Из смеси газов каждый её компонент адсорбируется хуже, чем если бы он адсорбировался в чистом виде, причём газ, имеющий большую адсорбционную способность, лучше адсорбируется и из смеси.
Таким образом, адсорбция газов на твёрдых поверхностях – процесс сложный, зависящий от природы адсорбента, адсорбтива и от внешних условий – давления, температуры. Очень часто изотермы адсорбции имеют более сложный вид (S – образный, ступенчатый). Для объяснения подобных кривых привлекается теория полимолекулярной адсорбции Поляни или теория Брунауэра, Эммета и Теллера (БЭТ).
V
адс

В

|
P/P0
Рис. Х. Изотерма полимолекулярной адсорбации |
Рис.9. Схема строения адсорбционного слоя по теории БЭТ |
Рис. 10. Изотерма полимолекулярной адсорбции
Адсорбционная способность зависит от пористости и физического состоянии адсорбента. Аморфные адсорбенты обычно лучше адсорбируют газ, чем кристаллические, это объясняется, очевидно, тем, что поверхность аморфного адсорбента шероховата, в то время как поверхность кристалла, за исключением рёбер и углов, гладкая.
Пористые адсорбенты применяют в виде гранул и таблеток. В качестве тонкопористых адсорбентов наиболее часто применяют древесный уголь, животный (костный) уголь, силикагель, различные природные силикаты, алюмогель, алюмосиликаты.
В последнее время широкое применение в качестве адсорбентов получили молекулярные сита. Примером таких сит являются цеолиты, кристаллы которых построены из чередующихся кремне- и алюмокислородных тетраэдров и содержат поры диаметром (4 – 7.5) · 10-10м в зависимости от типа цеолита.
