
- •Введение
- •1 Самостоятельная работа студентов по подготовке к Интернет-экзамену по учебной дисциплине «Физика»
- •2 Тематическая структура апим «Молекулярная физика и термодинамика»
- •Молекулярная физика и термодинамика
- •3.1 Законы, описывающие поведение идеальных газов
- •(При нормальных условиях)
- •Уравнение состояние иг
- •Основное уравнение мкт
- •3.2 Распределение Максвелла и Больцмана
- •Барометрическая формула. Распределение Больцмана
- •Средняя энергия молекул. Закон Больцмана о равномерном распределении энергии по степеням свободы
- •3.4. 1 Начало термодинамики. Работа при изопроцессах
- •Первое начало термодинамики
- •Теплоемкости. Уравнение Майера
- •Применение первого начала термодинамики к изопроцессам
- •3.5 Второе начало термодинамики. Энтропия. Циклы
- •Энтропия
- •Второе начало термодинамики
- •Третье начало термодинамики
- •Тепловые двигатели
- •Цикл Карно — идеальный термодинамический цикл
- •Графическое представление изопроцессов идеального газа на диаграмме т-s
- •4 Примеры решения задач
- •5.Рекомендуемая литература для самостоятельной работы студентов
- •Задания для самоконтроля: Проверьте свои знания (фэпо-14)
3.1 Законы, описывающие поведение идеальных газов
Модель идеального газа (ИГ)-
используется при изучении реальных газов:
-собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
-между молекулами газа отсутствуют силы взаимодействия;
-столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Основные понятия молекулярной - кинетической теории
Атом - наименьшая честь химического элемента, являющаяся носителем его свойств.
Молекула - наименьшая устойчивая частица вещества, обладающая его основными химическими свойствами и состоящая из атомов, соединенных между собой химическими связями.
Количество вещества п - физическая величина, определяемая числом специфических структурных элементов-молекул, атомов или ионов, из которых состоит вещество, измеряют в молях.
Моль вещества - это количество вещества, содержащее 6,02·10 в 23-й степени атомов или молекул этого вещества.
Фактическое
количество единиц вещества в 1 моле
называется числом Авогадро
![]() —
постоянная
Авогадро,
—
постоянная
Авогадро,
Для вычисления количества вещества на основании его массы пользуются понятием молярная масса:
![]() ,
,
где m — масса вещества, M — молярная масса вещества.
Молярная масса — это масса, которая приходится на один моль данного вещества, (кг/моль). Молярная масса вещества может быть получена произведением молекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро.
Количество вещества так же можно определить на основании его объёма:
= V / Vm,
где V — объём газа (при нормальных условиях), Vm — молярный объём газа при Н. У., равный 22,4 л/моль, единица- кг/моль.
![]()
масса 1-й молекулы вещества:
![]()
ρ - плотность газа, кг/м^3
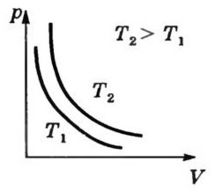
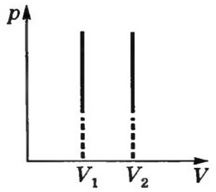
а) Закон Бойля - Мариотта для изотермического процесса:
![]()
Для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная.
К ривая,
изображающая зависимость между величинами
p
и V,
характеризующими свойства вещества
при постоянной температуре, называется
изотермой. Изотермы представляют собой
гиперболы, расположенные на графике
тем выше, чем выше температура, при
которой происходит процесс.
Изотерма-
график зависимости между параметрами
состояния идеального газа при Т = const.
ривая,
изображающая зависимость между величинами
p
и V,
характеризующими свойства вещества
при постоянной температуре, называется
изотермой. Изотермы представляют собой
гиперболы, расположенные на графике
тем выше, чем выше температура, при
которой происходит процесс.
Изотерма-
график зависимости между параметрами
состояния идеального газа при Т = const.
Изотермический процесс - процесс, происходящий при постоянной температуре (Т = const).
![]() или
или
![]()
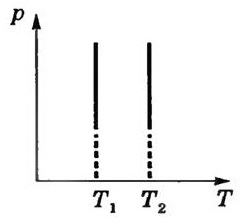
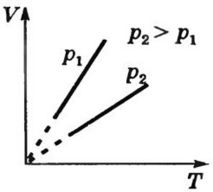
Б) Закон Гей – Люссака для изобарного процесса
Закон Гей – Люссака в шкале Цельсия: Объём данной массы газа при постоянном давлении изменяется линейно с температурой.
V=Vо(1+ αt) при p=const m=const
t – температура по Цельсию
Vо - объем при 0оС
![]()
Изобарный процесс - процесс, происходящий при постоянном давлении (p=const). Изобара - график зависимости между параметрами состояний идеального газа при p=const.
Закон Гей – Люссака в термодинамической шкале температур
Из формулы V=Vо(1+ αt) следует, что изобары пересекают ось температур в точке t= -1/α = -273,15о С, определяемой из условия 1+ αt=0. Если перенести начало отсчета в эту точку, то происходит переход к шкале Кельвина, тогда T=t+ 1/ α. В этом случае
![]()
Откуда
![]() (индексы 1 и 2 относятся к произвольным
состояниям, лежащим на одной изобаре).
(индексы 1 и 2 относятся к произвольным
состояниям, лежащим на одной изобаре).
при p = const, m = const

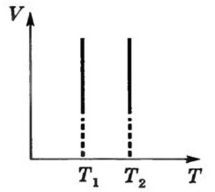
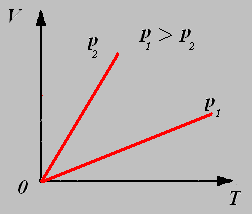
В) Закон Гей – Люссака для изохорного процесса
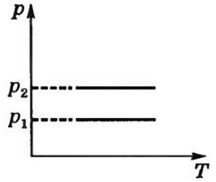
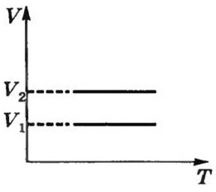
Закон Гей – Люссака в шкале Цельсия: Давление данной массы газа при постоянном объеме изменяется линейно с температурой.
p=po (1+ αt) при V = const, m=const
Изохорный процесс- процесс, происходящий при постоянном объеме
(V = const). Изохора- график зависимости между параметрами состояния идеального газа при V=const.
Закон Гей-Люссака в термодинамической шкале температур:
 V
= const
m
= const
V
= const
m
= const
![]() Из
формулы p=po(1+ αt) следует, что изохоры
пересекают ось температур в точке t=-1/α
= -273,15оС, определяемой из условия 1+ αt=0.
Если перенести начало отсчета в эту
точку, то происходит переход к шкале
Кельвина, откуда T=t+ 1/ α. Тогда
Из
формулы p=po(1+ αt) следует, что изохоры
пересекают ось температур в точке t=-1/α
= -273,15оС, определяемой из условия 1+ αt=0.
Если перенести начало отсчета в эту
точку, то происходит переход к шкале
Кельвина, откуда T=t+ 1/ α. Тогда ![]() ,
откуда
,
откуда ![]() (индексы 1 и 2 относятся к произвольным
состояниям, лежащим на одной изохоре)
(индексы 1 и 2 относятся к произвольным
состояниям, лежащим на одной изохоре)
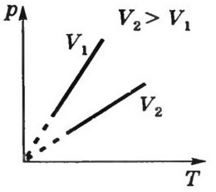
Г) Законы Авогадро и Дальтона
Закон Авогадро: Моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы.
