
- •1. Магнитное поле в веществе. Вектор намагничивания
- •2. Описание поля в магнетике. Напряженность магнитного поля.
- •3. Элементарные носители магнетизма
- •4. Диамагнетизм
- •5. Парамагнетизм
- •1. Ферромагнетизм
- •1. Общая характеристика уравнений
- •2. Первое уравнение Максвелла
- •3. Второе уравнение Максвелла. Ток смещения
- •4. Полная система уравнений Максвелла
- •1. Гармонические колебания в электрической системе.
- •2. Сложение двух гармонических колебаний одного направления
- •3. Сложение двух перпендикулярных гармонических колебаний
- •4. Затухающие колебания
- •5. Характеристики затухания
- •6. Вынужденные колебания
- •1. Образование и распространение волн в упругой среде
- •2. Уравнение бегущей волны
- •3. Энергия упругих волн
- •4. Cтоячие волны
- •5. Свойства электромагнитных волн
- •6. Излучение электромагнитных волн
- •7. Шкала электромагнитных волн
- •Волновая оптика
- •1. Предмет оптики
- •2. Световая волна
- •3. Интерференция волн. Когерентность.
- •4. Интерференция света.
- •5. Расстояние между интерференционными максимумами.
- •6. Интерференция в тонких пленках
- •1. Принцип Гюйгенса-Френеля
- •2. Метод зон Френеля. Прямолинейное распространение света
- •3. Дифракция на щелях
- •4. Дифракция света от многих щелей. Дифракционная решетка
- •1. Естественный и поляризованный свет
- •2. Поляризация света при прохождении через кристаллы
- •3. Получение поляризованного света
- •4. Закон Малюса
- •5. Поляризация при отражении и преломлении
- •6. Вращение плоскости поляризации
- •7. Применение поляризации
- •1. Проблема теплового излучения
- •2. Законы теплового излучения абсолютно черного тела
- •3. "Ультрафиолетовая катастрофа"
- •4. Квантовая гипотеза Планка
- •1. Фотоэффект
- •2. Фотон и его свойства
- •Элементы атомной физики и квантовой механики
- •1. Волновые свойства частиц
- •2. Физический смысл волн де Бройля.
- •3. Соотношение неопределенностей
- •1. Волновая функция
- •2. Уравнение Шредингера
- •3. Частица в потенциальной яме
- •1. Корпускулярная модель атома.
- •2. Квантовомеханическое описание водородного атома
- •3. Спин электрона
- •4. Принцип Паули
- •5. Электронная структура атомов
- •6. Рентгеновские лучи
- •Элементы ядерной физики
- •1. Состав атомного ядра
- •2. Энергия связи ядра
- •3. Ядерные силы
- •4. Модели ядра
- •1. Явление радиоактивности
- •2. Закон радиоактивного распада
- •3. Альфа - распад
- •4. Бета-распад
- •5. Уравнение ядерной реакции
- •6. Законы сохранения в ядерных реакциях
- •7. Составное ядро
- •8. Типы ядерных реакций
- •9. Трансурановые элементы
- •10. Реакция деления ядра
- •11. Цепная реакция деления
2. Квантовомеханическое описание водородного атома
Результаты
теории Бора для энергетических уровней
электрона в атоме водорода получаются
в квантовой механике без дополнительных
постулатов, т.к. правило квантования,
введенное Бором, искусственно является
следствием волновых свойств электрона.
Действительно, волна де Бройля, связанная
с движением электрона по орбите,
должна укладываться на ней целое число
раз (Рис. 35.1). Т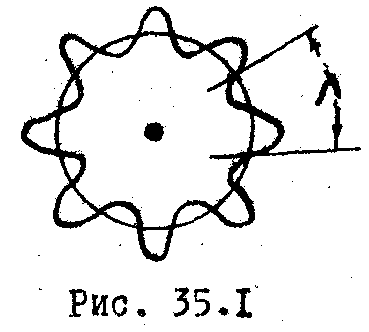 огда
огда
![]() ,
т.к.
,
т.к.
![]() ,
тo
,
тo
![]() ,
откуда
.
,
откуда
.
Т.о.
получим уравнение первого постулата
Бора. Состояние электрона в атоме
водорода, согласно квантовой механике,
описывается стационарным уравнением
Шредингера
![]() ,
где
,
где
![]() —
—
расстояние электрона до ядра.
Аналогично
примеру, рассмотренному в лк. 34, состояние
электрона будет описываться набором
волновых функций, которые в отличие
от одномерной задачи теперь определяются
не одним, а тремя квантовыми числами
- n, l, m:
![]() .
Эти числа связаны с квантованием
величин, характеризующих состояние
электрона. Как и в примере для частицы
в потенциальной яме, точное решение
уравнения Шредингера для атома водорода
приводит к появлению дискретных
энергетических уровней. Каждому уровню
соответствует целое главное квантовое
число n =1,2,..., что совпадает о результатом
теории Бора.
.
Эти числа связаны с квантованием
величин, характеризующих состояние
электрона. Как и в примере для частицы
в потенциальной яме, точное решение
уравнения Шредингера для атома водорода
приводит к появлению дискретных
энергетических уровней. Каждому уровню
соответствует целое главное квантовое
число n =1,2,..., что совпадает о результатом
теории Бора.
Состояние электронов в атоме может отличаться не только энергией, определяемой квантовым числом n, но величиной и направлением момента импульса. Момент импульса L сказывается также квантованной величиной, и для каждого значения энергии Еn принимает дискретный ряд значений:
![]() (35.8)
(35.8)
где l - целые числа от 0 до (n-1): l=0,1,2,...,(n-1) -всего значений. Его называют орбитальным или побочным квантoвым числом.
Проекция момента импульса LZ на любое направление также квантуется. Для каждого l момент импульса ориентируется так, чтобы
![]() (35.9)
(35.9)
где m -целые числа от -l до +l, включая 0: m=0, ±1, ±2,..., ±l - всего (2l+1) значение. Его называют магнитным квантовым числом. Итак, уравнение Шредингера приводит к тому, что каждое квантовое состояние электрона в атоме водорода характеризуется набором квантовых чисел n, l, m, который соответствует определенная энергия электрона, момент импульса и его проекция на выделенное направление. Подсчитаем число возможных состояний электрона с данным квантовом числом n. Т.к. m принимает (2l +1) значение, а l может изменяться от 0 до n-1, то полное число состояний равно
![]() (35.10)
(35.10)
Ниже
приведены возможные состояния электронов
в атоме. Если теория Б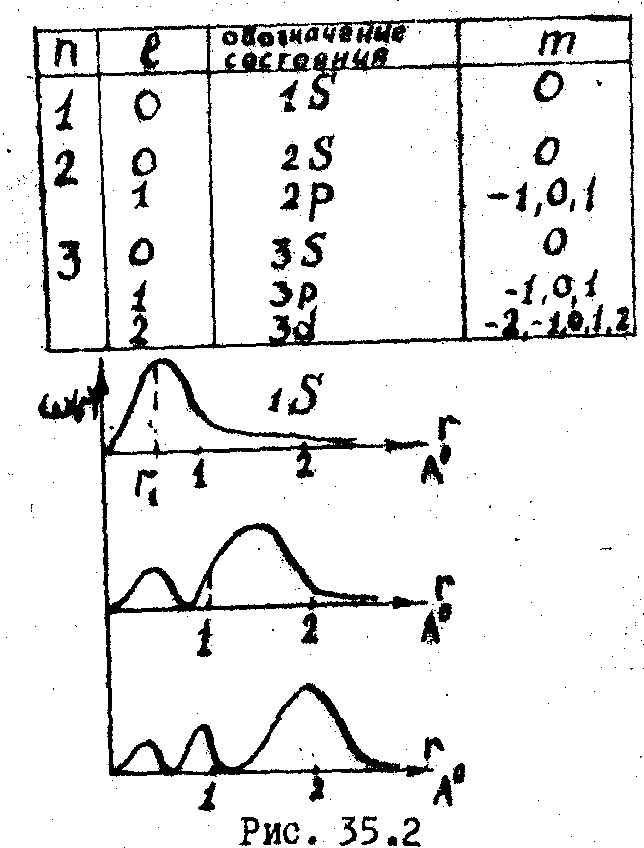 ора
допускала наглядное представление
состояния электрона в атоме с помощью
орбит, то квантовая теория вообще не
допускает существование орбит. Решение
уравнения Шредингера позволяет находить
ора
допускала наглядное представление
состояния электрона в атоме с помощью
орбит, то квантовая теория вообще не
допускает существование орбит. Решение
уравнения Шредингера позволяет находить
![]() -вероятность нахождения электрона
внутри заданного объема. На рис. 35.2.
показаны распределения вероятности
для различных состояний электрона. Так,
для основного состояния электрона 1S
вероятность w(r)
имеет максимум на расстоянии первой
бо-ровской орбиты. Т.о.,боровские орбиты
электрона в атоме предсдавляют собой
геометрические места точек, в которых
с наибольшей вероятностью может быть
обнаружен электрон.
-вероятность нахождения электрона
внутри заданного объема. На рис. 35.2.
показаны распределения вероятности
для различных состояний электрона. Так,
для основного состояния электрона 1S
вероятность w(r)
имеет максимум на расстоянии первой
бо-ровской орбиты. Т.о.,боровские орбиты
электрона в атоме предсдавляют собой
геометрические места точек, в которых
с наибольшей вероятностью может быть
обнаружен электрон.
