
- •Отдельные представители одноосновных карбоновых кислот и их применение.
- •Качественная реакция на уксусную кислоту
- •Отдельные представители двухосновных, непредельных ароматических карбоновых кислот, фенолокислот, оксикислот и их применение в медицине и народном хозяйстве. Непредельные кислоты
- •Двухосновные кислоты
- •Ароматические кислоты
- •Фенолокислоты
- •Оксикислоты. Оптическая изомерия.
- •Домашнее задание:
- •Вопросы для закрепления:
ЛЕКЦИЯ №44.
Химические свойства карбоновых кислот. Важнейшие представители карбоновых кислот. Мыла.
План:
1. Химические свойства карбоновых кислот.
2. Отдельные представители одноосновных карбоновых кислот.
3. Непредельные кислоты
4. Двухосновные кислоты
5. Ароматические кислоты
6. Фенолокислоты
7. Оксикислоты.
Химические свойства карбоновых кислот.
Кислотные свойства:
диссоциация кислот:

 R—COOH
H+
+ R—
COO–
R—COOH
H+
+ R—
COO–

 R—COOH
+ H2O
H3O+
+ R— COO-
R—COOH
+ H2O
H3O+
+ R— COO-
Взаимодействие со щелочами:
СН3СООН + NaOH ——→ CH3COONa + H2O
ацетат натрия
2. Галогенирование алифатических кислот (реакция Геля-Фольгарда-Зелинского).
4
СН3 CH3
\ 3 2 1 +P (красный) \
СН—СН2—СООН + Br2 ——————→ CH — CH — COOH
/ –HBr / │
СН3 CH3 Br
изовалериановая 2 - бромизовалериановая
кислота кислота
Реакция нуклеофильного замещения:
реакция этерификации:
O O
// H2SO4 (к), t //
R— C + R1—OH —————→ R— C
 \
└┘ –H2O
\
\
└┘ –H2O
\
OH O—R1
└–┘
карбоновая к-та спирт сложный эфир
образование галогенангидридов:
O O
// //
 R—C
+ SOCl2
—→ R—C + SO2
↑ + HCl
R—C
+ SOCl2
—→ R—C + SO2
↑ + HCl
\ \
OH Cl
тионилхлорид хлорангидрид
карбоновой
кислоты
Образование ангидридов кислот:
O
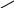 O
//
O
//
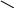 R—
C R— C
R—
C R— C
а) OH + P2O5 , t + 2 HPO3 \
+ ——————→ O + H2O
OH /
R— C R— C
O \\
О
ангидрид карбоновой кислоты
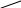 б)
O
б)
O
 O
O R—C
O
O R—C
// \\ t O
 R— C +
C — R ———→
R— C +
C — R ———→
\ / –NaHal R—C
Hal NaO O
ангидрид карбоновой кислоты
Образование амидов:
O O O
// t // t //
R—C + NH3 —→ R—C —→ R—C
\ \ –H2O \
OH ONH4 NH2
амид карбоновой кислоты
При отщеплении гидроксогруппы от карбоксила образуются ацильные радикалы.
O O
// //
R—C —→ R—C
\ \
OH
карбоновая кислота ацил.
О О
// //
1. СН3 — С ——→ СН3 — С
\ \
ОН
ацетил
О О
// //
2. Н— С ——→ Н—С
\ \
ОН
формил
3. О О
// //


 С
С
С
С
\ ——→ \
ОН
бензоил
К функциональным производным карбоновых кислот относят:
1. Сложные эфиры: - функциональные производные карбоновых кислот, в которых гидроксогруппа заменена остатком спирта или фенола.
O
//
R—C
\
O—R1
Названия сложным эфирам по международной номенклатуре дают с использованием суффикса –оат.
О О
// //
С2Н5—С С6Н5—С СН3
 \
\
\
\
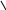 О—С3Н7
О—СН
О—С3Н7
О—СН
СН3
пропилпропаноат изопропилбензоат
2. Амиды – это функциональные производные карбоновых кислот, в которых гидроксогруппа заменена на аминогруппу.
O
//
R—C
\
NH2
общая формула
амидов
О O
// //
С C2H5 — C Н2N—C—NH2
\ \ ║
NH2 NH2 O
бензамид пропанамид мочевина
(полный амид угольной кислоты )
3. Галогенангидриды – функциональне производные карбоновых кислот, в которых гидроксогруппа заменена на галоген.
O
//
R—C
\
Hal
4. Ангидриды – функциональные производные карбоновых кислот, в которых гидроксогруппа заменена на кислотный остаток карбоновой кислоты.
O
//
R—C
\
O
/
R— C
\\
O
Функциональными производными карбоновых кислот называются производные карбоновых кислот, в которых гидроксогруппа заменена на алкоксильную группу, аминогруппу, галогены, аминогруппу.
Отдельные представители одноосновных карбоновых кислот и их применение.
Муравьиная кислота: НСООН.
Соли муравьиной кислоты называются формиаты.
t
Н—СООН —→ CO0↑ + H2O
Получение: t
1) СО + NaOH —→ HCOONa + H2SO4 ———→ HCOOH
формиат –NaHSO4 муравьиная
натрия кислота
2) Разработан экономически более выгодный способ получения муравьиной кислоты: взаимодействие метанола с оксидом углерода (11) с образованием метилового эфира муравьиной кислоты:
СН3ОН + СО ——→ НСООСН3
Эфир подвергается гидролизу:
t; H+
НСООСН3 + Н2О ——→ НСООН + СН3ОН
Метанол вновь используют для реакции с оксидом углерода (II). Процесс получения кислоты является безотходным.
Н—С═О Муравьиную кислоту можно рассматривать как :
│ 1) карбоксильную группу, связанную с атомом водорода
ОН 2) альдегидную группу, связанную с гидроксильной группой
Муравьиная кислота – самая активная из одноосновных карбоновых кислот: она примерно в 10 раз сильнее уксусной кислоты. Объяснить это можно тем, что в муравьиной кислоте карбоксильная группа связана не с с углеродным радикалом, а с водородом, который не влияет на кислотные свойства карбоксильной группы.
Качественная реакция.
Муравьиная кислота – восстановитель, дает реакцию серебряного зеркала.
t
Н
 —С
═ О + 2 [ Ag
(NH3)2
]OH
—→ 2Ag↓
+ 4NH3↑
+ H2O
+ HO—C—OH
—С
═ О + 2 [ Ag
(NH3)2
]OH
—→ 2Ag↓
+ 4NH3↑
+ H2O
+ HO—C—OH
│ ║
ОН O
угольная
кислота
СО2↑ Н2О
Муравьиная кислота – бесцветная жидкость с резким запахом, растворяется в воде в любых количествах.
Применение: Муравьиная кислота применяется в кожевенном деле (дубление кож), текстильной промышленности (как протрава при крашении), для получения сложных эфиров, используемых в парфюмерии, и в качестве растворителя. В медицине эта кислота применяется для растираний при ревматизме в виде 1,25% спиртового раствора, известного под названием муравьиного спирта. Название историческое. Это средство когда-то готовили настаиванием муравьев на спирту. Муравьиную кислоту используют в качестве консерванта для сохранения зеленых кормов.
Уксусная кислота.
3-6% раствор называют столовый уксус. Это вкусовая приправа, консервант.
100% раствор СН3СООН называется ледяной. 70-80% называют эссенцией.
Уксусная кислота – бесцветная жидкость с резким характерным запахом, растворяется в воде в любых количествах. Соли и эфиры уксусной кислоты называются ацетаты.
Получение:
1. Гидратация этилена:
O O
t, K=Pd // //
СН2 ═ СН2 + Н2О ———→ H3C—C + [ O ] ——→ CH3—C
–H2↑ \ \
H OH
уксусный альдегид уксусная
этаналь кислота
2. Уксусно-кислое брожение этанола:
микроорганизмы
СН3—СН2—ОН + О2 ————————→ СН3—С═О
–Н2О │
ОН
3. Из метанола:
t, K
СН3ОН + СО ———→ CH3COOH
Из метана:
t=150ºC
a) 2CH4 ————→ C2H2 + 3H2
t; Hg2+
б) С2Н2 + Н2О ———→ CH3—C ═ O
│
H
[ О ] t
в) СН3—С ═ О ——→ СН3—С ═ О
│ │
Н ОН
Окислением бутана:
t; K
2СН3—СН2—СН2—СН3 + 5О2 ————→ 4СН3—С ═ О + 2Н2О
│
ОН
