
- •Раздел 1. Классификация и номенклатура биоорганических соединений.
- •Раздел 2. Сопряженные системы.
- •Раздел 3 Передача электронных влияний в биоорганических соединениях. Кислотно-основные свойства биоорганических соединений.
- •Раздел 4. Изомерия биоорганических соединений
- •Раздел 5. Механизмы биоорганических реакций.
- •Раздел 6 . Классификация, номенклатура, физические и химические свойства карбоновых кислот.
- •Раздел 7. Природные биологические активные вещества липиды и высшие карбоновые кислоты
- •Раздел 8. Природные биологические активные вещества аминокислоты
- •Раздел 9. Полипептиды. Белки
- •Раздел10. Углеводы. Классификация. Моносахариды.
- •Раздел 11. Углеводы. Олигосахариды. Полисахариды.
- •(Основная связь α-1, 4, ветвление α-1, 6 через 20-25 остатков глюкозы)
- •(Основная связь α-1, 4, ветвление α-1, 6 через 8-12 остатков глюкозы)
- •Раздел 12. Нуклеиновые кислоты, нуклеотиды, нуклеозиды, азотистые основания
- •Раздел 13. Синтетические биологически активные вещества - лекарственные препараты
- •Раздел 14. Алкалоиды. Витамины.
- •Раздел 15.Реакции полимеризации и поликонденсации. Полимеры в стоматологии.
Раздел 3 Передача электронных влияний в биоорганических соединениях. Кислотно-основные свойства биоорганических соединений.
Исходный уровень знаний для усвоения темы основан на школьной программе химии, разделах 1, 2 данного пособия и протолитической теории кислот и оснований.
Гибридизация орбиталей, пространственная ориентация орбиталей, ковалентные σ - и π – связи, полярные и неполярные ковалентные связи, изменение электроотрицательности элементов в периоде и группе, функциональные группы, сопряженные системы, делокализация.
Для усвоения темы и приобретения компетенции по данному разделу надо знать:
- определения « индуктивный», «мезомерный» эффект,
- электронные эффекты заместителей в алифатических и сопряженных системах
- диаграммы распределения электронной плотности,
- определения «кислота», «основание» по теории Бренстеда- Лоури
- влияние факторов на изменение кислотно-основных свойств.
Ключевые слова.
Заместитель донорный, акцепторный, кислота, основание, распределение электронной плотности в молекуле биоорганического соединения, сопряженная кислота, сопряженное основание, теория Бренстеда - Лоури, электроотрицательность, эффект индуктивный, мезомерный.
Содержание раздела 3
3.1. Типы химических связей в биоорганических соединениях. Механизмы смещения электронной плотности (индуктивный и мезомерный эффекты). Группы «доноры» и «акцепторы»
3.1.2. Индуктивный эффект. Сравнительная электроотрицательность атомов и элементов. Обозначение индуктивного эффeкта. Диаграммы распределения электронной плотности.
Передача индуктивного эффекта по длине углеродной цепи. Понятие а- углеродный атом рядом с акцепторной группой (карбонильной, карбоксильной).
Примеры для иллюстрации индуктивных эффектов: кислоты этановая, пропановая, бутановая, 2-гидроксипропановая, 3-гидроксипропановая. Сравнение индуктивных эффектов двух групп: амино -NH2 и положительно заряженной триметиламмонийной - +N(CH3)3 на примере
2-аминоэтанола-1 (коламина) и холина.
3.1.3.Мезомерый эффект в сопряженных системах. Донорные и акцепторные группы, знаки эффекта (± М).
3.1.3.1. Мезомерный эффект в ациклических сопряженных системах. Примеры для иллюстрации: хлорэтен (сравнить с хлорэтаном), пропеновая 2-бутеновая, 2-оксопропановая кислоты (сравнить с 2-гидроксипропановой).
3.1.3.2. Мезомерный эффект в карбоароматических соединениях. «Правило 2,4,6 ».
Примеры для иллюстрации: толуол, фенол, анилин, бензойная кислота.
3.1.3.3 Мезомерный эффект в гетероароматических соединениях.
Примеры для иллюстрации: пиридин, пиридиниевый катион, никотиновая кислота, пиримидин
Сравнение распределения электронной плотности и величин зарядов б+ в парах соединений: пиридин- пиримидин, пиридин - пиридиниевый катион,
Пиридин - никотиновая кислота, никотиновая кислота- катион никотиновой кислоты.
3.2. Кислотно - основные свойства биоорганических соединений (теория Бренстеда-Лоури). Определения кислота, сопряженное основание, основание, сопряженная кислота. Константа кислотности, основности. Значения рКа, рКв.
3.2.1. Кислотные свойства. Виды кислот (-ОН, -SH, -NН, -CH - кислоты), Факторы, влияющие на кислотные свойства:
-природа кислотного центра,
- полярность связи,
- влияние заместителей,
-поляризуемость атома (наибольшая у серы в сравнении с кислородом),
Изменение кислотных свойств в гомологических рядах.
Примеры: гомологические ряды
- спиртов: метанол, этанол, пропанол-1;
- монокарбоновых кислот: муравьиная, уксусная, пропановая и т.д.
-дикарбоновых кислот: щавелевая, малоновая, янтарная, глутаровая
Сравнение кислотных свойств
- одно – и многоатомных спиртов – этанол, глицерин
-аминоэтанола (коламина) и холина
- фенола и его производных – фенол, 4-нитрофенол, п-дигидроксибензол (гидрохинон),
- гидроксикарбоновых кислот (2-гидроксипропановая,
3-гидроксибутановая, 2-гидроксибутандиовая)
- оксокарбоновых кислот (2-оксопропановая, 3-оксобутановая, 2-оксобутандиовая)
- карбоновых кислот, гидрокси - и оксокарбоновых кислот между собой
3.2.2. Основные свойства. Факторы, влияющие на основные свойства:
- природа основного центра
- влияние заместителей
-изменение основных средств в гомологических рядах
Основные свойства азотсодержащих ароматических гетероциклических соединений и сравнение основных свойств.
Примеры:
- гомологический ряд аминов
- алифатические и ароматические амины - этиламин, анилин
- замещенные ароматические амины - анилин, 4-аминофенол
- пиридин, никотиновая кислота
- сравнение : амины, спирты, тиолы
Приложение. Основы теории.
Индуктивный и мезомерный эффекты.
Для объяснения направления и силы индуктивного эффекта надо знать ряд сравнительной электроотрицательности элементов.
Сравнительная электроотрицательность атомов и элементов:
А) С( sp3) < С( sp2 ) < С (sp)
Б) С < N < O; C < галоген (F < Cl < Br < I)
Электронные эффекты функциональных групп
Таблица 3
№№ |
Группа |
Значение индуктивного эффекта |
Значение мезомерного эффекта |
1 |
-СООН |
- I |
- M |
2 |
- C=O |
- I |
- M |
3 |
-OH |
- I |
+M |
4 |
-NH2 |
- I |
+M |
5 |
галогены |
- I |
+M |
6 |
Алкильные радикалы |
+ I |
+M (у группы СН3) в ароматическом цикле. |
Знаки индуктивного эффекта (±I ). Обозначение индуктивного эффeкта: направление стрелки —> от донорной группы в сторону более э.о. атома или акцепторной группы по линии одинарной связи)
 Знаки
мезомерного эффекта (±М ). Обозначение
мезомерного эффекта: « выгнутая»
стрелка от донорной группы в
сторону более э.о. атома или акцепторной
группы.
Знаки
мезомерного эффекта (±М ). Обозначение
мезомерного эффекта: « выгнутая»
стрелка от донорной группы в
сторону более э.о. атома или акцепторной
группы.
Обучающая задача 1
Яблочная кислота образуется в митохондриях многих клеток. Составьте систематическое название и диаграмму распределения электронной плотности в молекуле,
Решение.
Запишем структурную формулу яблочной кислоты, в которой присутствуют σ- связи, образующие скелет молекулы, пронумеруем атомы, составим систематическое название о системе ИЮПАК: 2-гидроксибутандиовая кислота.
4 3 2 1
НООС- СН2-СН- СООН
|
ОН
Определим, каким индуктивным эффектом обладают функциональные группы: карбоксильная и гидроксильная. Они проявляют отрицательный индуктивный эффект ( -I )
Вновь запишем формулу кислоты и поставим знаки смещения электронной плотности в соответствии с эффектами групп и затем знаки частичных зарядов.
(- I) δ + δ + (- I)
НООС ← СН2 — СН→ СООН
↓
ОН (- I)
Остается обдумать: как смещается электронная плотность между атомами С2 и С3. Электронная плотность должна смещаться в сторону большего заряда δ +, который находится на атоме С2, поскольку с ним связаны две электроотрицательные группы.
Полная диаграмма распределения электронной плотности:
δ + δ +
НООС ← СН2 → СН→ СООН
↓
ОН
Обучающая задача 2
Составить диаграмму распределения электронной плотности в молекуле никотиновой кислоты.
 δ
+
δ
+

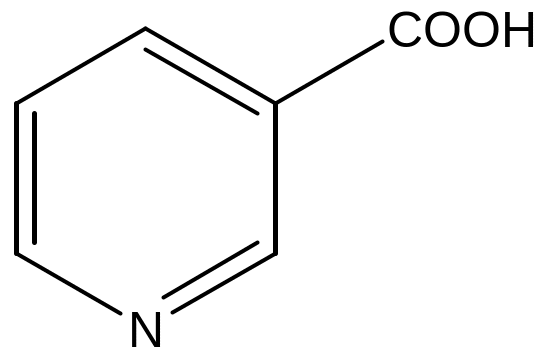
рис 1. δ + δ +
Решение. рис. 2
1.Запишем формулу никотиновой кислоты (рис 1)
2. Определим эффекты циклического атома азота и карбоксильной группы. Атом азота обладает большей электроотрицательностью по сравнению с атомами углерода. Атом азота и карбоксильная группа по отношению к ароматической системе проявляют - М эффект, создают неравномерное распределение электронной плотности. В положениях 2,4,6 по отношению к ним, т.е. и к атому азота, и к карбоксильной группе, создается частичный заряд δ +. Места возникновения зарядов δ + совпадают. Получается сочетанное действие двух заместителей.
2. Составим диаграмму распределения электронной плотности (рис. 2). Стрелки указывают места формирования частичных δ + зарядов.
Кислотно-основные свойства биоорганических соединений
Акцепторные заместители увеличивают, донорные уменьшают кислотные
свойства, и наоборот, акцепторные заместители уменьшают основные
свойства и увеличивают кислотные.
Кислотные свойства в гомологических рядах убывают.
Сравнение кислотных свойств соединений с различными кислотными центрами:
R-SH > R-ОН > R –NН2
Проведем сравнение кислотных свойств нескольких соединений.
Гидрокси - и оксокарбоновые кислоты:
А) пропановая кислота < 2-гидроксипропановая < 2-оксопропановая
Б) янтарная < 2- гидроксиянтарная (яблочная) < 2-оксоянтарная (ЩУК)
В) 3-гидроксибутановая < 2-гидроксипропановая < 2-гидроксибутандиовая
Соединения с различными основными центрами
R –NН2 > R-ОН > R-SH
Основные свойства в гомологических рядах увеличиваются. Основность вторичных алифатических аминов выше, чем первичных (влияние + I эффекта алкильной группы)
СН3-NН2 < С2Н5- NН2 < С3Н7 - NН2
СН3-NН2 < СН3- NН - СН3
Основность ароматических аминов ниже по сравнению с алифатическими
( из-за +М-эффекта аминогруппы в ароматическом соединении, проявляющегося в существовании р-π сопряжения )
С6Н5- NН2 < С2Н5- NН2
В пептидных (амидных) группах основные свойства у атома азота исчезают.
В ароматических гетероциклических соединениях пиррольный атом азота теряет, пиридиновый атом азота - сохраняет основные свойства. У пиррола отсутствуют основные свойства, пиридин обладает основными свойствами.
В имидазоле один атом азота образует основный центр, другой атом азота – кислотный центр.
основный
 центр
центр
 кислотный
кислотный
центр
Обучающая задача 1.
Сравните основные свойства обеих аминогрупп в молекуле белого стрептоцида – одного из первых эффективных сульфаниламидных препаратов, которые успешно применяются при лечении бактериальных инфекций.
1. Запишем формулу белого стрептоцида- амида сульфаниловой кислоты. В молекуле две аминогруппы: ароматическая и амидная.
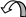
ароматическая амидная
амидная
2. Поставим первый вопрос: как влияет ароматическая система на основные свойства аминогруппы, связанной с бензольным циклом? Электроны неподеленной пары аминогруппы вовлекаются в сопряжение. Основные свойства аминогруппы снижаются по сравнении с алифатической аминогруппой (например, в этиламине С2Н5NH2).
3. Поставим второй вопрос: как изменяются основные свойства аминогруппы в составе сульфаниламидного фрагмента? Амидная группа полностью теряет основные свойства за счет очень сильного смещения электронной плотности от атома азота акцепторной группой SO2 (на атоме серы заряд δ+).
4. Слабые основные свойства проявляет только одна ароматическая аминогруппа, связанная с бензольным циклом.
Обучающая задача 2
В организме человека образуются кислоты: молочная (лактат) и β -гидроксимасляная. Обе кислоты снижают рН крови и могут быть причиной развития ацидоза. Сравните кислотные свойства карбоксильных и гидроксигруп в обеих кислотах.
Решение.
1.Запишем формулы обеих кислот
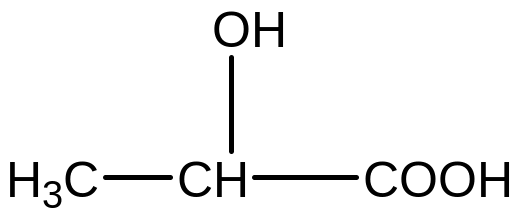
2- гидроксипропановая кислота 3-гидроксибутановая кислота
молочная кислота (лактат) (β-гидроксимасляная кислота)
2.Проведем анализ строения. Сходство: в составе обеих кислот присутствуют карбоксильная и гидроксигруппа. Известно, что кислотные свойства карбоксильной группы значительно больше, чем у гидроксильной. Обе группы обладают отрицательным (- I) индуктивным эффектом в отношении соседних атомов углерода. Отличие: разное расположение гидроксигрупп по отношению к сильному кислотному центру карбоксильной группе.
3. Индуктивный эффект передается по системе σ – связей. Чем ближе группы расположены, тем сильнее их влияние друг на друга.
4. В молочной кислоте гидроксигруппа расположена ближе к карбоксильной группе, во 2 (а) -положении, поэтому акцепторное индуктивное влияние проявляется сильнее по сравнению с β-гидроксимасляной кислотой, где гидроксигруппа расположена дальше, в 3(β ) – положении.
Поэтому 2-гидроксипропановая кислота сильнее, чем 3- гидроксибутановая.
5 Карбоксильные группы с их сильным отрицательным (- I) индуктивным эффектом увеличивают кислотные свойства гидроксигрупп. Вновь, в 2-гидроксипропановой кислоте карбоксильная группа оказывает более сильное действие по сравнению с 3-гидроксибутановой кислотой.
Кислотно-основные свойства биоорганических соединений
Таблица 4
-
Название
Структурная формула
Органические кислоты
рКа
Муравьиная кислота
НСООН
3, 75
Уксусная кислота
С Н3 -СООН
4. 76
Щавелевая кислота
НООС-СООН
1,23
Малоновая кислота
НООС-СН2 -СООН
2, 8
Янтарная кислота
НООС-СН2-СН2-СООН
4, 17
Бензойная кислота
С6 Н5 -СООН
4, 19
Фумаровая кислота
Малеиновая кислота
НООССН=СН СООН
3, 02
1, 92
Метанол
С Н3 -ОН
15,5
Этанол
С 2 Н5 -ОН
16, 0
Фенол
С6 Н5 -ОН
10, 0
Органические основания
рК b
Аммиак
NH3
4.75
Метиламин
CН 3 -NH 2
3,36
Этиламин
С2 Н5 - NH2
3,33
Анилин
С6 Н5 - NH2
9,38
Пиридин
С5 Н5 N
8,96
Мочевина
NH2 -С( О ) - NH2
13,9
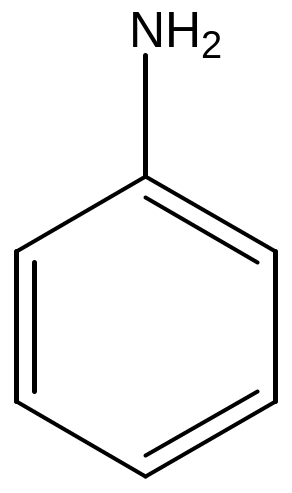 анилин
анилин
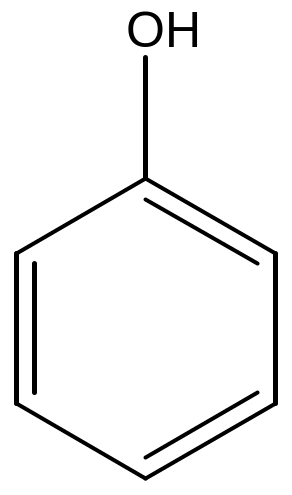 фенол
фенол
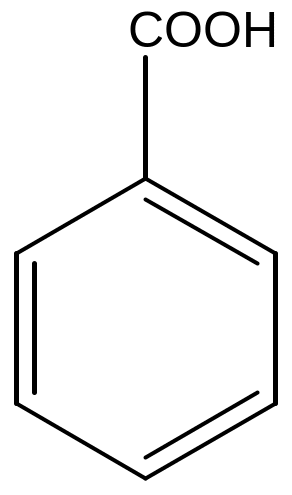 бензойная
кислота
бензойная
кислота
