
Розділ 2 Металознавство і термічна обробка.
Заняття № 6
Тема 2.1 Будова і кристалізація металів.
ПЛАН: 1 Поняття про науку "Металознавство".
2 Поняття про аморфні та кристалічні речовини. Кристалічна будова металів.
3 Типи і параметри кристалічних решіток. Реальна будова металевих кристалів.
4 Точкові, лінійні та поверхневі недосконалості, їх зв'язок з механічними властивостями металів.
5 Кристалізація металів. Критичні точки.
6 Зведена енергія для рідкого і твердого металу. Побудова кривих охолодження.
7 Поняття про поліморфізм (алотропію).
8 Методи дослідження структури металу: металографічний, рентгено - структурний і спектральний аналіз. Призначення і сутність кожного аналізу. Поняття про електронну мікроскопію. Фізичні методи досліджень і контролю якості металів - методи не руйнуючого контролю.
Мета заняття учбова: Поняття про аморфні та кристалічні речовини. Кристалічна будова металів.
Мета заняття виховна: Реальна будова металевих кристалів.
Самостійна робота № 2
Тема :Основні властивості металів
ПЛАН: 1Поняття об основних механічних властивостях - міцності, твердості, пружності, в'язкості, втомленості, методах їх випробуваній, в зв'язку від умов навантаження металу.
2 Методи випробовування твердості. Випробовування на міцність і побудову діаграми розтягу. Випробовування на ударну в'язкість.
Література: (1, с.60…88; 3, с.57…83; 4,с.60…78
1 Матеріалознавство вивчає у взаємозв'язку склад, будову та властивості матеріалів. Воно об'єднує металознавство та науку про неметалеві властивості, вивчає залежність будови і властивостей від методів виробництва та обробки матеріалів, а також зміну їх під впливом зовнішніх чинників: силових, теплових (термічних), радіаційних та інших.
Теоретичною основою матеріалознавства є відповідні розділи фізики та хімії. У матеріалознавстві широко використовують сучасні структурні дослідження, фізичні та механічні випробування. Завдяки цьому, а також беручи до уваги економічні розрахунки, можна обґрунтовано визначити доцільність застосування того чи іншого матеріалу в конкретних умовах експлуатації. Знання теоретичних засад металознавства дає змогу глибше зрозуміти процеси ливарного та зварювального виробництв, обробки металів тиском і різанням..
2 У величезному ряду матеріалів, з незапам'ятних часів відомих людині і широко використовуваних їм в своєму житті і діяльності, метали завжди займали особливе місце.
Підтвердження цьому: і в назвах епох (золотий, срібний, бронзовий, залізний століття), на які греки ділили історію людства: і в археологічних знахідках металевих виробів (ковані мідні прикраси, сільськогосподарські знаряддя); і в повсюдному використанні металів і сплавів в сучасній техніці.
Причина цього - в особливих властивостях металів, що вигідно відрізняють їх від інших матеріалів і роблять у багатьох випадках незамінними.
Метали – один з класів конструкційних матеріалів, що характеризується визначеним набором властивостей:
· «металевий блиск» (хороша відбивна здатність);
· пластичність;
· висока теплопровідність;
· висока електропровідність.
Дані властивості обумовлені особливостями будови металів. Згідно теорії металевого стану, металом є речовина, що складається з позитивних ядер, навколо яких по орбіталях обертаються електрони. На останньому рівні число електронів невелике і вони слабо пов'язані з ядром. Ці електрони мають можливість переміщатися по всьому об'єму металу, тобто належати цілій сукупності атомів.
Таким чином, пластичність, теплопровідність і електропровідність забезпечуються наявністю «електронного газу».
Всі метали, що твердіють в нормальних умовах, є кристалічними речовинами, тобто укладання атомів в них характеризується визначеним порядком – періодичністю, як по різних напрямах, так і по різних площинах. Цей порядок визначається поняттям кристалічна решітка(комірка).
Іншими словами, кристалічна решітка це уявні просторові грати, у вузлах якої розташовуються частинки, створюючи тверде тіло.
Кристалічна будова характеризується закономірним, геометрично правильним розташуванням атомів (іонів) у просторі.
Атоми (іони) металу перебувають на такій регулярній відстані між собою, при якій енергія взаємодії позитивно і негативно заряджених частинок мінімальна. Якщо через центри атомів кристалу провести лінії, то отримаємо просторову ґратку, а якщо через ряди атомів провести площини, то утвориться безліч однакових елементарних геометричних фігур. Виділимо в просторовій ґратці кристалу такий об'єм, що дає уявлення про будову всього кристалу і назвемо цей об'єм елементарною кристалічною коміркою.
3 Отже, елементарною кристалічною коміркою називається такий найменший об'єм, який дає нам уявлення про взаємне розташування атомів у всьому кристалі. Переважна більшість металів має одну з перелічених нижче елементарних кристалічних комірок: кубічну об'ємноцентровану, кубічну гранецентровану, гексагональну щільноукладену.
Кристалічну комірку зображають вузлами (точками), що відповідають положенню центрів атомів у стані спокою, сполучених уявними прямими лініями.
В елементарній кристалічній комірці об'ємноцентрований куб (ОЦК) вісім атомів розташовано на перетині ребер куба (рисунок 1а) і один — на перетині його діагоналей.
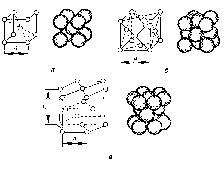
Рисунок 1 - Елементарні кристалічні комірки: об'ємноцентрована кубічна (а); гранецентрована кубічна (б); гексагональна щільноукладена (в); а, с — параметри комірки
Названу будову (ОЦК) мають метали: калій, натрій, (β-титан,β-цирконій, тантал, вольфрам, ванадій, α-залізо, хром та інші.
Елементарну кристалічну комірку характеризують: параметр, кількість атомів, що припадає на одну елементарну комірку, коефіцієнт компактності та координаційне число.
Параметр кристалічної комірки — величина, яка визначає її лінійні розміри. Очевидно, що для кубічної комірки параметром є довжина ребра куба а, яка вимірюється в нанометрах (нм). Один нанометр 1 нм = 10‾9 м. Для металів з кубічною елементарною коміркою значення а перебуває в межах 0,2...0,6 нм.
Кількість атомів, що припадає на одну елементарну комірку, для випадку об'ємноцентрованого куба можна визначити так. Кожен атом, що розташований на перетині ребер куба, належить одночасно 8 елементарним коміркам. Таких атомів у комірці вісім. Атом, що є в центрі комірки, належить тільки їй. Тому кількість атомів, яка припадає на одну елементарну комірку ОЦК, становить (1/8) ∙8 +1=2.
Коефіцієнт компактності комірки визначають як відношення об'єму, зайнятого атомами в межах куба, до об'єму куба. При розрахунках атоми розглядають як жорсткі кулі, що дотикаються між собою. У випадку об'ємноцентрованого куба це значення дорівнює 0,68.
Координаційне число — це кількість атомів, розташованих на найближчих і однакових відстанях від будь-якого атома в ґратці. Атом А (рисунок 2а), що в центрі куба, перебуває на найближчій і однаковій відстані від атомів 1-8, розташованих на перетині його ребер, тобто координаційне число цієї ґратки дорівнює 8, або К8. Що менше координаційне число, то менший коефіцієнт компактності комірки.
Елементарна кристалічна комірка гранецентрований куб (ГЦК) має вісім атомів на перетині ребер (рисунок 1б) і шість атомів — на перетині діагоналей граней куба. Така будова властива для свинцю, нікелю, срібла, золота, платини, у-заліза та інших металів.
Кількість атомів, що припадає на одну елементарну комірку гранецентрованого куба: (1/8) ∙8 + (1/2) ∙6 = 4. У цьому випадку число один відповідає атомам, які є на перетині ребер і число три — атомам, які є в центрі граней, оскільки кожен з атомів у центрі граней належить одночасно двом сусіднім коміркам.
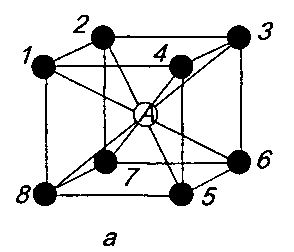


Рисунок 2- Координаційне число в різних кристалічних комірках для
атома А: а — об'ємноцентрована кубічна (К8);
б — гранецентрована кубічна (К12);
в — гексагональна щільноукладена (Г12)
Коефіцієнт компактності комірки для ГЦК становить 0,74, координаційне число — К12 (атоми 1...12 (рисунок 2б) є на найменшій і однаковій відстані від атома А, який є в центрі грані, тобто це атоми 1-4, розташовані на перетині ребер куба, атоми 5-8 і 9-12 — в центрі граней сусідніх комірок).
У гексагональній щільноукладеній комірці (ГЩУ) атоми розташовані в кутах (рисунок 1в) і в центрі основ шестигранної призми, а три атоми — між її основами. Таку комірку мають магній, α-титан, кадмій, реній, осмій, рутеній, цинк, берилій та інші метали.
Параметрами гексагональної щільноукладеноі комірки є її висота с і довжина а грані при с/а = 1,633. На одну елементарну гексагональну щільноукладену комірку припадає 6 атомів — два із 12 атомів, що є в кутах основ [(1/6)∙12 = 2], один, що є в центрі двох основ [( 1/2 )∙2 = 1], і три атоми між основами призми.
Коефіцієнт компактності комірки становить 0,74, координаційне число — 12 (Г12). На найменшій і однаковій відстані від атома А (рисунок 2 в), який є в центрі спільної основи сусідніх шестигранних призм, перебувають атоми 1-12. Серед них атоми 1, 2, 6, 7, 8, 12 у вершинах шестикутника і атоми 3,4,5 та 9,10,11 — у середній площині сусідніх призм.
4 Реальні кристали на відміну від ідеальних мають багато різних дефектів. Під дефектом розуміють зону кристалу, де порушено правильне розташування атомів. За геометричною ознакою дефекти кристалічної будови поділяють на: точкові, лінійні, поверхневі, об'ємні.
Точкові дефекти (нульвимірні) дуже малі в усіх трьох вимірах у просторі: їх розміри не перевищують декількох параметрів кристалічної комірки. До таких дефектів належать вакансії, міжвузлові атоми, атоми домішок тощо.
Рисунок 3 - Точкові дефекти: а — вакансія ; б — міжвузловий атом (•);
в — атом домішки ( ●)
Вакансією
називається
порожнє місце в кристалі, де мав би
перебувати атом.
Оскільки
атоми коливаються навколо положення
рівноваги, то окремий атом, наприклад
атом 1
з
вищою ніж середня енергією, покидає
вузол кристалічної ґратки й потрапляє
на поверхню кристалу або на границю між
зернами. На місці, де перебував атом 1,
утворилась вакансія , яку заповнює
згодом атом 2,
а
потім атом
3.
В
результаті відбувається міграція
вакансії в глибину кристалу.
атом.
Оскільки
атоми коливаються навколо положення
рівноваги, то окремий атом, наприклад
атом 1
з
вищою ніж середня енергією, покидає
вузол кристалічної ґратки й потрапляє
на поверхню кристалу або на границю між
зернами. На місці, де перебував атом 1,
утворилась вакансія , яку заповнює
згодом атом 2,
а
потім атом
3.
В
результаті відбувається міграція
вакансії в глибину кристалу.
Вакансії сприяють перебігу дифузійних процесів. Зі збільшенням кількості вакансій зменшуються густина, електро- і теплопровідність кристалу.
Міжвузловим називають атом, що вийшов із положення рівноваги і зайняв простір між вузлами (рисунок 3б). Перехід атомів у міжвузлове положення викликає опромінення нейтронами, при цьому значно менший вплив мають теплові коливання атомів.
Атоми домішок є навіть у найчистішому металі. Вони або заміщають атоми основного металу у вузлах кристалічної ґратки (рисунок 3в), або розташовуються між вузлами (рисунок 3 б).
Лінійні порушення будови кристалу мають малі розміри в двох вимірах і велику довжину в третьому. Дуже важливими серед лінійних дефектів є крайові та гвинтові дислокації, їх назва походить від латинського слова dislocation, що в перекладі означає розміщення.
Крайова дислокація — це лінія АВ (рисунок 4 б) на краю зайвої атомної півплощини АВЕС в кристалі. Одним із способів утворення крайової дислокації є зсув частини атомів кристалу відносно іншої частини атомів на ділянці площини ковзання ABCD (рисунок 4 а) під дією прикладеної сили F.
 Внаслідок
такого зсуву у верхній частині кристалу
маємо на одну атомну площину більше
(рисунок 4б),
ніж
у нижній. Зайва площина АВЕС,
яка
перпендикулярна до напрямку зсуву,
називається екстраплощиною.
Вона
не має продовження у нижній частині
кристалу. Екстраплощина
ніби
розклинює кристал, зближаючи атоми
над дислокацією і розсуваючи їх під
нею. Тому в невеликій спотвореній зоні
— ядрі
дислокації
—
міжатомні відстані менші або більші
від нормальних, а поза межами ядра вони
нормальні. Крайова дислокація АВ
простягається
на багато тисяч міжатомних відстаней.
Пересування дислокації під дією сили
F
може
відбуватись доти, поки вона не вийде на
поверхню кристалу, де утвориться сходинка
(рисунок 4 в). Якщо екстраплощина є у
верхній частині кристалу, то дислокація
умовно вважається позитивною
і
позначається знаком
┴
,
а
якщо екстраплощина лежить у нижній його
частині, то
— негативною
і
позначається ┬
.
Внаслідок
такого зсуву у верхній частині кристалу
маємо на одну атомну площину більше
(рисунок 4б),
ніж
у нижній. Зайва площина АВЕС,
яка
перпендикулярна до напрямку зсуву,
називається екстраплощиною.
Вона
не має продовження у нижній частині
кристалу. Екстраплощина
ніби
розклинює кристал, зближаючи атоми
над дислокацією і розсуваючи їх під
нею. Тому в невеликій спотвореній зоні
— ядрі
дислокації
—
міжатомні відстані менші або більші
від нормальних, а поза межами ядра вони
нормальні. Крайова дислокація АВ
простягається
на багато тисяч міжатомних відстаней.
Пересування дислокації під дією сили
F
може
відбуватись доти, поки вона не вийде на
поверхню кристалу, де утвориться сходинка
(рисунок 4 в). Якщо екстраплощина є у
верхній частині кристалу, то дислокація
умовно вважається позитивною
і
позначається знаком
┴
,
а
якщо екстраплощина лежить у нижній його
частині, то
— негативною
і
позначається ┬
.
Рисунок 4 - Крайова дислокація АВ, яка виникає внаслідок зсуву:
F — прикладена сила
Такий зсув призводить до появи домішкових атомів, що істотно зменшують пластичність металлу.
Скупчення домішкових атомів називається атмосферою Коттрелла.
Спотворення кристалу в ядрі дислокації оцінюють вектором Бюргерса.
Кількісною
характеристикою
дислокаційної структури є густина
дислокацій
ρ,
яка дорівнює відношенню сумарної
довжини дислокацій ∑l
до об'єму кристалу V:
![]()
Густина дислокацій помітно впливає на механічні властивості: з її збільшенням зростає міцність і знижується пластичність металів.
Поверхневі дефекти малі в одному вимірі і значно більші в двох інших. До цих дефектів належать границі зерен, границі фрагментів і блоків.
Конструкційні метали та їх сплави мають полікристалічну будову: вони складаються із безлічі дрібних кристаликів — зерен (рисунок 5). Сусідні зерна мають неоднакову орієнтацію кристалічних ґраток (рисунок 5 а). Між зернами існують вузькі перехідні зони шириною до декількох атомних діаметрів — границі зерен із нерегулярним розташуванням атомів ( рисунок 5б).

Рисунок 5 - Схема, що ілюструє різну орієнтацію кристалічних ґраток зерен (а) і границі зерен (б):
На границях концентруються дислокації та домішки. По границях зерен порівняно легко здійснюється дифузія. Границі зерен мають помітний вплив на механічні властивості металів. Що дрібніші зерна, то вища пластичність і міцність металів.
Об'ємними можна вважати локальні нагромадження точкових дефектів — вакансій, а також газові порожнини, мікротріщини й неметалеві вкраплення.
5 Будь-яка речовина може перебувати у трьох агрегатних станах: твердому, рідкому або газоподібному. Якщо тиск сталий, то перехід від одного стану до іншого в чистих металах відбувається при певній температурі. Наприклад, метал із твердого стану переходить у рідкий при температурі плавлення, а з рідкого стану — у газоподібний при температурі кипіння. На особливу увагу в металознавстві заслуговує кристалізація, оскільки тоді формується та або інша структура.
Кристалізацією називається перехід металу від рідкого до твердого стану з утворенням кристалічної структури. Величина, форма й напрям орієнтації кристалів у металевому виробі помітно впливають на його експлуатаційні характеристики. Вивчення закономірностей процесу кристалізації дає змогу набути необхідних знань і досвіду, які використовують для оптимізації структури та властивостей металів і їх сплавів.
Розглянемо перехід металу з рідкого стану в твердий.
При нагріві всіх кристалічних тіл спостерігається чітка межа переходу з твердого стану в рідкий. Така ж межа існує при переході з рідкого стану в твердий.
Кристалізація – це процес утворення ділянок кристалічної решітки в рідкій фазі і зростання кристалів з центрів, що утворилися.
Кристалізація протікає в умовах, коли система переходить до термодинамічно стійкішого стану з мінімумом вільної енергії.
Процес переходу металу з рідкого стану в кристалічне можна зобразити кривими в координатах час – температура. Крива охолоджування чистого металу представлена на мал. 3.2.

Рисунок 6 - Крива охолоджування чистого металу
![]() –
теоретична
температура кристалізації;
–
теоретична
температура кристалізації;
![]() .
–
фактична температура кристалізації.
.
–
фактична температура кристалізації.
