
Введение.
Учебно-методическая разработка составлена в помощь студентам Иркутского Медицинского Университета, изучающим физическую и биофизическую химию.
Она необходима для подготовки к лекциям и лабораторным работам, к коллоквиумам, зачетам и экзамену.
Методическая разработка состоит из двух частей: теоретической и экспериментальной, в которой студентам предлагается выполнить ряд лабораторных работ по данной теме.
Лабораторная работа только тогда имеет смысл, когда она проводится с пониманием эксперимента. Поэтому описанию работ предшествует рассмотрение теоретических основ изучаемой темы.
Такое теоретическое введение необходимо, что бы с минимальной затратой времени проработать вопросы теории, ответить на предлагаемые вопросы, решить задачи, которые приводятся в методической разработке каждого занятия.
Большое внимание уделяется решению задач, которые помогают проверить усвоение материала, а так же развивают способности применять теоретические знания к решению вопросов в медицинской практике.
Работая в физико-химической лаборатории, студент знакомится с устройством соответствующих приборов, которые широко используются в клинических, биохимических, фармацевтических и санитарно-гигиенических лабораториях.
По окончании работы студент должен представить преподавателю для проверки отчет по следующей форме:
Дата.
Название работы.
Значение темы лабораторного занятия для изучения других дисциплин и практической деятельности.
Цель занятия.
Ход работы.
Экспериментальные данные.
Необходимые вычисления, графики.
Возможные ошибки измерений и наблюдений. Расчет ошибки.
Выводы.
Электронные потенциалы и электродвижущие силы. Потенциометрия.
Значение темы.
Все процессы жизнидетельности организмов сопровождаются появлениям в клетках и тканях электродвижущих сил. Электрические явления играют большую роль в важнейших физиологических процессах: возбуждении клеток и проведении возбуждения по клеткам. Многие биологические процессы, такие, как переработка и усвоение питательных продуктов, передача сигналов нервной системы, механизм зрительного восприятия включают в себя стадии, характеризующиеся электрохимическими явлениями.
В организме имеются специальные вещества – ферменты, которые и осуществляют в клетках в определенном порядке стадии химического превращения питательных веществ. Комплексы различных веществ собраны и укреплены на мембранах клеток. Эти мембраны как бы выполняют роль электродов в гальванических элементах, а электролитами служат биологические жидкости, хорошо проводящие ток. При изучении моделей биомембран неожиданно обнаружили, что при сочетании липидных бислойных мембран и границы двух несмешивающих жидкостей, многие мембранные ферменты являются молекулярными генераторами тока.
А что такое распространение нервного импульса во время опасности? Мозг мгновенно рассылает тысячи команд различным органам о необходимости их действия. И можно фиксировать отдельные сигналы измерением биотоков.
О состоянии нашего сердца судят по электрокардиограмме, которая является не чем иным, как зафиксированными с помощью специального прибора электрохимическими показаниями, характеризующими происходящие там процессы.
Большинство ученых сходится на том, что память – не что иное как изменение химической структуры веществ в нервных клетках под действием электрических токов, возникающих в организме.
Клетка получила электрический импульс – сигнал запоминания. Под его воздействием происходит электрохимическое изменение в структуре некоторых соединений клетки и тем самым в структуре белков, которые синтезируются после запоминания. Разные импульсы будут вызывать разную структуру молекул.
Электрохимия начинает вмешиваться в древнейшую иглотерапию, которую в последнее время начали применять у нас в лечебной практике. При введении иглы в активную точку, она приобретает электрический потенциал, свидетельствующий о наличии в активных точках в этот момент электрохимических процессов.
Электродные процессы. Электродвижущие силы.
Если два различных металла погрузить в раствор электролита, то при их замыкании друг с другом металлическим проводником, можно обнаружить электрический ток.
Химические превращения, которые происходят в растворах на электродах из проводников первого рода, называются электродными процессами.
___________________________________________________________________________________________
Механизм возникновения потенциала на электроде.
Если в воду поместить пластинку какого либо металла, то ионы металла из его кристаллической решетки под влиянием полярных молекул воды будут отрываться и переходить в воду (процесс окисления). При этом поверхность металла зарядится отрицательно за счет избытка электронов металла, а слой воды зарядится положительно за счет ионов, которые перешли в воду. Ионы металла не будут распространяться по всему объему жидкости, а будут концентрироваться у поверхности металла, удерживаясь зарядом поверхности. Таким образом, на границе металл – вода, образуется двойной электрический слой и возникает потенциал между отрицательно заряженной пластинкой и слоем положительно заряженных ионов в растворе.

металл
раствор ( ![]() )
Катионы в растворе, участвуя в
тепловом движении могут получать такие
)
Катионы в растворе, участвуя в
тепловом движении могут получать такие
скорости в направлении поверхности металла, что могут потерять гидратную
оболочку и войти в состав кристаллической решетки(процесс восстановления)
При равенстве скоростей двух противоположных процессов в системе
устанавливается динамическое равновесие, которому соответствует
Рисунок №1. Двойной равновесный потенциал.
электрический слой
При погружении металла в раствор его соли наблюдается, аналогична картина, но равновесие наступает при другом скачке потенциала. Повышение концентрации ионов данного металла уменьшает способность ионов металла переходить с пластинки на раствор.
Таким образом, при погружении металла в воду или раствор, содержащий ионы данного металла, на границе раздела метал-раствор образуется двойной электрический слой и возникает потенциал, который называют электродным потенциалом.
Величина и знак электродного потенциала зависят от природы металла, активности (концентрации) ионов металла в растворе и температуры.
Поэтому металл может заряжаться относительно раствора как положительно, так и отрицательно.
Металлическая пластинка (проводник
I-го рода) находящаяся в
контакте с электролитом (проводником
II рода) называется
электродом. Условные обозначения
электродов: ![]() |Cu,
|Cu,
![]() |Al
(вертикальная черта граница раздела
фаз).
|Al
(вертикальная черта граница раздела
фаз).
Гальванические элементы.
Любой гальванический – электрохимический элемент состоит из двух электродов – полуэллементов. На электродах протекают электрохимические реакции – на одном окисление, а на другом – восстановление.
Одним из наиболее простых гальванических элементов является элемент Якоби-Даниэля, состоящий из двух электродов – цинкового и медного, погруженных в соответствующие растворы сульфатов цинка и меди, которые разделены полупроницаемой мембраной. Цинковый электрод заряжается отрицательно по отношению к медному. При замыкании внешней цепи – цинк растворяется. Происходит реакции:
Zn
- 2ē → ![]() (окисление) , а на медном электроде
выделяется медь:
(окисление) , а на медном электроде
выделяется медь:
![]() +
2ē → Cu
(восстановление).
+
2ē → Cu
(восстановление).
Суммарный процесс – тообразующая реакция: Zn + = + Cu.
При схематичной записи гальванического элемента все фазы составляющие элемент записываются в одну строчку.
Образующие его фазы отделяются друг от друга сплошной вертикальной чертой;
Вещества, входящие в одну фазу, разделяются запятыми;
Контактирующие растворы разграничиваются одной пунктирной вертекальной чертой;
Если устранен диффузный потенциал, то контактирующие растворы разграничиваются сдвоенной пунктирной вертикальной чертой.
В схематической записи слева пишется электрод, на котором протекает процесс окисления, а справа электрод, на котором протекает процесс восстановления. Например, схематическая запись элемента Якоби-Даниэля:
(-) Zn
|
¦¦ ![]() Cu
(+) Знаки (+) и (-) указывают
полярность электродов.
Cu
(+) Знаки (+) и (-) указывают
полярность электродов.
Термодинамика гальванического элемента.
Если в электрохимическом элементе обратимо и изотермически протекает реакция:
aA
+ bB
![]() cC
+ dD,
то Э.Д.С. такого элемента описывается
уравнением
cC
+ dD,
то Э.Д.С. такого элемента описывается
уравнением
Е = ![]() -
- ![]()
![]() или Е =
- 2,303
или Е =
- 2,303
![]()
Е =
– ![]() ;
;
Где ![]() - стандартная Э.Д.С.; а
и с - активности
и концентрации реагирующих веществ,
2.303 переводной множитель при переходе
от ln к lg;
- стандартная Э.Д.С.; а
и с - активности
и концентрации реагирующих веществ,
2.303 переводной множитель при переходе
от ln к lg;
![]() = 0,059 при Т= 298,15 К;
= 0,059 при Т= 298,15 К;
n – число электронов, участвующих в окислительно - восстановительном процессе; F – число Фарадея, 96486,7 Кл/моль.
При обратимом протекании химической
реакции в гальваническом элементе в
условиях постоянства температуры и
давления, получаемая электрическая
энергия будет наибольшей и совершаемая
системой электрическая работа будет
максимальной полезной работой реакции,
равной убыли изобарно – изометрического
потенциала A
max
= - ![]()
Если отнести работу реакции к количеству электричества nF кулонов, то электрическая работа, совершаемая элементом, будет A = nEF, где
n – число электронов, участвующих в элементарном акте электрохимической реакции;
F – число фарадея;
E – ЭДС элемента;
И тогда nEF = -
При стандартных условиях ( I
атм, T= 298, 15 К ) nEF
= - ![]()
Следовательно , стандартная ЭДС
элемента будет равна:
= ![]()
Стандартная ЭДС элемента равна разности
стандартных потенциалов (![]() )
правого (п) и
левого (л) электродов.
)
правого (п) и
левого (л) электродов.
![]() =
= ![]()
Максимальная полезная работа химической реакции равна :
A
max
= RT
(![]() -
-
![]() )
Уравнение
изотермы химической реакции Вант-Гоффа.
)
Уравнение
изотермы химической реакции Вант-Гоффа.
К – константа равновесия химической реакции.
Если активности всех ионов, участвующих
в реакции, равны единице ( ![]() =
… прод =
=
… исход = I) т.е. стандартные
условия, то:
=
… прод =
=
… исход = I) т.е. стандартные
условия, то:
A
max
= RT
или n![]() F
= RT
,
тогда стандартная ЭДС будет равна:
F
= RT
,
тогда стандартная ЭДС будет равна:
= или = 2, 303 .
Константу равновесия электрохимического процесса можно рассчитать и через изменение изобарного потенциала.
-
=
RT
или -
=
2, 303 RT
;
=
- ![]()
Значение можно вычислить по уравнению Гиббса-Гельмгольца:
= ![]() - T
- T![]() ,
где
- стандартная энтальпия;
Т – температура,
К;
- изменение энтропии при стандартных
условиях.
,
где
- стандартная энтальпия;
Т – температура,
К;
- изменение энтропии при стандартных
условиях.
Гальванические элементы могут быть построены с применением электродов различного типа.
Классификация электродов.
Электроды можно классифицировать по природе электронной реакции. Согласно этой классификации принято различать электроды первого рода, второго рода, газовые, окислительно-восстановительные и некоторые специальные типы электродов.
Металлические электроды первого рода.
Металлические электрод первого рода,
представляет собой металл (М), погруженный
в раствор, содержащий ионы того же
металла (![]() ).
).
Электроды первого рода можно схематически
представить в виде ![]() М (вертикальная черта-граница фаз; Z
– заряд катиона металла). На границе
металл-раствор протекает электродная
реакция:
М (вертикальная черта-граница фаз; Z
– заряд катиона металла). На границе
металл-раствор протекает электродная
реакция:
+ nē = М
Величину электродного потенциала для металлического электрода первого рода можно рассчитать по уравнению Нернста:
![]() =
= ![]() М +
М + ![]()
![]() – стандартный потенциал электрода
при
– стандартный потенциал электрода
при ![]() или
или ![]() = 1моль/
= 1моль/![]() ;
;
активность катионов металла в
растворе; ![]() концентрация
катионов металла в растворе;
концентрация
катионов металла в растворе;
N – Число электронов, участвующих в электродной реакции (n = Z);
R – Универсальная газовая постоянная;
R
= 8,314 Дж/К ![]() моль.
моль.
![]() при T
= 298, 15 К; 2, 303 – переводной множитель
при переходе от ln
и lg.
при T
= 298, 15 К; 2, 303 – переводной множитель
при переходе от ln
и lg.
(Если T=298,15 К , то ).
Поэтому уравнение Нернста после подстановки принимает вид:
![]()
![]()
ЗАДАЧА:
Вычислить потенциал цинкового электрода
в растворе, содержащем 1,2 г ![]() в 150
в 150 ![]() раствора при 298 К. Кажущаяся степень
диссоциации соли в растворе = 60%.
раствора при 298 К. Кажущаяся степень
диссоциации соли в растворе = 60%.
Алгоритм:
Кратко записать условие задачи. Дано: m = 1,2 г;
 = 60%; V = 150
;
T = 298 К;
= 60%; V = 150
;
T = 298 К;
![]() Zn
= 0,76 В
Zn
= 0,76 В
Найти: ![]() Zn
Zn
Вычислить молярную концентрацию раствора.
C(![]() =
= ![]() = 0,0496 моль/
= 0,0496 моль/![]()
Вычислить молярную концентрацию ионов цинка в растворе.
С = 0,6 ![]() 0,0496 = 0,02976 моль/
0,0496 = 0,02976 моль/
Вычислить электродный потенциал по уравнению Нернста.
Zn
=
Zn
+ ![]()
![]() = - 0,76 +
0,02976 = - 0,8376 В.
= - 0,76 +
0,02976 = - 0,8376 В.
Электроды второго рода.
Электрод второго рода представляет собой полуэлемент, состоящий из металла, покрытого слоем труднорастворимого соединения ( соли, оксида) и погруженного в раствор содержащий тот же анион, что и труднорастворимое соединение. Схематически электрод второго рода можно представить в виде:
![]() , а протекающую в нем реакцию - MA
+ Zē = M +
(A – анион, M
– металл).
, а протекающую в нем реакцию - MA
+ Zē = M +
(A – анион, M
– металл).
Потенциалы электродов второго рода легко воспроизводимы и устойчивы. Эти электроды часто применяются в качестве стандартных полуэлементов или электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее важны в практическом отношении каломельные, хлорсеребряные, ртутносульфатные и сурьмяные электроды.
Хлорсеребряный электрод.
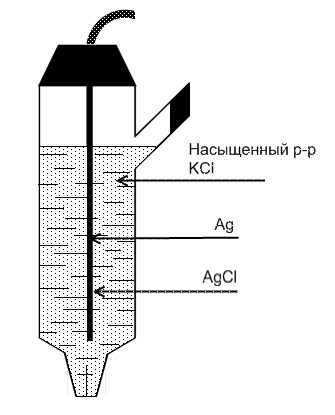 Хлорсеребряный электрод представляет
собой систему
Хлорсеребряный электрод представляет
собой систему ![]()
Серебряная проволочка покрыта слоем AgCl и помещена в раствор KCl определенной концентрации и насыщенного AgCl.
Раствор хлорида калия может быть
насыщенным или с концентрацией
1моль/
или 0,1 моль/
.
Потенциал возникает на границе ![]()
Электродная реакция полуэлемента: AgCl
+ ē ![]()
![]()
Направление реакции зависит от природы второго электрода.
Электрод обратим относительно катионов
серебра, так как анионы ![]() не участвуют в окислительно-восстановительном
процессе на электроде. Поэтому потенциал
электрода равен:
не участвуют в окислительно-восстановительном
процессе на электроде. Поэтому потенциал
электрода равен:
![]()
В насыщенном растворе AgCl
в присутствии KCl активность
ионов серебра определяется активностью
(концентрацией) ионов ![]()
Для труднорастворимой соли AgCl
![]() ;
;
![]() =
= ![]() тогда
тогда ![]() Ag
+
Ag
+ ![]() или
или
![]() Ag
+
Ag
+ ![]() -
- ![]()
![]() Ag
+
=
Ag
+
= ![]() После подстановки получаем :
После подстановки получаем :
![]() =
-
=
- ![]()
![]() (1), где
- стандартный потенциал
хлорсеребряного электрода, когда
активность или концентрация ионов хлора
в растворе равна единице (справочная
величина).
(1), где
- стандартный потенциал
хлорсеребряного электрода, когда
активность или концентрация ионов хлора
в растворе равна единице (справочная
величина).
Из уравнения (1) видно, что потенциал хлорсеребряного электрода зависит от температуры (Т,К) и активности (концентрации) ионов раствора KCl.
 Так как в процессе
измерений концентрация (активность)
ионов
почти не изменяется, то и потенциал
хлорсеребряного электрода при данной
температуре остается величиной
постоянной.
Так как в процессе
измерений концентрация (активность)
ионов
почти не изменяется, то и потенциал
хлорсеребряного электрода при данной
температуре остается величиной
постоянной.
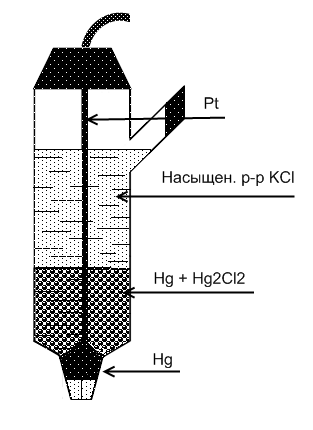
Каломельный электрод.
Каломельный электрод состоит из ртути,
пасты (приготовленной из каломели ![]() ,
раствора KCl, и одной капли
металлической ртути), платиновой
проволоки, которая контактирует с
металлической ртутью. Электрод заливают
раствором KCl, насыщенного
.
(Рис.)
,
раствора KCl, и одной капли
металлической ртути), платиновой
проволоки, которая контактирует с
металлической ртутью. Электрод заливают
раствором KCl, насыщенного
.
(Рис.)
Раствор хлорида калия может быть насыщенным или с концентрацией 1 моль/ или 0,1 моль/ .
Электродная реакция: + 2ē ⇆ 2Hg + 2 .
В электродной реакции участвует ртуть и поэтому потенциал электрода будет зависеть от активности ионов ртути.
![]()
Но в насыщенном растворе в присутствии KCl активность ионов ртути определяется активностью ионов раствора KCl. Соль одновалентной ртути труднорастворимое соединение.
ПР (
)
= ![]()
![]() тогда,
тогда, ![]() =
=
![]() . Если активность ионов ртути подставить
в уравнение для расчета потенциала, то
получим уравнение:
. Если активность ионов ртути подставить
в уравнение для расчета потенциала, то
получим уравнение:
![]() или
или

![]() -
-
![]()
![]()
(n=2 , участвует два электрона в электродной реакции).
Уравнение для вычисления потенциала каломельного электрода будет иметь вид :
![]() =
-
=
- ![]()
![]() или
=
–
или
=
– ![]() где,
где,
![]() - стандартный потенциал каломельного
электрода (справочная величина).
Следовательно, потенциал каломельного
электрода, как и хлорсеребряного, зависит
от активности ионов
и
температуры.
- стандартный потенциал каломельного
электрода (справочная величина).
Следовательно, потенциал каломельного
электрода, как и хлорсеребряного, зависит
от активности ионов
и
температуры.
Газовые электроды.
Любой газовый электрод представляет собой полуэлемнт, состоящий из металлического проводника, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Чаще, при конструировании газовых электродов используется платина, обладающая высокой адсорбционной и каталитической способностью.
Водородный электрод.
Г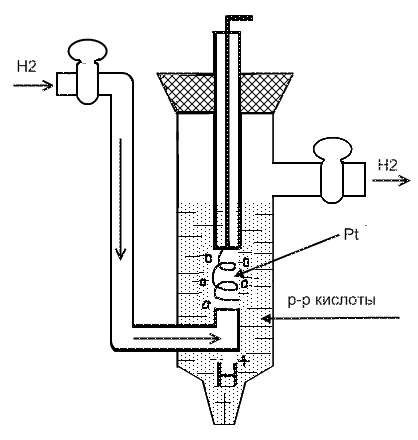 азовый
водородный электрод можно представить
схемой
азовый
водородный электрод можно представить
схемой ![]()
Молекулярный водород адсорбируется
на поверхности платины (Рис.) Адсорбированный
водород затем в виде ионов ![]() переходит
в раствор.
переходит
в раствор.
Электронная реакция водородного электрода:
2
2![]() 2H
=
или
2H
=
или ![]() + ē = H
= ½
+ ē = H
= ½ ![]()
Потенциал водородного электрода определяется не только активностью водородных ионов, но и парциальным давлением газообразного водорода – Р( ).
![]() +
2,303
+
2,303 ![]() , где
, где ![]() - стандартны потенциал водородного
электрода, когда давление водорода I
атм и концентрация катионов водорода
в растворе I моль/
- стандартны потенциал водородного
электрода, когда давление водорода I
атм и концентрация катионов водорода
в растворе I моль/![]()
Стандартный потенциал водородного электрода при всех температурах условно принят равным нулю.
Если давление водорода на платине равно единице – I атм (101,3 кПа), то
![]() +
2,303
+
2,303 ![]() (n=2, участвует два
электрона) или
(n=2, участвует два
электрона) или
+
2,303 ![]()
![]() =
0; pH
= -
=
0; pH
= - ![]() и тогда
и тогда ![]() = - 0,059 рН.
= - 0,059 рН.
Таким образом, при определенных условиях, потенциал водородного электрода дает непосредственно значение pH.
Окислительно-восстановительные или редокс-электроды.
Редокс-электродами называют такие
полуэлементы, в которых материал
электрода в реакциях не участвует, а
является лишь переносчиком электронов
для протекающей в растворе реакции
между окисленной и восстановленной
формами веществ. Например: ![]()
Потенциал, который принимает дифферентный электрод (чаще платина) при погружении в данную окислительно-восстановительную систему, называется редокс-потенциалом.
При исследовании биологических объектов, часто встречаются сложные редокс-системы, в которых присутствуют окисленные и восстановленные формы различных соединений.
Следует различать простые и сложные редокс-электроды. В первом случае электродная реакция сворится к перемене валентности ионов без изменения их состава, например: + ē ⇆ .
Простой редокс-електрод записывается в виде схемы: Red,Ox| Pt. Где Ox- окисленная, а Red – восстановленная формы вещества.
Потенциал простого редокс-электрода можно рассчитать по уравнению Петерса:
![]() ,
,
где aOx и aRed – активность окисленной и восстановленной формы вещества; n – число электронов, участвующих в окислительно-восстановительном процессе;
![]() -
стандартный окислительно-восстановительный
потенциал, когда aOx = aRed
(Справочная величина).
-
стандартный окислительно-восстановительный
потенциал, когда aOx = aRed
(Справочная величина).
Потенциал простого редокс-электрода зависит от температуры и соотношения активностей (концентрации) окисленной и восстановленной формы вещества.
Платиновый электрод относительно редокс-системы может заряжаться положительно или отрицательно. Например С ( ) » С ( ). За счет электронов платины происходит восстановление:
+ ē → .
Платиновая пластинка заряжается положительно и притягивает анионы раствора. Образуется двойной электрический слой с определенным скачком потенциала. Если в растворе С ( ) » С ( ) , то в этом случае протекает обратная реакция: - ē → .
Платиновая пластинка принимает электроны и заряжается отрицательно.
ЗАДАЧА:
Рассчитать потенциал платинового
электрода, погруженного в раствор,
содержащего 0,004 моль/
Fe![]() ,
и 0,002 моль/
Fe
(Т=298 К, коэффициенты активности считать
равными I)
,
и 0,002 моль/
Fe
(Т=298 К, коэффициенты активности считать
равными I)
Алгоритм.
Кратко записать условие задачи. Дано: С (Fe ) = 0,004 моль/
С (Fe ) = 0,002 моль/
Т=298 К; ![]() = + 0,771 В.
= + 0,771 В.
Найти: ![]() .
.
Вычислить редокс-потенциал по уравнению Петерса.
=
+ ![]() =
=
=
+ ![]() .
=
.
=
0,771 + 0,059 lg 0,002 =
0,771 + 0,059 lg2
![]() =
=
0,771 + 0,059 (lg2 + lg ) =
0,771 + 0,059 (0?3010 – 3) =
0,771 + 0,159 = 0,612 В.
В сложных редокс-электродах реакция протекает с участием ионов водорода. Схему сложного редокс – электрода записывают следующим образом:
![]()
Потенциалу электрода отвечает уравнение:
Хингидронный электрод.
Относится к сложным редокс-электродам.
Хингидронный электрод представляет
собой платиновый электрод, погруженный
в раствор, содержащий ионы водорода и
в большом избытке кристаллы хингидрона
- ![]() .
.
Хингидрон – это эквимолекулярное соединение хинона и гидрохинона, плохо растворимое в воде. При растворении в воде хингидрон диссоциирует на эквивалентные количества хинона и гидрохинона:
⇆ (хинон) + (гидрохинон).
Гидрохинон, являясь слабой кислотой, диссоциирует с отщеплением водородных ионов, а образующийся двухзарядный анион способен обмениваться электронами с хиноном:
+ 2![]() =
=
+ 2ē =
_________________________
+ 2 + 2ē +
Суммарная реакция показывает, что равновесие зависит от концентрации ионов водорода. Если в раствор хинон-гидрохинон погрузить платиновую (или золотую) пластинку – это будет хингидронный электрод. Платиновый электрод принимает электроны, заряжается отрицательно и притягивает катионы водорода. На границе Pt- раствор образуется двойной электрический слой и возникает потенциал.
![]()
![]() ,
где
,
где
![]() - стандартный потенциал,
- стандартный потенциал,
N = 2 (участвует два электрода),
- активность хинона,
![]() – активность гидрохинона.
– активность гидрохинона.
При избытке твердого хингидрона, отношение активностей (концентраций) хинона и гидрохинона является величиной постоянной.
Тогда ![]() 0,059
0,059
![]() a
(
)
или
a
(
)
или ![]() 0,059
pH.
0,059
pH.
Поэтому, хингидронный электрод можно использовать для определения pH растворов, но только в кислой среде. В щелочной среде равновесие смещается в сторону хингидрона.
ЗАДАЧА:
При 298 К ЭДС хингидронно-каломельного элемента равна 0,106 В. Вычислить pH раствора и концентрацию ионов .
Алгоритм:
Кратко записать условие задачи. Дано: (-) Hg|

 ,X,ГX|Pt
(+).
,X,ГX|Pt
(+).
E = 0, 106 В,
= 0,699 В.
Т = 298 К.
Найти: pH, C![]()
Вычислить pH раствора. 0,059 pH
pH = ![]() =
= ![]() = I
= I
Вычислить С ( ) pH = - ln С ( )
ln С (
)=
- 10,081 С (
)
= ![]() =
=
8,892 ![]() .
.
Ионоселективные электроды.
Ионоселективные электроды отличаются от всех рассмотренных ранее тем, что у них граничащие фазы – мамбрана-раствор – обладают ионной проводимостью, и потому на их границе не происходит электрохимическая реакция с переносом электронов. Процесс сводится здесь к обмену ионами между мембраной и раствором.
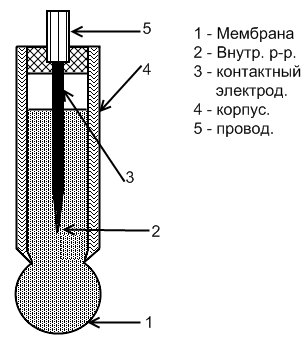 Междуфазовую
границу пересекают только ионы, заряд
которых при этом не изменяется. При
соответствующем подборе состава и
структуры мембраны, потенциал на
межфазовой границе будет зависеть от
активности только одного какого-либо
вида ионов. Такие электроды обладают,
следовательно, селективностью и
позволяют измерить активность отдельных
ионов.
Междуфазовую
границу пересекают только ионы, заряд
которых при этом не изменяется. При
соответствующем подборе состава и
структуры мембраны, потенциал на
межфазовой границе будет зависеть от
активности только одного какого-либо
вида ионов. Такие электроды обладают,
следовательно, селективностью и
позволяют измерить активность отдельных
ионов.
Мембраны ионоселективных электродов могут быть твердыми и жидкими. К твердым относятся стеклянные, кристаллические, гетерогенные.
Стеклянные электроды были первыми ионоселективными электродами (рис).
Обычно стеклянный электрод изготавливают в виде стеклянной трубки с выдутым на одном конце стеклянным шариком с очень тонкими стенками. Шарик заполняют раствором, содержащим NaCl и HCl. В раствор погружают хлорсеребряный электрод, т.е. серебряную проволочку покрытую AgCl.
При подготовке к работе, стеклянный электрод предварительно выдерживается в воде в течение достаточно длительного времени. При этом происходит гидролиз силиката натрия в поверхностном слое стекла мембраны.
![]()
Ионы водорода, получающиеся при диссоциации кремниевой кислоты, частично переходят в раствор. Образуется двойной электрический слой у поверхности стекла.
Раствор изнутри
![]()
______________________________
![]()
Стекло
![]()
Мембраны
______________________________
![]()
Раствор внешн.
Скачек потенциала на внутренней поверхности стеклянной мембраны имеет постоянную величину, а ее внешней меняется в зависимости от активности ионов исследуемого раствора. Потенциал стеклянного электрода – это разность потенциалов, возникающих на внешней и внутренней поверхностях стеклянной мембраны.
В стеклянной мембране электрода известной подвижностью обладают лишь низкозарядные катионы, в первую очередь катионы щелочных металлов (Na, K), а силикатные, алюмосиликатные и иные оксиды (CaO) образуют практически неподвижную стенку. При создании контакта между стеклянной мембраной и раствором, начинается обмен ионами между стеклом и раствором.
мемб. + р-ра = р-р + M мемб.
Обмен характеризуется константой обмена:
K
= ![]()
Потенциалу электрода отвечает уравнение:
![]()
В зависимости от значения К электрод селективен по отношению к ионам водорода (К« I), тогда
![]()
![]() или
или ![]() , где
, где
– стандартный потенциал стеклянного электрода.
Электрод селективен к ионам металла ( и др.) при К»I, либо не будет обладать селективностью при К = I.
