
1. Строение @, волновая функция, квантовые числа.
А́том (от греч. «неделимый») — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств. Благодаря открытию фотоэффекта, рентген., катодных лучей, радиоактивности, б/установлено, что атомы состоят из + и – заряж. частиц, взаимодействующих между собой.
Модель Томсона: море +-электричества с колеблющимися в нем ē.
Модель Резерфорда: в центре атома ядро, в к-ом сосредоточена вся масса, вокруг ядра движ-ся ē.
Планк выяснил, что излучение Е квантовано: Е=hν=>Бор: ē движ. по стац. орбитам, не излучают при этом э/м. Е, при переходе с одной орб. на др. ē испуск. или поглощ. квант Е.
Броиль, предполож. о двойственной природе ē:
Е![]() =h/mυ.
Принцип неопред. Гейзенберга:
=h/mυ.
Принцип неопред. Гейзенберга:
![]() .
Это неравенство даёт несколько
возможностей – состояние может быть
таким, что x может
быть измерен с высокой точностью, но
тогда p будет
известен только приблизительно, или
наоборот. Во всех же других состояниях
и x и p м/б.
измерены с «разумной» точностью.
.
Это неравенство даёт несколько
возможностей – состояние может быть
таким, что x может
быть измерен с высокой точностью, но
тогда p будет
известен только приблизительно, или
наоборот. Во всех же других состояниях
и x и p м/б.
измерены с «разумной» точностью.
П![]() ояв.
квант. мех., в основе – ур. Шр., совмещающее
корп. и волн. свойства. ĤΨ=EΨ,
Ĥ=Ек+Еп=p/2m+Eп.
Ψ – в.ф., носит вероятностный хар-тер,
опис. состояние ē в @, мол..| Ψ|2
выражает плотность вероятности нах-я
ē в опред. области пр-ва. Решая ур. Шр.,
польз. кв.числами:
ояв.
квант. мех., в основе – ур. Шр., совмещающее
корп. и волн. свойства. ĤΨ=EΨ,
Ĥ=Ек+Еп=p/2m+Eп.
Ψ – в.ф., носит вероятностный хар-тер,
опис. состояние ē в @, мол..| Ψ|2
выражает плотность вероятности нах-я
ē в опред. области пр-ва. Решая ур. Шр.,
польз. кв.числами:
n![]() є[0;
∞), хар-ет Ее,
размеры орб-ли; lє[0;n-1],
Ее,
форма эл.облака; mеє[-ℓ;ℓ],
положение эл. ρ в пр-ве. ms=+-1/2,
поведение ē (вращение). Из набора кв. ч.
м/охар-ть орбиталь – часть пр-ва, где
вер-ть обнаруж-я ē 95%. Число орб.= n2;
число ē = 2n2.
є[0;
∞), хар-ет Ее,
размеры орб-ли; lє[0;n-1],
Ее,
форма эл.облака; mеє[-ℓ;ℓ],
положение эл. ρ в пр-ве. ms=+-1/2,
поведение ē (вращение). Из набора кв. ч.
м/охар-ть орбиталь – часть пр-ва, где
вер-ть обнаруж-я ē 95%. Число орб.= n2;
число ē = 2n2.
Распред. ē в @ основано на положениях: 1) пр-п Паули: в @ не м/б. ē с одинаковым набором 4-х кв.ч.; 2) пр. Хунда: ē стремятся расположиться так, чтобы суммарный спин их был max; 3) пр-п наим. Е (Клечковского). Поряд. № опред. qя, число ē. В ПС группы сформированы по пр-пу близости кол-ва ē на вн.эн.ур. => связь между св-ми и стр-ем @. 7В гр. ns2(n-1)d5 – 7 ē на вн. эн. ур., но др. св-ва (по сравнению с 7А).
ē на внеш. обол. облад. малыми Еиониз. => эти ē легко отрыв. и уч-ют в х.р. Инертн. газы не уч-ют в х. р. (оболочка заполнена, ē тяжело отрыв.).
Теории ядер: капельная (атомное ядро можно представить в виде сферической равномерно заряженной капли из особой ядерной материи, которая обладает некоторыми свойствами, например несжимаемостью, насыщением ядерных сил, «испарением» нуклонов, напоминает жидкость); оболочечная (все нуклоны нах-ся на ядерн. орбиталях). Док-ва: квантован. излуч-е, сущ-е магических чисел n 2,8,20,28,50,82,126, 184; p 2,8,20,28,50,82,114; пр-п четности (повыш. устойч-ти ядер, содержащих четное число протонов и нейтронов).
2. Ковалентная связь.
К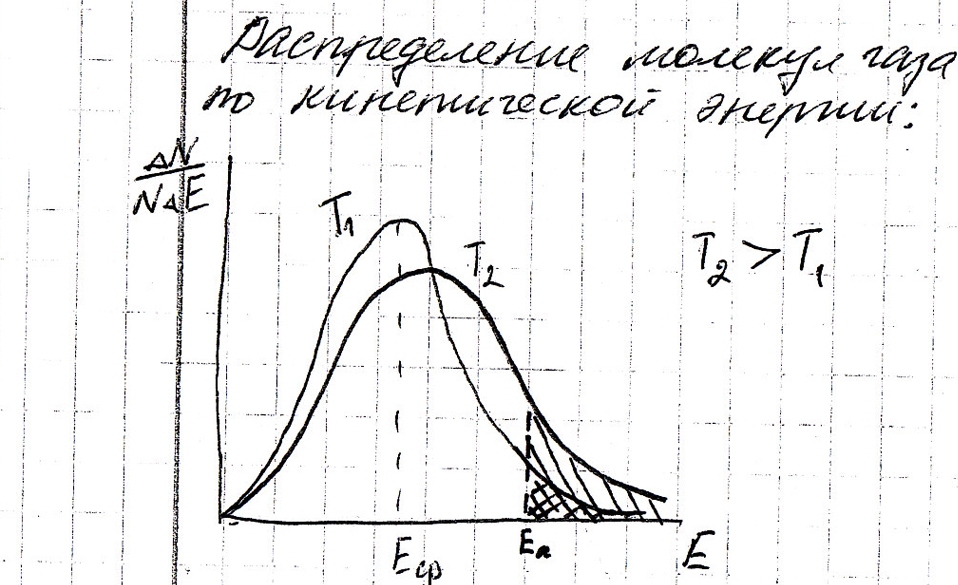 ов.
св. осущ-ся ē. Представления о ков. св.
базир-ся на работе Гейтлера и Лондона.
Они сдвигали 2 @ Н, получили зависимость
Ψ от координат, ввели поправки и получили
ур-е, позвол. найти зав-ть Е от r.
r0
– равновесное межъядерное расстояние
в молекуле Н2.
ов.
св. осущ-ся ē. Представления о ков. св.
базир-ся на работе Гейтлера и Лондона.
Они сдвигали 2 @ Н, получили зависимость
Ψ от координат, ввели поправки и получили
ур-е, позвол. найти зав-ть Е от r.
r0
– равновесное межъядерное расстояние
в молекуле Н2.
![]() Вывод:
хим. св. м-у @ м/осущ-ся, если вз-ют 2 орб.,
на к-ых есть ē: ↑ и ↑ или ↑↓ и
(дон.-акц.).
Вывод:
хим. св. м-у @ м/осущ-ся, если вз-ют 2 орб.,
на к-ых есть ē: ↑ и ↑ или ↑↓ и
(дон.-акц.).
Св-ва ков. св.: 1) двухцентровая (2 @); 2) двухē-ная (обр-ся общ. ē-пара); 3) короткодействующая (на мал. расст.); 4) насыщ. (т. 2 ē); 5) направ. (т. в этом направлении).
Р азработанная
на этой основе теория х.с. наз-ся методом
валентных связей. Связь обр-ся 2-мя ē с
противоп. направ. спинами. В н.в. МВС чаще
прим. в орг. химии: R-CHO
– функц. гр., св-ва > зависят от ф. гр.
Необх. рассм-ть канонич. стр-ры: I
п. Н 1s
1 св. Н-Н; II
п. , макс. кол-во связей = 4, но
азработанная
на этой основе теория х.с. наз-ся методом
валентных связей. Связь обр-ся 2-мя ē с
противоп. направ. спинами. В н.в. МВС чаще
прим. в орг. химии: R-CHO
– функц. гр., св-ва > зависят от ф. гр.
Необх. рассм-ть канонич. стр-ры: I
п. Н 1s
1 св. Н-Н; II
п. , макс. кол-во связей = 4, но
чаще вал-ть = кол-ву несп. ē. В – мера способности @ эл-та соед-ся с др. @ в опред. соотнош. BeF2 – 4 св. III п. макс. В=6 (всего 9 орб., но подойти достат. близко могут т. 6, т.к. эл-ты 3 пер. имеют небольш. размеры). СО2 О=С=О; Н2SO4 (пример). Каждый эл-т стремится завершить свою ē-оболочку.
МВС в некоторых случаях не позвол. оценить св-ва некот. соед., напр. О3, HNO3. Появ. метод наложения вал. схем.
BeH2 приним. уч-е s- и p-орб.=> связи не одинак. => связи перемеш-ся, обр. гибридные орб. (гибридизация). Действует пр-п взаимного отталкивания.
H-Be-H (sp). ВН3 sp2 120o; СН4 sp3 109o28’.
Если @ неодинак., углы измен-ся (неэквивал. гибр-ция), напр., CH3Cl.
М/приним. уч-е и непод. пары, напр., NH3 107o sp3.
В МВС не говорится о полярности связей. Если 2-атомная мол. сост. из @ одного х.э., то эл. облако распространяется симметрично относит. обоих ядер (связь непол.). Если из @ разл. х.э., ē-облако сдвиг-ся, связь обладает дип. моментом (связь полярная). Полярность связи условно показывает, какая часть ē-плотности одного @ смещена к др. Полинг предлож. рассм-ть эту св. как суперпозицию ков. и ион. связи. Если ионности > 50%, связь ионная.
μэкспер.=(1-х) μков+хμион μион=ql, μков=0
В н.в. физики утвержд., что d-орб. в обр-нии св. не уч-ют, появ. метод гиперсвязи (трехцентр., четырехэлектрон.).
МВС не объяс., напр., почему в мол. О2 2 несп. ē (О=О), сущ-ние иона Н2+ (нет ē-пары). Появ. ММО: ē принадлеж. молекуле, ē нах-ся на орб-лях, к-ые хар-ют молекулу (МО); МО м/б сконструир. разл. сп-ми, св-ва зависят от АО => ММО ЛКАО. «-» - напр., меньшая наглядность.
