
Цитозольный механизм действия (для стероидных, тиреоидных гормонов, витамина д, ретиноевой к-ты)
Г


М
АКТИВАЦИЯ РЕЦЕПТОРА
ЕМБРАНА
ЦИТОЗОЛЬ
N-конец ДНК-связ. С-конец
Экспрессия генов домен Гормонсвязующ.домен


В
↑ сродство к ДНК
нутриклеточный рецептор

Связывается со специф. геном в ядре
Регуляция экспрессии генов

Синтез белка-фермента

КЛЕТКИ-МИШЕНИ
Мембранно-опосредованный механиз действия а г Длительное действие гормона Десенсибилизация р денилатциклазная система
Р
7-тмс
Β1-адренорецепторы
Β2- адренорецепторы
Д1- рецепторы



Инактивация Р
Вместе с Г в клетку с помощью эндоцтоза
МЕМБРАНА КЛЕТКИ
α
β
γ
ГДФ

Диссоциация ГДФ
Образование исходного неактивного G-белка
Образуется короткоживущий комплекс
[Г+ Р+G-белок, не связанный с нуклеотидом]
Увеличивается сродство к βγ
Уменьшается сродство к АЦ

Связывается с ГТФ
Уменьшается сродство рецептора к G-белку


α -ГДФ
α -ГТФ


ДИССОЦИАЦИЯ КОМПЛЕКСА

Р
α -ГТФ
βγ
В то же время повысилась ГТФ-азная активность α субъединицы
Активация АДЕНИЛАТЦИКЛАЗЫ

АМФ

АТФ
цАМФ
Активация Са-зависимых ФДЭ
Инактивация протеинкиназы


R
C
ПРОТЕИНКИНАЗА А неактивная
R
C
↑Са в клетке
Диссоциация

цАМФ+ R2
С
С
Фосфорилирование Са-зависимых каналов



Каталитические субъединицы
Фосфорилирование белков по серину и треонину

Завершение «выключения системы»
ФОСФОПРОТЕИНФОСФАТАЗА
Дефосфорилирует белки
Изменение конформации и активности фосфорилированных белков

И г нозитолфосфатная система
R
Изменение конфигурации
↑ сродства к G-белку
[Г+R+G-белок]
Диссоциация ГДФ
Образуется короткоживущий комплекс
[Г+ Р+G-белок, не связанный с нуклеотидом]
Связывается с ГТФ
Уменьшается сродство рецептора к G-белку
ДИССОЦИАЦИЯ КОМПЛЕКСА
Р
α -ГТФ
βγ


Активация ФОСФОЛИПАЗЫ С

Гидролиз мембранных фасфатидил-инозитол-4,5-бифосфатов

Дальнейший гидролиз до арахидоновой к-ты
ИФ-3
ДАГ
Выходит в цитозоль
Остается в мембране
Завершение «выключения системы»
ФОСФОПРОТЕИНФОСФАТАЗА
Дефосфорилирует белки

Связывается с центрами Са-каналов мембран ЭР
Протеинкиназа с неактивная
Са выходит в цитозоль
Изменение конформации и активности фосфорилированных белков
Связывается с фосфатидилсерином
+кальмодулин (внутриклеточный рецептор Са)
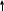
[ПКС+Са+ДАГ+ФС ] (активная ПКС)
Фосфорилирование белков


КАЛЬМОДУЛИН +4Са
Активация Na/Ca и H/Ca-транслоказы и Са-АТФ-азы ЭР
↓Са в клетке
Изменение конформации


Активация Са-кальмодулин-зав. протеинкиназ
СПОСОБЫ ВЗАИМОДЕЙСТВИЯ СИГНАЛОВ И КЛЕТОК МИШЕНЕЙ:
1) гормональное или гемокринное, т.е. действие на клетки, расположенные далеко от источника сигналов и использующие кровообращение для переноса сигнала от клетки производителя до отдаленной клетки - мишени.
2) изокринное, или местное, когда химическое вещество, синтезированное в одной клетке, оказывает действие на клетку, расположенную в тесном контакте с первой, и высвобождение этого вещества осуществляется в межтканевую жидкость и кровь;
3) нейрокринное, или нейроэндокринное (синаптическое и несинаптическое), действие, когда гормон, высвобождаясь из нервных окончаний, выполняет функцию нейротрансмиттера или нейромодулятора, т.е. вещества, изменяющего (обычно усиливающего) действие нейротрансмиттера;
4) паракринное — разновидность изокринного действия, но при этом гормон, образующийся в одной клетке, поступает в межклеточную жидкость и влияет на ряд клеток, расположенных в непосредственной близости;
5) юкстакринное – разновидность паракринного действия, когда гормон не попадает в межклеточную жидкость, а сигнал передается через плазматическую мембрану рядом расположенной клетки.
6) аутокринное действие, когда высвобождающийся из клетки гормон оказывает влияние на ту же клетку, изменяя ее функциональную активность;
7 )
солинокринное действие, когда гормон
из одной клетки поступает в просвет
протока и достигает таким образом другой
клетки, оказывая на нее специфическое
воздействие (например, некоторые
желудочно-кишечные гормоны).
)
солинокринное действие, когда гормон
из одной клетки поступает в просвет
протока и достигает таким образом другой
клетки, оказывая на нее специфическое
воздействие (например, некоторые
желудочно-кишечные гормоны).
ОСНОВЫ ГОРМОНАЛЬНОГО СИГНАЛА:
Специфичность, которая обеспечивается комплементарностью между структурой сигнальной молекулы а и активного центра рецептора. (Сигнальная молекула комплементарна активному центру рецептора; другие сигналы не комплементарны)
Кооперативность во взаимодействии лиганда и рецептора дает в результате большие изменения в активности рецептора при минимальной концентрации лиганда
Усиление (амплификация) сигнала. Когда ферменты активируют другие ферменты, число вовлекаемых молекул увеличивается в геометрической прогрессии в ферментных каскадах. Если бы сигнальные молекулы прямо взаимодействовали с исполнительными элементами , то это потребовало бы огромных количеств сигнальных молекул, перемещаемых по крови от места их образования к клеткам мишеням. Выход из этого положения - в создании механизмов усиления сигнала, с привлечением специальных ферментов и молекул, получивших название вторичных посредников
«выключение» действия сигнала. Это достигается разными приемами, включенными в механизм передачи сигнала. Активирование рецептора при взаимодействии с сигнальной молекулой одновременно включает механизм обратной связи, который отключает рецептор (например, путем фосфорилирования молекулы рецептора) или удаляет рецептор с поверхности клетки (путем эндоцитоза) или используются специальные белки, прерывающие передачу сигнала
Интеграция, способность системы, получая многочисленные и разнообразные сигналы, выдавать интегрированный ответ, соответствующий потребностям клетки или организма.
РЕЦЕПТОРЫ — это генетически детерминированные макромолекулярные сенсоры (простые белки, глико-и липопротеины), локализованные в специализированных образованиях клетки (плазматическая мембрана, цитозоль, ядро), обеспечивающие при специфическом взаимодействии с физиологически значимыми сигналами химической и физической природы трансформацию и передачу заключенной в них информации на пострецепторные структуры, инициируя каскад биохимических и / или физико-химических процессов, приводящих к конкретному ответу клетки-мишени на раздражитель.
Две группы:
рецепторы плазматической мембраны
внутриклеточные рецепторы .
Рецепторы плазматической мембраны клеток обеспечивают узнавание, связывание и передачу регуляторного сигнала внутрь клетки и относятся к одному из трех суперсемейств.
7-сегментные трансмембранные рецепторы (7-transmembrane segment receptots ) 7-TMС являются интегральными мембранными белками с семью трансмембранными спиральными сегментами, соединенными гидрофильными внеклеточными и внутриклеточными петлями. Внутриклеточные петли этих рецепторов содержат центры связывания G-белка. Поэтому 7-TMС рецепторы иногда называют рецепторами, связанными с G-белком (G-protein-coupled receptors — GPCRs), а по форме расположения полипептидной цепи в мембране, напоминающей змею – серпентиновыми рецепторами. При связывании лиганда эти рецепторы косвенно активируют (через связанный с ним G-белок) ферменты внутри клеток, которые катализируют образование внутриклеточных вторичных посредников.
Односегментные трансмембранные каталитически» рецепторы (single -transmembrane segment receptors ) 1-TMС — являются интегральными мембранными белками с одним трансмембранным сегментом и глобулярными доменами на экстраклеточной и внутриклеточной поверхностях мембраны. Внеклеточный домен содержит участок узнавания и связывания лиганда, а внутриклеточный домен, инициирующий каскад биохимических реакций в клетке в ответ на образование лигандорецепторного комплекса, обладает каталитической активностью (гуанилатцикпазной, тирозинкиназной и др.) Когда один из таких рецепторов активируется внеклеточным лигандом, его внутриклеточный домен катализирует образование внутриклеточных вторичных посредников
Каналообразующие рецепторы (channel-forming receptors) — состоят из ассоциированных белковых субъединиц, каждая из которых содержит несколько трансмембранных сегментов . Эти олигомерные структуры являются лигандозависимыми ионными каналами. Лигандами таких ионных каналов обычно являются нейромециаторы Это самые простые сигнальные преобразователи, которые открываются и закрываются (отсюда термин "ворота") в ответ на присоединение химических лигандов или изменений трансмембранного потенциала.
Внутриклеточные рецепторы расположены в цитозоле или ядре и после связывания со своими специфическими лигандами (примером может служить рецептор стероидного гормона эстрогена), изменяют скорость транскрипции специфических генов и трансляции их с образованием белков.
Мембранные рецепторы
7ТМС рецепторы взаимодействуют с гетеротримерными G –белками
1ТМС рецепторы
Рецепторы со свойствами гуанилатциклазы
Рецепторы со свойствами тирозинкиназы
Рецепторы, взаимодействующие с тирозинкиназами
Рецепторы со свойствами протеинфосфатаз
Рецепторы со свойствами СЕР/ТРЕ протеинкиназ
Ионные каналы
Лигандзависимые
Потенциалзависимые
Щелевые контакты
Ядерные и цитозольные рецепторы
Класс I – ядерные или цитоплазматические, без лиганда связаны с белками теплового шока
Класс II - ядерные, не связаны с белками теплового шока

Схематическое изображение структуры -адренэргического рецептора, относящегося к суперсемейству 7-ТМС, , включающего 3 подсемейства: 1) подсемейство -адренергического рецептора; 2) подсемейство секретиноподобных рецеторов; 3) подсемейство метаботропнык глутаматных рецепторов.
 G-БЕЛКИ-это
семейство белков,
относящихся кГТФазам и
функционирующих в качестве вторичных
посредников во внутриклеточных сигнальных
каскадах. в своём сигнальном механизме
они используют замену GDP на GTP как
молекулярный функциональный «выключатель»
для регулировкиклеточных процессов.
G-БЕЛКИ-это
семейство белков,
относящихся кГТФазам и
функционирующих в качестве вторичных
посредников во внутриклеточных сигнальных
каскадах. в своём сигнальном механизме
они используют замену GDP на GTP как
молекулярный функциональный «выключатель»
для регулировкиклеточных процессов.
Типы G-белков
Гетеротримерные ( иногда гетеротетрамерные) «большие»— это белки с четвертичной структурой, состоящие из трёх субъединиц: альфа(α), бета (β) и гамма (γ).
Малые G-белки — это белки из одной полипептидной цепи, они имеют молекулярную массу 20—25 кДа и относятся к суперсемейству Ras малых ГТФаз

ПРОТЕИНКИНАЗЫ А - гетеромеры, состоящие из 2-х каталитических (С2) и одной регуляторной субъединицы, состоящей из двух полипептидных цепей (R2).
Были выделены 3 типа каталитических (α,β,γ ) субъединиц и два типа регуляторных (I и II). Холоэнзимы R2С2 неактивны. Присоединение цАМФ вызывает диссоциацию фермента. При этом каталитические субъединицы освобождаются и начинают активно катализировать перенос фосфорного остатка с АТФ на определенные остатки серина или треонина некоторых белков органа- мишени.


 Инозитолфосфатная
система
Инозитолфосфатная
система

Взаимосвязь цАМФ и ИФ3 зависимых путей передачи сигналов.
Большинство эффектов цГМФ, как предполагают, опосредуется цГМФзависимой протеинкиназой, также называемой протеинкиназой G или ПкG, которая фосфорилирует остатки Сер и Тре в белках- мишенях после ее активирования цГМФ. Каталитические и регулирующие домены этого фермента расположены на одном полипептиде. (ММ. 80,000). Связывание цГМФ активирует каталитический домен. Ц ГМФ обладает и другим действием. Оно проявляется в механизмах восприятия света: цГМФ стимулирует открытие специфичных ионных каналов в палочках и колбочках сетчатки. И наконец, цГМФ - активатор фосфодиэстераз, катализирующих гидролиз цАМФ и тем самым значительно снижающим эффект цАМФ опосредованных путей передачи сигнала в клетки.

Обычным прикладным принципом регуляции секреции гормона является ПРИНЦИП ОТРИЦАТЕЛЬНОЙ ОБРАТНОЙ СВЯЗИ: сам гормон непосредственно или косвенно тормозит свою дальнейшую секрецию.
например, инсулин секретируется клетками поджелудочной железы в ответ на увеличение уровня глюкозы в крови и его действие направлено на повышение усвоения глюкозы клетками, что приводит к снижению уровня глюкозы крови. Последнее является сигналом для уменьшения секреции инсулина.
Однако в регуляции секреции некоторых гормонов может быть и ПРИНЦИП ПОЛОЖИТЕЛЬНОЙ ОБРАТНОЙ связи, при котором гормон непосредственно или косвенно вызывает дополнительную секрецию гормона.
например, выброс лютеинизирующего гормона (ЛГ) перед овуляцией - результат положительной обратной связи влияния эстрогенов на переднюю долю гипофиза, ЛГ затем действует на яичники и усиливает секрецию эстрогенов.
