
- •3.А) Рассчитайте стандартное изменение энтальпии реакции гидролиза мочевины:
- •4. Используя табличные данные, установите путем расчета ∆g˚298 возможность протекания в стандартных условиях реакции окисления этанола:
- •5. Запишите выражение константы равновесия для реакции синтеза аммиака:
- •18. Используя табличные данные, рассчитайте эдс и ∆g˚310 реакции и возможность ее самопроизвольного протекания в указанном направлении в стандартных биологических условиях:
Качественно оцените реакцию среды 0,05 М растворов а)НСl, б)NaOH. Рассчитайте значение рН каждого раствора исходя из молярной концентрации в них ионов Н+.
Решение.
а) НСl- сильный электролит, диссоциирует с образованием катионов Н+ и анионов Сl-
НСl= Н+ + Сl-
Так как в процессе диссоциации образуются катионы Н+, то среда в растворе кислая, рН<7
С(Н+)= С(НСl)= 0,05 моль/л
рН= -lgC(H+)= lgC(0.05)=1.3
б) NaOH- сильный электролит, диссоциирует с образованием катионов Na+ и анионов ОН-
NaOH= Na+ +OH-
Так как в процессе диссоциации образуются анионы ОН-, то среда в растворе щелочная, рН>7
С(Н+)= 1*10-14 / С(ОН-), где 1*10-14- ионное произведение воды
С(ОН-)= С(NaOH)= 0,05 моль/л
С(Н+)=1*10-14 / 0,05= 2,0*10-13
рН= -lgC(H+)= lgC(2,0*10-13)=12,7
Ответ. а) рН= 1,3, б)рН =12,7
2. В 200 мл раствора, плотность которого равна 1,01 г/мл содержится 1,11 г СаCl2 (М=111г/моль) и 0,585 г NаСl (М=58,5 г/моль). Рассчитайте: а)массовую долю NаСl в этом растворе, б) осмолярность раствора, в) осмотическое давление раствора при 37 С.
Решение.
а) Определим массовую долю NаСl в растворе.
ω= m(NаСl)*100%/ m(р-ра)
m(р-ра)= ρ*V=200*1,01= 202 г
ω= 0,585*100/202= 0,29%
б) Определим осмолярность раствора
Осмолярность – сумма концентраций катионов анионов и неэлектролитов, т.е. всех кинетически активных частиц в 1л. раствора. Она выражается в миллиосмолях на литр (мосм/л)
Концентрация СаCl2
С(СаCl2)= m(СаCl2 )/ М(СаCl2 )V=1,11/(111*0,2)= 0,05 моль/л
Концентрация NаСl
С(NаСl)= m(NаСl )/ М(NаСl )V=0,585/(58,5*0,2)= 0,05 моль/л
Осмолярность раствора
С(осм)= С(Nа+)+ С(Сl-)+ С(Са2+)=0,05+3*0,05+0,05= 0,25моль/л
в) Определим осмотическое давление раствора 37 С.
Т= 273+t=273+37= 310 К
Осмотическое давление
π = (m/MV) ∙RT = C(осм) ∙RT
π = 0,25*8,314*310= 644,3 кПа.
Ответ. а) ω= 0,29%, б) С(осм)=0,25 моль/л в) π = 644,3 кПа.
3.А) Рассчитайте стандартное изменение энтальпии реакции гидролиза мочевины:
СО(NH3)2(тв)+H2O(ж)=CO2(р-р)+2NH3(р-р), если стандартные энтальпии образования СО(NH3)2(тв), H2O(ж), CO2(р-р), NH3(р-р) равны соответственно (кДж/моль):-333, -286, -413 и -80,8. Благоприятствует ли энтальпийный фактор протеканию реакции.
б) Сколько теплоты будет поглощаться или выделяться при гидролизе 3г мочевины, если ее молярная масса 60 г/моль.
Решение.
СО(NH3)2(тв)+H2O(ж)=CO2(р-р)+2NH3(р-р)
а)ΔH°(298)= ΔfH°298(СО2)+ 2ΔfH°298(NH3)-( ΔfH°298(СО(NH3)2)+ ΔfH°298(Н2О))
ΔH°(298)=(-413-2*80,8)-(-333-286)=44,4кДж
Поскольку ΔH°(298)>0, то энтальпийный фактор не благоприятствует протеканию реакции
б) количество мочевины n= m/М(СО(NH3)2)= 3/60= 0,05 моль
При гидролизе 1 моль мочевины поглощается 44,4 кДж тепла, тогда при гидролизе 3г мочевины (0,05 моль) поглощается 44,4*0,05= 2,22 кДж тепла (так как ΔH°(298)>0- процесс эндотермический, идет с поглощением тепла).
Ответ. а) ΔH°(298)=44,4кДж. Поскольку ΔH°(298)>0, то энтальпийный фактор не благоприятствует протеканию реакции
Б) При гидролизе 3 г мочевины поглощается 2,22 кДж тепла.
4. Используя табличные данные, установите путем расчета ∆g˚298 возможность протекания в стандартных условиях реакции окисления этанола:
С2Н5ОН(ж)+ Н2О2(ж)=СН3С(О)Н(газ)+2Н2О(ж)
Не производя вычислений,оцените роль энтропийного фактора для этой реакции.
Решение.
Для данной реакции
ΔG°298 =2*ΔG°обр(H2O) + ΔG°обр(CH3CHO) – (ΔG°обр(C2H5OH) + ΔG°обр(H2O2) )
ΔG°обр(H2O)=-237,24кДж/моль
ΔG°обр(CH3CHO)=-133,31 кДж/моль
ΔG°обр(C2H5OH)= (-174.21) кДж/моль
ΔG°обр(H2O2)= (-120.4) кДж/моль
ΔG°298 = 2*(-237.24) + (-133.31) - (-174.21) - (-120.4) = -325.18 кДж
Критерием возможности самопроизвольного протекания реакции является изменение энергии Гиббса, при ΔG°<0- реакция возможна.
Так как ΔG°298 °<0-то возможно самопроизвольное окисление этанола пероксидом водорода в стандартных условиях.
Поскольку по уравнению реакции из 2 моль жидких веществ образуется 2 моль жидкого продукта реакции и 1 моль газообразного, то в процессе реакции упорядоченность системы уменьшается, следовательно энтропия возрастает, ΔS>0, т.е. энтропийный фактор благоприятствует протеканию процесса.
Ответ ΔG°298 =-325.18 кДж. Так как ΔG°298 °<0-то возможно самопроизвольное окисление этанола пероксидом водорода в стандартных условиях. ΔS>0, т.е. энтропийный фактор благоприятствует протеканию процесса.
5. Запишите выражение константы равновесия для реакции синтеза аммиака:
N2(газ)+3H2(газ)=2NH3(газ) ∆Н˚298<0
Как повлияет на состояние равновесия этой системы а)повышение температуры, б) повышение давления.
Рассчитайте константу этого равновесия, если исходные концентрации N2, Н2 и NH3 были 5, 14 и 0 моль/л, соответственно, а к моменту установления равновесия в реакцию вступило 40% азота.
Решение.
N2(газ)+3H2(газ)=2NH3(газ)
Kс = [NH3]²/([N2]*[H2]³)
а)Так как ∆Н˚298<0- реакция экзотермическая, идет с повышением тепла, поэтому, по принципу Ле Шателье, при повышении температуры равновесие в системе сместится влево- в сторону обратной эндотермической реакции.
б) Суммарное число молей газообразных продуктов реакции-2, суммарное число молей газообразных исходных веществ 1+3=4, т.е. реакция протекает с уменьшением числа молей газообразных веществ. Поэтому при повышении давления, по принципу Ле Шателье, равновесие в системе сместится вправо-в прямой реакции, протекающей с уменьшением числа молей газообразных веществ.
По уравнению реакции из 1 моль N2 и 3 моль Н2 образуется 2 моль 2NH3. Если к моменту равновесия в реакцию вступило 40% азота, то
[N2]*= 5-5*40/100= 3 моль/л
[H2]= 14-3*(5*40/100)= 8 моль/л
[NH3]=2*(5*40/100)=4 моль/л
K = 4²/(3*8³)= 0,0104
Ответ. Константа равновесия K = 0,0104
6. Константа скорости реакции гидролиза сахарозы (реакция первого порядка) при 25˚С равна 3,2*10-3 ч-1. Рассчитайте: а) период полупревращения реакции; б)время, за которое гидролизу подвергнется 90% исходного количества сахарозы.
Решение.
а) Для реакций первого порядка период полупревращения
![]()
Т(1/2)= ln2/0,0032=216,6 часов
б) время, за которое гидролизу подвергнется 90% исходного количества сахарозы.
Кинетическое уравнение реакции первого порядка:
![]()
Приведение уравнения к линейному виду даёт уравнение
![]()
Тогда ln(C0/(C0-0.9C0))= 0.0032*t
t=719.6 часов=30 суток
Ответ а) период полупревращения Т(1/2)= ln2/0,0032=216,6 часов, б) время, за которое гидролизу подвергнется 90% исходного количества сахарозы -30 суток.
7. Качественно оцените реакцию среды 0, 001М раствора NaOH и рассчитайте значение рН исходя из молярной концентрации ионов Н+.
Решение.
NaOH- сильный электролит, диссоциирует с образованием катионов Na+ и анионов ОН-
NaOH= Na+ +OH-
Так как в процессе диссоциации образуются анионы ОН-, то среда в растворе щелочная, рН>7
С(Н+)= 1*10-14 / С(ОН-), где 1*10-14- ионное произведение воды
С(ОН-)= С(NaOH)= 0,001 моль/л
С(Н+)=1*10-14 / 0,001= 1*10-11
рН= -lgC(H+)= lgC(1*10-11)=11
Ответ. рН =11
8. В 1 л раствора, плотность которого 1г/мл содержится 0,1 моль глюкозы (С6Н12О6) и 0,1 моль КСl. Вычислите: а) массовую долю КСl в этом растворе; б) осмолярность раствора, в)осмотическое давление раствора при 37˚С.
Решение.
Решение.
а) Определим массовую долю КСl в растворе.
ω= m(КСl)*100%/ m(р-ра)
m(р-ра)= ρ*V=1000*1=1000г
m(КСl)= n(КСl)*М(КСl)=0,1*74,55=7,455 г
ω= 7,455*100/1000= 0,745%
б) Определим осмолярность раствора
Осмолярность – сумма концентраций катионов анионов и неэлектролитов, т.е. всех кинетически активных частиц в 1л. раствора. Она выражается в миллиосмолях на литр (мосм/л)
Концентрация СаCl2
С(КCl)= n(КCl)/ V=0,1/1=0,1 моль/л
Концентрация глюкозы
С(С6Н12О6)= n (С6Н12О6 )/V=0,1/1=0,1 моль/л
Осмолярность раствора
С(осм)= С(К+)+ С(Сl-)+ С(С6Н12О6)= 0,1+0,1+0,1=0,3 моль/л
в) Определим осмотическое давление раствора 37 С.
Т= 273+t=273+37= 310 К
Осмотическое давление
π = (m/MV) ∙RT = C(осм) ∙RT
π = 0,3*8,314*310= 773,2 кПа.
Ответ. а) ω= 0,745%, б) С(осм)=0,3 моль/л, в) π = 773,2 кПа.
9. Какое количество теплоты выделится при сжигании 4, 48 л метана (СН4), если его стандартная энтальпия сгорания равна -875 кДж/моль. Запишите термохимическое уравнение реакции.
Решение.
ΔfH°(298)= -Q/n,
Тогда Q=- ΔfH°(298)*n
n(СН4)= 4,48/22,4= 0,2 моль (где 22,4л- мольный объем)
Q=-(-875)*0,2= 175 кДж
Термохимическое уравнение реакции
СН4(г)+2O2(г)=СO2(г)+2H2O(ж)+875кДж
Ответ. Q= 175 кДж
10. Не производя вычислений, установите знак изменения энтропии реакции:
2H2S(газ)+3O2(газ)=2SO2(газ)+2H20 (ж)
Определите, при каких температурах (высоких, низких, любых) возможно самопроизвольное протекание реакции, если ∆Н˚298<0
Решение.
По уравнению реакции: из 4 моль газообразных исходных веществ образуется 2 моль газообразных продуктов и 2 моль жидких продуктов реакции, т.е. упорядоченность системы увеличивается, следовательно ΔS<0.
Критерием возможности самопроизвольного протекания реакции является изменение энергии Гиббса, при ΔG°<0- реакция возможна
ΔG°= ΔН°-Т*ΔS°
Если ∆Н˚298<0 и ΔS<0- то изменение энергии Гиббса имеет отрицательные значения при низких температурах, и возможно самопроизвольное протекание реакции.
При достаточно высокой температуре величина (-Т*ΔS°) станет больше изменения энтальпии, и изменение энергии Гиббса будет величиной положительной (самопроизвольное протекание реакции станет невозможным).
11. Запишите выражение для константы равновесия 2NO2(газ)=N2O4(газ)
∆Н˚298=-57кДж. Как повлияет на состояние равновесия этой системы: а) повышение температуры, б) понижение давления.
Решение.
2NO2(газ)=N2O4(газ)
K = [N2O4]/([ NO2]²
Так как ∆Н˚298=-57кДж- реакция экзотермическая, протекает с выделением тепла. Поэтому, по принципу Ле Шателье, при повышении температуры равновесие в системе сместится влево- в сторону обратной эндотермической реакции.
Суммарное число молей газообразных исходных веществ -2, суммарное число молей газообразных продуктов реакции-1, реакция протекает с уменьшением числа молей газообразных веществ. Поэтому при понижении давления, по принципу Ле Шателье, равновесие в системе сместится влево- в сторону обратной реакции, протекающей с увеличением числа молей газообразных веществ.
12. Период полувыведения лекарственного препарата (реакция первого порядка) составляет 15 часов. Какая масса препарата останется в организме через 30 часов после приема 200 мг лекарства?
Решение.
Период полувыведения -это время, необходимое для того, чтобы исходное количество лекарства уменьшилась вдвое.
Период полувеведения препарата -15 часов, тогда через 15 часов в организме останется 200/2=100 мг лекарства.
Еще через 15 часов в организме останется 100/2=50 мг лекарства.
Следовательно через 30 часов в организме останется 50 мг лекарства.
Ответ. Через 30 часов в организме останется 50 мг лекарства
13. Напишите уравнения протолитических равновесий определяющих кислотность в 0,01М растворе молочной кислоты СН3СН(ОН)СООН , рКд=3,85.Качественно оцените характер среды и рассчитайте рН данного раствора.
Решение.
СН3СН(ОН)СООН= СН3СН(ОН)СОО- + Н+
Так как в процессе диссоциации образуются катионы Н+, то среда в растворе кислая, рН<7.
Рассчитаем рН 0,01М растворе молочной кислоты СН3СН(ОН)СООН , рКд=3,85
рН= 1/2 рКд+1/2lgC(СН3СН(ОН)СООН)= 3.85/2+1/2lg0,01=2,925
Ответ. рН=2,925
14. Напишите уравнения протолических равновесий, определяющих кислотность в 0,01М водном растворе NаНСО3, если для угольной кислоты рКа1=6, 36, рКа2=10,3. Качественно оцените характер среды и рассчитайте рН данного раствора.
Решение.
NаНСО3+Н2О= NaOH+Н2СО3
НСО3- +Н2О= OH- +Н2СО3
А также НСО3- = Н+ + СО32-
В процессе гидролиза образуется избыток ионов ОН-, поэтому среда в растворе щелочная, рН>7
рН = 1/2(рК1+рК2)=1/2*(6,36+10,3)=8,33
15. Рассчитайте рН раствора, в 1 л которого содержится 0,5 моль СН3СООН и 0,2 моль СН3СООNа, если для СН3СООН рКа=4,76. Укажите сопряженные кислоту и основание, напишите реакции, выражающие механизм буферного действия этого раствора по отношению к НС l иNаОН.
Решение.
![]()
рН=4,76- lg(0,5/0,2)=4,36
Слабая кислота СН3СООН, сопряженное с ней основание СН3СОО-
Причина буферного действия ацетатного буфера заключается в следующем.
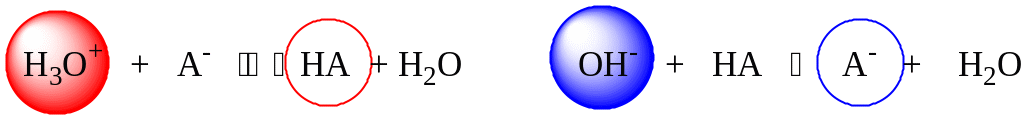
Где А- это СН3СОО-, НА это СН3СООН.
Сильная кислота при добавлении к буферному раствору «превращается» в слабую кислоту, а сильное основание - в слабое основание. Следовательно, заметного изменения рН раствора при этом не происходит.
16. Напишите уравнения первичной и вторичной диссоциации комплекса [Cu(en)2]Cl2 (en=NН2СН2СН2NН2) в растворе и выражение для константы устойчивости комплексного иона. Укажите заряд на внутренней сфере, степень окисления, заряд и координационное число иона-комплексообразователя, а также заряды лигандов и их дентантность.
Решение.
[Cu(en)2]Cl2
Ион- комплексообразователь Cu+2, координационное число меди 4,
лиганды – 2 молекулы NН2СН2СН2NН2 (этилендиамина, заряд молекул 0, это бидентантные лиганды)
Внутренняя сфера: [Cu(en)2]2+
Внешняя сфера 2 Cl-
Первичная диссоциация
[Cu(en)2]Cl2= [Cu(en)2] 2+ + 2 Cl-
Вторичная диссоциация протекает в 2 ступени
[Cu(en)2] 2+ = [Cu(en)] 2+ NН2СН2СН2NН2
[Cu(en)] 2+ = [Cu] 2+ NН2СН2СН2NН2
Суммарно
[Cu(en)2] 2+ = [Cu] 2+ 2NН2СН2СН2NН2
Константа устойчивости
Куст= С([Cu(en)2] 2+) / С([Cu] 2+ )*С²(NН2СН2СН2NН2)
17. Напишите уравнения гетерогенных равновесий и выражения Кпр для малорастворимых электролитов СаSО4 и ВаSО4. Определите, образуется ли осадок если к 1л раствора содержащего 2*10-3 моль СаСl2 и 1*10-3 моль Ва Сl2 добавили равный объем 0,02М раствора серной кислоты.
Решение.
СаСl2+Н2SО2= СаSО4+2НС l
СаSО4= Са2+ + SО42-
Кпр= С (Са2+ ) *С (SО42-)
Кпр(СаSО4)=6,1*10-5
При сливании равных объемов растворов концентрации уменьшаются пополам:
С (Са2+ )= 2*10-3*1/2=1*10-3 моль/л
С (SО42-)= 0,02/2=0,01 моль/л
С (Са2+ ) *С (SО42-)=1*10-3*0,01=1*10-5
Так как С (Са2+ ) *С (SО42-) меньше Кпр(СаSО4), то осадок сульфата кальция не выпадает.
ВаСl2+Н2SО2= ВаSО4+2НС l
ВаSО4= Ва2+ + SО42-
Кпр= С (Ва2+ ) *С (SО42-)
Кпр(ВаSО4)=8,1*10-9
При сливании равных объемов растворов концентрации уменьшаются пополам:
С (Са2+ )= 1*10-3*1/2=5*10-4моль/л
С (SО42-)= 0,02/2=0,01 моль/л
С (Ва2+ ) *С (SО42-)=5*10-4*0,01=5*10-6
Так как С (Ва2+ ) *С (SО42-) больше Кпр(ВаSО4), то осадок сульфата бария выпадает.
Ответ. Образуется осадок сульфата бария, осадок сульфата кальция не образуется.
