
- •Тема 1. Образование белков: общие представления о фолдинге
- •1.1. Строение белков
- •Вариантами вторичной структуры
- •1.2. Модели сворачивания белков.
- •Факторы фолдинга
- •Ферменты фолдинга
- •Шапероны
- •1.3.3. Прионы как антишапероны
- •Тема 2. Сортировка и модификация белков
- •2.1. Процессы в гранулярной эпс
- •2.2. Процессы в комплексе Гольджи
- •2.3. Сортировка и транспорт белков митохондрий
- •2.4. Образование коротких пептидов
- •2.5. Распад белков
Шапероны
Функции шаперонов.
1. Обеспечение "правильного" фолдинга новообразованных белков.
а) до того как большинство гидрофобных аминокислотных радикалов уйдут внутрь белковой молекулы, они могут вступить во взаимодействие с аналогичными радикалами других пептидных цепей. Т.е. до окончания фолдинга возможна агрегация новосинтезированных белковых молекул. Предупреждение агрегации новых белков, т.е. предупреждение «неправильных» внешних взаимодействий входе фолдинга – одна из важнейших задач шаперонов.
б) предупреждение «неправильных» внутренних (в пределах одной пептидной цепи) взаимодействий.
в) лабилизация «неправильных» слабых связей, для их исправления и достижения оптимальной конфигурации.
Все вместе это и означает «обеспечение правильного фолдинга».
Контроль за рефолдингом.
Под действием самых разных причин (перегрева, облучения, действия оксидантов и т.д.) белки, относительно давно синтезированные и до того успешно функционировавшие, могут терять свою нативную конформацию т.е. частично или полностью денатурировать, что сопровождается склонностью к агрегации. Считают, что такие белки в клетке могут подвергаться рефолдингу при активном участии шаперонов. Функция шаперонов в данном случае заключается в предупреждения агрегации и лабилизацией связей пространственной структуры белка. У прокариот и эукариот данную функцию выполняют т.н. белки теплового шока – Hsp (heat shock proteins) .
3. Участие в некоторых видах внутриклеточного транспорта белков: в частности, в лизосомы (для белков «отслуживших» свой срок и не поддающихся рефолдингу) и в митохондрии. При переносе в лизосомы шапероны препятствуют агрегации «старых» белков. В митохондрии переносятся напротив, новосинтезированные белки. Причем за счет собственной активности митохондрий синтезируется только 5% митохондриальных белков, остальные белки поступают из цитозоля, где образуются на свободных рибосомах. Фолдинг этих 95% белков откладывается до момента их локализации в митохондриях. Это объясняется тем, что через липидные слои мембран легче проникнуть, если полипептид находится в развернутом состоянии и гидрофобные радикалы не спрятаны внутрь частицы. В данном случае шапероны, находящиеся вне митохондрий, сразу связываются с продуктами трансляции и поддерживают их в развернутом состоянии до контакта с митохондриальной мембраной. Т.е. шапероны предупреждают преждевременный фолдинг. Другие белки-шапероны внутри митохондрий принимают полипептиды и помогают им принять нативную форму.
4. Поддержание ряда белков в определенной конформации, в состоянии как бы незавершенного фолдинга. В таком состоянии шапероны не теряют связи с соответствующим белком после его сворачивания.
Примером может служить локализующийся в цитоплазме белковый рецептор к гликокортикоидным гормонам. В отсутствии гормонов он связан с комплексом шаперонов (белков теплового шока). В таком состоянии у рецептора закрыта (экранирована) т.н. ядерная метка – та часть пептидной цепи, которая необходима для проникновения белка внутрь ядра. После связывания гликокортикоидов белки шапероны диссоциируют, фолдинг завершается и ядерная метка оказывается на поверхности. Поэтому рецептор проникает в ядро, переходит в димерную форму и связывается с определенным участком ДНК.
Второй пример - рецепторы к стероидным гормонам эстрогенам и прогестерону. Эти белки тоже связаны с шаперонами. Но теперь незавершенность фолдинга приводит не к блокировке ядерной метки, а к неспособности связываться с ДНК. Присоединение соответствующего гормона вызывает диссоциацию шаперонов, изменение структуры рецептора и связывание последнего с нужным локусом ДНК.
1.3.2.2. Система DпаК/DnaJ у бактерий
Белки теплового шока часто обозначаются по их молекулярной массе. Например, семейство белков Нsp70 — это шапероны с массой около 70 кДа.
У шаперонов часто имеются «помощники», или ко-шапероны. Это тоже белки, но обычно с меньшей молекулярной массой.
Один из представителей Нsp70 — шаперон DпаК; его ко-шапероном является белок DnaJ.
Система этих белков осуществляет, видимо, ко-трансляционный фолдинг (рис.1.8). Иначе говоря, они связываются с синтезирующимися полипептидными цепями еще до окончания трансляции — когда эти цепи еще находятся на рибосомах. Такое раннее связывание предупреждает «неправильные» взаимодействия внутри незавершенных пептидов и агрегацию цепей, высвобождающихся с рибосом.
В процессе фолдинга неоднократно расходуется АТФ, а по окончании фолдинга для отделения шаперонов требуется еще один фактор - GrрЕ.
Если после этого белок еще не принял окончательной нативной конформации, то на его поверхности остаются радикалы, способные связывать шапероны DпаК/DnaJ повторно. И так далее: полагают, что может быть несколько циклов связывания и высвобождения этой системы.
Таким образом, в отличие от представлений А.С. Спирина, допускается, что фолдинг может продолжаться и по окончании трансляции.
Более того, у Е. соli примерно 200-300 белков (составляющие 5-10 % от общего белкового пула) и после неоднократной «обработки» системой DпаК/DnaJ остаются в состоянии незавершенного фолдинга—в виде расплавленной глобулы.
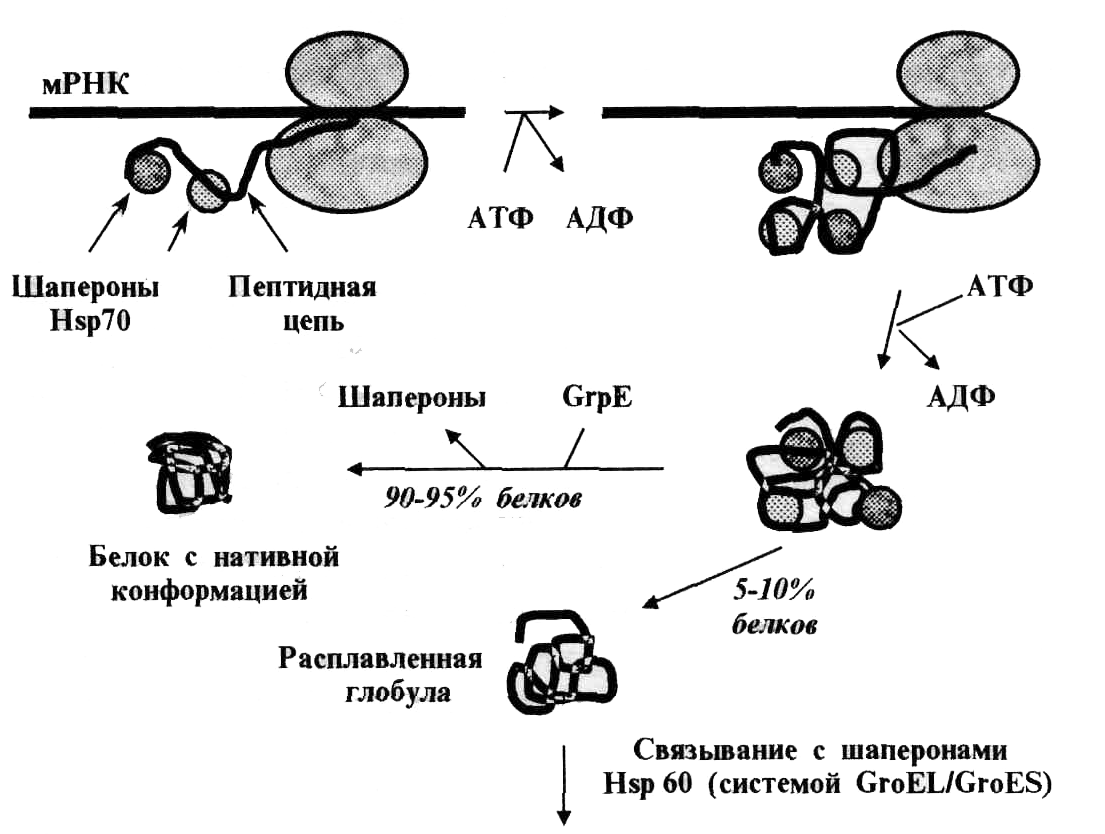
Рис. 1.8. Ко-трансляционный фолдинг шаперонами Hsp 70
Т. е. у них практически сформирована нативная вторичная структура, но межрадикальные связи являются пока случайными и непрочными. В основном, к таким белкам относятся достаточно крупные белки с относительно сложной пространственной конфигурацией.
Завершение фолдинга таких белков происходит с помощью другой системы шаперонов — GrоЕL/GrоЕS.
1.3.2.3. Система GrоЕL/GrоЕS у бактерий
Э та
шаперонная система изучена особенно
хорошо. Шаперон GrоЕL
относится к белкам Нsp 60, т. е. имеет массу
около 60 кДа (а точнее, 57 кДа). Масса
ко-шаперона GrоЕS
существенно меньше — 10 кДа.
та
шаперонная система изучена особенно
хорошо. Шаперон GrоЕL
относится к белкам Нsp 60, т. е. имеет массу
около 60 кДа (а точнее, 57 кДа). Масса
ко-шаперона GrоЕS
существенно меньше — 10 кДа.
Нередко белки Нsр 60 называют не шаперонами, а шаперонинами. Соответственно, и рассматриваемая здесь система GгоЕL/GгоЕS тоже называется шаперониновой.
Эта система (как и все семейство Нsр 60) содержится в бактериальных клетках, а также в митохондриях и хлоропластах эукариот.
Система особенно интересна тем, что ее белки формируют уникальный комплекс (рис. 1.9.). Он имеет вид двух «котлов», прилежащих друг к другу днищами, причем один из них (и только один!) может быть закрыт «крышкой».
Стенки и дно каждого «котла» образованы 7 молекулами (субъединицами) белка GrоЕL, расположенными по окружности.
В составе каждой субъединицы этого белка — три домена:
- апикальный (находится в области отверстия «котла»),
- промежуточный (участвует в образовании стенки «котла») и
- экваториальный (вместе с аналогичными доменами других субъединиц формирует дно «котла» и обеспечивает связь между двумя «котлами»).
Отверстие «котла» несколько уже, чем остальная часть его полости. В центральной же части полость имеет диаметр 9 нм, что вполне достаточно для размещения в ней весьма крупного белка.
Всего в клетке Е. соli — примерно 700 подобных комплексов белка GroEL (содержащих по 14 субъединиц).
Что же касается «крышки», которой может быть закрыт один из «котлов», то ее формируют 7 субъединиц второго белка — ко-шаперонина GгоЕS.
При этом имеется принципиальное обстоятельство: связывание «крышки» меняет конфигурацию белка GrоЕL. В открытом «котле» конфигурация такова, что на внутренней поверхности полости преобладают гидрофобные радикалы. В закрытом же «котле» внутренняя поверхность является гидрофильной (из-за переориентации соответствующих радикалов).
Эти изменения конфигурации энергетически обеспечиваются гидролизом АТФ. И для диссоциации «крышки», и для ее связывания должен происходить распад 7 молекул АТФ (до АДФ и фосфата). Катализируют этот распад сами субъединицы белка GroЕL — по 1 молекуле АТФ на субъединицу за каждый акт диссоциации или связывания «крышки» и сопутствующего изменения конформации.
Предполагаемый механизм функционирования данной системы показан на рис. 1.10.
В исходном состоянии комплекса полости обоих «котлов» пусты, а отверстие одного из них закрыто «крышкой».
Дальнейшие события таковы.
а) В открытый «котел» проникает субстрат — белок в состоянии незавершенного фолдинга, а именно расплавленная глобула.
Связыванию способствует тот факт, что на поверхности и такой глобулы, и внутренней стенки открытого «котла» в избытке находятся гидрофобные радикалы.
Некоторые авторы считают, что в процессе этого связывания апикальные домены белка GrоЕL могут также физически разворачивать глобулу, если она имеет «неправильную» структуру. Это позволяет объяснить вторую функцию шаперонов — рефолдинг давно образованных, но частично денатурированных белков.
б )
Взаимодействие субстрата с «котлом»
инициирует диссоциацию «крышки» от
второго «котла». Соответственно,
происходит гидролиз 7 молекул АТФ, и
второй «котел» также становится
гидрофобным.
)
Взаимодействие субстрата с «котлом»
инициирует диссоциацию «крышки» от
второго «котла». Соответственно,
происходит гидролиз 7 молекул АТФ, и
второй «котел» также становится
гидрофобным.
Не вполне ясно: может ли он теперь тоже связать молекулу белка с незавершенной структурой? Возможно, при занятом первом «котле» этому мешает какое-либо стерическое препятствие (тоже обусловленное изменением конформации белка GrоЕL).
в) Диссоциировавшая «крышка» тут же связывается вновь — с равной вероятностью с одним из двух «котлов». Следовательно, в 50% случаев она закрывает тот «котел», который содержит белок.
В таком случае срабатывают два обстоятельства:
во-первых, белок оказывается в замкнутом пространстве и, следовательно, теряет способность к агрегации с себе подобными частицами.
во-вторых, в данном «котле» внутренняя поверхность становится гидрофильной. Поэтому белок теряет связь с нею и оказывается предоставленным в полости сам себе.
В этом, как полагают, и состоит ключевая роль данной системы: она просто изолирует сворачивающийся белок, предварительно устраняя в нем «неправильные» взаимодействия, и затем дает ему возможность самому найти оптимальную пространственную структуру.
г) Через 15-20 с происходит очередной гидролиз АТФ — «крышка» диссоциирует и «котел» опять становится гидрофобным.
Если за это время белок успел принять нативную конформацию (т. е. сделался поверхностно гидрофильным), он больше не «липнет» к стенкам полости и диффундирует из нее.
д) Если же фолдинг не завершился, белковая глобула вновь связывается со стенками, оставаясь в полости.
Тогда после очередного связывания «крышки» цикл повторяется снова. И так далее—пока не будет достигнут необходимый результат.
В частности, для одного из ферментов — роданезы — установлено: его фолдинг в системе GrоЕL/GrоЕS включает в среднем 7 циклов.
Очевидно, все эти циклы могут проходить только по окончании трансляции.
Если белок является олигомерным, то роль системы GrоЕL/GrоЕS состоит в том, что она обеспечивает правильный фолдинг отдельных субъединиц и затем поставляет их в готовом виде в цитозоль. Сама же сборка субъединиц в олигомерные структуры происходит вне полостей данной системы.
