
Уравнение состояния идеальных газов
Законы Бойля—Мариотта, Гей-Люссака и Шарля устанавливают связь только между двумя из трех основных параметров газа р, ʋ и Т при условии, что значение третьего параметра остается постоянным. Уравнение состояния идеального газа устанавливает связь между всеми тремя основными его параметрами.
Допустим, что идеальный газ, заключенный в цилиндре с поршнем имеет параметры р1, ʋ1 и Т1 (рис. 1.2, а). Если уменьшить давление газа в цилиндре и подвести к нему некоторое количество теплоты, то газ перейдет в новое состояние, где будут иметь место параметры p2, ʋ2 и Т2 (рис. 1.2, б).
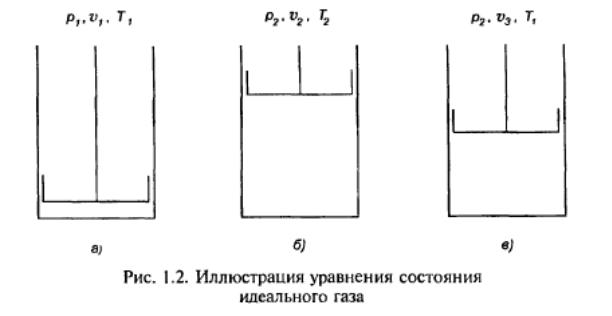
Чтобы установить связь между начальным и конечным состояниями газа, осуществим переход из первого состояния в последнее двумя промежуточными операциями. Сначала уменьшим давление газа от р1 до р2, поддерживая температуру Т1, постоянной путем подвода теплоты к газу. Тогда газ окажется в промежуточном состоянии (рис. 1.2, в) и будет иметь параметры p2, ʋ3 и Т1. Затем будем подогревать газ так, чтобы он продолжал расширяться, сохраняя свое давление неизменным, его температура при этом повысится до Т2 (рис. 1.2, б).
pʋ = RT. (1.1)
Уравнение (1.1) называется уравнением идеального газа, или уравнением Клайперона,
где R – удельная газовая постоянная.
Теплоемкость газов
Теплоемкостью газа, как и любого другого тела, называется количество теплоты, необходимое для нагрева тела на один градус.
Теплоемкость единицы количества вещества называется удельной теплоемкостью. Так как в термодинамике рассматривается главным образом удельная теплоемкость, то ее можно называть просто теплоемкостью.
Если единице количества вещества сообщить (или отвести от нее) какое-то количество теплоты (q) и если при этом происходит изменение температуры данного вещества от Т1 до Т2, то отношение теплоты q к разности данных температур представляет собой среднюю теплоемкость (с) газа в пределах от Т1 до Т2:
с = q/(T2 – Т1),
следовательно,
q = с(Т2 – Т1).
Теплоемкость вещества и в частности газа зависит от его природных свойств, а также от условий, в которых происходит процесс изменения его состояния, от температуры, а для реальных газов и от давления.
Теплоту можно подводить к рабочему телу различными способами. В термодинамике широко используется два способа подведения теплоты:
1) при постоянном удельном объеме (изохорный способ);
2) при постоянном давлении рабочего тела (изобарный способ).
Изохорный подвод теплоты происходит в цилиндре с неподвижным поршнем, изобарный — в цилиндре с подвижным поршнем при увеличении объема, давление при этом остается постоянным.
Величина q в соответствии с формулой (1.3) зависит не только от соотношения температур, но и от способа подвода теплоты. Поэтому различают теплоемкость при постоянном объеме сʋ, (изохорная теплоемкость) и теплоемкость при постоянном давлении ср (изобарная теплоемкость).
Первый закон термодинамики
Первый закон термодинамики: теплота может превращаться в механическую работу, а работа в теплоту лишь в строго эквивалентных количествах, причем количество теплоты, полученное рабочим телом от какого-либо источника тепла, равно сумме приращения внутренней энергии этого тела и количества совершенной им работы, т. е.

В термодинамике принято следующее-
• теплоту Q считать положительной, если она подводится к газу и отрицательной, если она отводится;
• изменение внутренней энергии ∆U считать положительным, если температура газа растет, и отрицательным, если она падает;
• работу L считать положительной, если газ расширяется и отрицательной, если газ сжимается под действием внешних сил.
Внутренняя энергия
Внутренняя энергия состоит из внутренней кинетической и внутренней потенциальной энергий. Первая — результат хаотического движения частиц тела, с увеличением скорости которых возрастает и внутренняя кинетическая энергия.
Так как температура тела определяется скоростью движения его частиц (молекул), то увеличение температуры тела означает увеличение его внутренней кинетической энергии.
Внутренняя потенциальная энергия связана с силами взаимодействия между частицами вещества.
Обратимые и необратимые процессы
Термодинамическим процессом называется последовательное изменение состояния рабочего тела, при котором параметры его состояния (все или некоторые) изменяются, а масса рабочего тела, совершающего процесс, остается неизменной.
Обратимыми называются процессы, в результате совершения которых в прямом и обратном направлениях термодинамическая система возвращается в исходное состояние.
Необратимым называется процесс, при котором система не возвращается в исходное состояние.
Все естественные самопроизвольные процессы необратимы. Обратимых процессов в природе не существует. Типичным примером необратимого процесса является процесс трения. Работа, затраченная на преодоление трения, превращается в теплоту.
Изохорный процесс
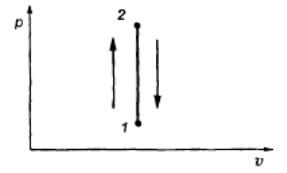
Изохорными называются процессы, протекающие при постоянном объеме. К таким процессам относятся нагревание или охлаждение газа в сосуде постоянного объема: ʋ - const.
 Диаграмма
изохорного процесса
Диаграмма
изохорного процесса
В изохорном процессе вся подведенная теплота идет на увеличение внутренней энергии газа.
Изобарный процесс
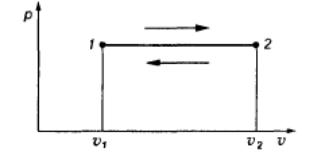
Изобарными процессами называются процессы, протекающие при постоянном давлении: р = const.
 Диаграмма
изобарного процесса
Диаграмма
изобарного процесса
Изотермический процесс
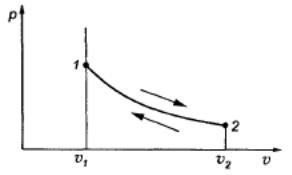
Изотермическим процессом называется процесс, протекающий при постоянной температуре: Т = const
 Диаграмма
изотермического процесса
Диаграмма
изотермического процесса
Таким образом, в изотермическом процессе расширения вся подведенная теплота расходуется на внешнюю работу, а при изотермическом процессе сжатия внешняя работа полностью превращается в теплоту.
Адиабатный процесс
Адиабатным процессом называют процесс, протекающий без подвода и отвода теплоты:
pʋk - const,
где k — показатель адиабаты — величина, равная отношению удельной изобарной теплоемкости к удельной изохорной теплоемкости:
k = cp/cʋ.
 Диаграмма
адиабатного процесса
Диаграмма
адиабатного процесса
Политропный процесс
Политропным процессом называют процесс, в котором могут изменяться одновременно все параметры газа (р, ʋ, Т), и между газом и окружающей средой осуществляется теплообмен.
Процессы в тепловых машинах, как правило, являются политропными.
Уравнение политропного процесса:
pʋn = const, где п — показатель политропы.
Второй закон термодинамики
Одна из формулировок утверждает, что теплота не может самопроизвольно перейти от более холодного тела к более теплому.
По другой формулировке самопроизвольный выход термодинамической системы из равновесного состояния практически невозможен.
Таким образом можно утверждать следующее:
• теплота только тогда может быть преобразована в механическую работу, когда в термодинамической системе имеется перепад температур;
• совершаемая работа зависит от уровня этих температур:
• полный переход теплоты в работу невозможен.
Цикл теплового двигателя
Принцип преобразования тепловой энергии в механическую работу состоит в использовании эффекта значительного объемного расширения газообразных рабочих тел при их нагревании.
Чтобы реализовать этот принцип необходимо иметь машину с рабочей полостью переменного объема, который должен быть заполнен рабочим телом. Один их вариантов такой машины — цилиндр с поршнем, перемещение которого позволяет изменять рабочий объем. При подводе теплоты к газу последний расширяется и оказывая силовое воздействие на поршень, перемещает его и производит внешнюю работу.
Для непрерывного получения механической работы необходимо осуществить круговой процесс, т. е. цикл.
Циклом называется совокупность процессов, происходящих в определенной последовательности, в результате осуществления которых рабочее тело возвращается в первоначальное состояние.
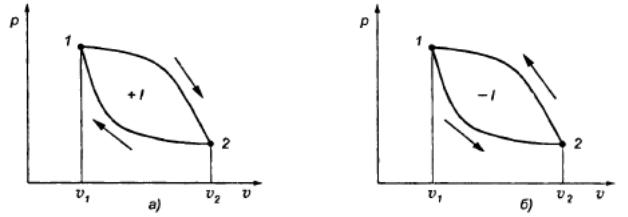
Диаграммы циклов работы тепловых машин
прямой (а) и обратный (б) циклы рабочих тепловых машин.
В реальных тепловых двигателях после осуществления каждого цикла происходит смена рабочего тела. Однако возможны и замкнутые циклы, совершаемые с одним и тем же рабочим телом путем изменения параметров его состояния. С точки зрения термодинамики эти две схемы совершенно эквивалентны.
Прямые циклы лежат в основе работы тепловых двигателей.
Работа обратного цикла отрицательна и используется в холодильных машинах.
Термодинамический КПД определяет степень преобразования тепловой энергии в механическую в прямом цикле.
