
- •Задание на контрольную работу и Общие указания к выполнению контрольной работы
- •Варианты контрольного задания
- •Химическая термодинамика Энергетика химических процессов
- •Термохимические законы
- •Контрольные вопросы.
- •Химическая кинетика
- •Контрольные вопросы.
- •Химическое равновесие
- •Контрольные вопросы.
- •Растворы. Гидролиз солей. Жесткость воды.
- •Контрольные вопросы.
- •Термодинамика электрохимических процессов
- •Контрольные вопросы
- •Электролиз
- •Контрольные вопросы.
- •Коррозия и защита металлов
- •Химическая коррозия
- •Контрольные вопросы
- •Учебно-профессиональные задачи курса
- •Задачи для самоконтроля
- •Приложение
- •Энергия ( потенциал ) ионизации и электроотрицательность атомов элементов
- •Стандартные теплоты ( энтальпия ) образования н0298; энтропии s0298 и энергии Гиббса образования g0298 некоторых веществ
- •Стандартные электродные потенциалы ( 0 ) некоторых металлов ( ряд напряжений ) при 298к.
Контрольные вопросы.
61. Напишите выражение для константы равновесия системы:
4HCl(г)+O2(г) 2H2O(г) + 2Cl2(г) , Ho298=-114,5кДж. Изменением какого фактора (концентрации, давления или температуры) можно добиться увеличения константы равновесия? В какую сторону сместится при этом равновесие системы?
Как можно добиться повышения выхода аммиака (изменяя концентрацию веществ, давление и температуру) в реакции, протекающей по схеме: N2 +3H2 2NH3 ; H < 0. Вывод сделайте на основании принципа Ле Шателье и подтвердите расчетом (в случае изменения давления, при условии, что давление изменяется соответственно в 3 раза) Напишите выражение константы равновесия.
В каком направлении сместится равновесие реакции: А2(г)+2В(г) 2АВ(г), если давление увеличить в 2 раза и одновременно повысить температуру на 500С? Температурный коэффициент прямой и обратной реакции равен соответственно 2 и 3. Каков знак H0 этой реакции?
Напишите выражение Кр для гомогенной системы
N2
+ 3H2
2NH3,
![]() H
= - 46 кДж
H
= - 46 кДж
Какими изменениями концентрации, температуры и давления можно повысить выход NH3?
Напишите выражение Кр для гетерогенной системы CO2 + C 2CO Какими изменениями концентрации и давления сместить влево равновесие системы?
Почему при изменении давления смещается равновесие системы
4HCl(г) + O2(г) 2H2O(г) + 2Cl2(г) и не смещается равновесие системы
H2(г) + J2(г) 2HJ(г)? Напишите выражение Кр для каждой из систем.
67. При 500 К константа
равновесия равна 3,4·10-5.
Вычислите для этой реакции
![]() .
.
68. Из приведенных ниже значений термодинамических функций укажите те, которые являются критерием состояния равновесия в изолированной системе (Р, Т=const):
а) H < 0, б) G < 0, в) S > 0, г) G = 0, д) S = 0
Дайте обоснованный ответ. Возможно ли самопроизвольное изменение физической величины в выбранном Вами критерии после установления равновесия? Если нет, то как достичь изменения физической величины в выбранном Вами критерии с помощью внешнего воздействия?
69. Из приведенных ниже значений термодинамических функций укажите те, которые являются критерием состояния равновесия в закрытой системе (Р, Т=const):
а) H > 0, б) S = 0, в) G > 0, г) G = 0, д) S > 0
Дайте обоснованный ответ. Можно ли изменять термодинамические параметры системы без нарушения равновесного состояния?
70. Для реакции Si(к)+2Н2О(г)SiО2(к)+2Н2(г) укажите правильно записанное выражение для константы равновесия Кр:
а)
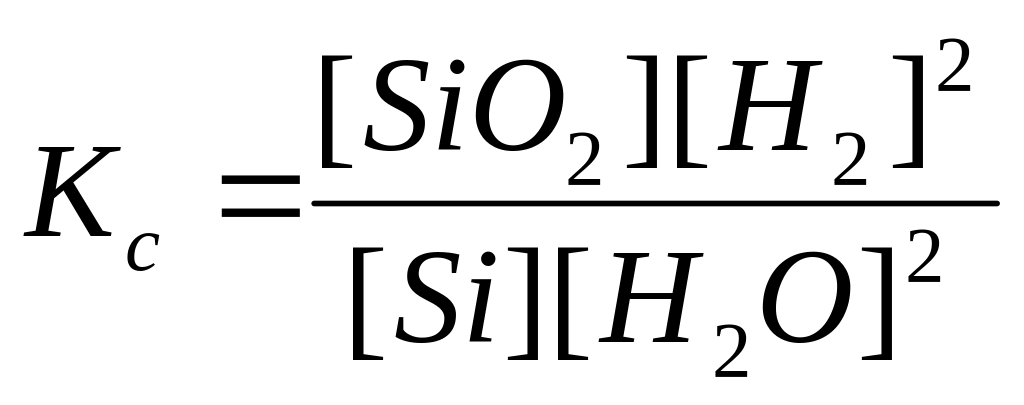 б)
б)
![]()
в)
![]() г)
г)
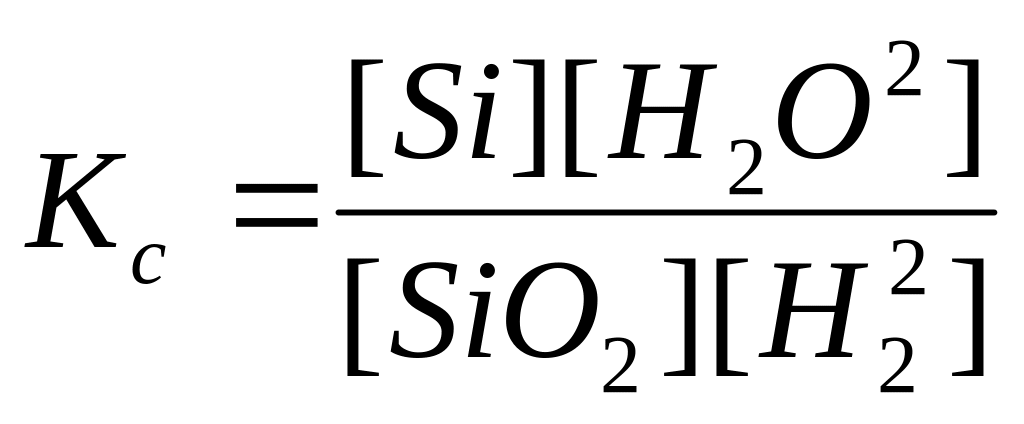
д)
![]() е)
е)
![]() ж)
ж)
![]()
Проанализируйте ошибки в неверно записанных выражениях. На основе какого закона составляется выражение для константы равновесия Кр?
71. При некоторых условиях для реакции 2NO(г)+Cl2(г)2NOCl(г) константа равновесия равна 10. Какие выводы Вы можете сделать из этого значения?
72. В обратимой химической реакции А + 2В С равновесие наступило при следующих равновесных концентрациях: [А] = 0,6 моль/л; [В] = 1,2 моль/л; [С] = 2,16 моль/л. Определить константу равновесия и исходные концентрации веществ А и В.
73. Укажите, к какому из значений константы равновесия
Кр→0, Кр→∞, Кр→1
относятся утверждения (условия стандартные):
а) реакция протекает в прямом направлении практически необратимо,
б) реакция в прямом направлении почти не протекает, но практически полностью протекает в обратном направлении,
в) оба направления протекания реакции (прямое и обратное) практически равновероятны.
74. Рассмотрите следующую равновесную систему:
SO2(г)+ O2(г) = SO3(г) – 378 кДж
Как будет изменяться число молей SO3 в реакционной смеси, если:
а) добавить в систему O2;
б) удалить из системы SO2;
в) добавить катализатор;
г) уменьшить температуру?
75. Пользуясь принципом Ле-Шателье, укажите оптимальные условия (температуру и давление), обеспечивающие увеличение выхода аммиака при его прямом синтезе из азота и водорода. Объясните, почему в реальных условиях производственный процесс проводят при температурах 450-5000С и используют катализатор?
76. В каком направлении сместится равновесие системы N2+3Н2=2NН3 Н0=-192 кДж/моль, при понижении температуры? Как объяснить, что на практике синтез аммиака ведут при повышенной температуре (не ниже 400-5000С)?
77. В системе А(г.)+2В(г.)=С(г.) равновесные концентрации равны: [А]=0,06 моль/л; [В]=0,12 моль/л; [С]=0,216 моль/л. Найти константу равновесия реакции и концентрации веществ А и В.
Рассчитать константу равновесия реакции: 2SO3/г/2SO2/г/+О2/г/., пользуясь справочными данными G.
В закрытом сосуде установилось равновесие: СО2(г.)+Н2(г.)↔СО(г.)+Н2О(г.); константа равновесия равна единице. Определить: а) сколько процентов СО2 подвергнется превращению в СО при данной температуре, если смешать 1 моль СО2 и 5 молей Н2? б) в каких объёмных соотношениях были смешаны СО2 и Н2, если к моменту наступления равновесия в реакцию вступило 90% первоначального количества водорода?
При состоянии равновесия в системе N2(г.)+3Н2(г.)↔2NН2(г.); ΔН0=-92,4 кДж, концентрации участвующих веществ равны: [N2]=3 моль/л; [Н2]=9 моль/л; [NН3]=4 моль/л. Определить: исходные концентрации водорода и азота; б) в каком направлении сместится равновесие с ростом температуры? в) в каком направлении сместится равновесие с повышением давления?
Константа равновесия реакции FеО(к.)+СО(г.)↔Fе(к.)+СО2(г.) при некоторой температуре равно 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации составляли соответственно 0,05 и 0,01 моль\л.
Для реакции Н2(г.)+Br2(г.)↔2НВr(г.) при некоторой температуре Кр=1. Определить состав (в процентах по объёму) равновесной реакционной смеси, если исходная смесь состояла из трёх молей водорода и двух молей брома.
Константа равновесия реакции А(г.)+В(г.)↔С(г.)+D(г.) равна единице. Сколько процентов вещества А подвергнется превращению, если смешать 3 моля вещества А и 5 молей вещества В.
После смешивания газов А и В в системе А(г.)+В(г.)↔С(г.)+D(г.) устанавливается равновесие при следующих концентрациях: [А]=0,05 моль/л, [С]=0,02 моль/л. Константа равновесия равна 4·10-2. Найти исходные концентрации веществ А и В.
Найти константу равновесия реакции N2О4↔2NО2, если начальная концентрация N2О4 составляла 0,08 моль/л, а к моменту наступления равновесия диссоциировало 50% молекул N2О4.
В каком направлении сместятся равновесия 2Н2(г.)+О2(г.)↔2Н2О(г.), ΔН0= -483,6 кДж СаСО3(к.)↔СаО(к.)+СО2(г.) ΔН0= 179 кДж а) при повышении давления; б) при повышении температуры. Ответ обосновать.
В каком направлении сместятся равновесия 2СО(г.)+О2(г.)↔2СО2(г.), ΔН0= -556 кДж N2(г.)+О2(г.)↔2NО(г.) ΔН0= 180 кДж а) при понижении температуры; б) при повышении давления. Ответ обосновать.
Пользуясь табличными данными, вычислить константы равновесия следующей реакции при 298 К и при 1000К. СО(г.)+Н2О(г.)↔СО2(г.)+Н2 (г.)
Вычислить температуру, при которой константа равновесия реакции 2NО2(г.)↔N2О4(г.) равна единице. В каком направлении сместится равновесие при температуре более низкой, чем найденная.
Стандартное изменение энергии Гиббса для реакции А+В↔АВ при 298 К равно –8 кДж/моль. Начальные концентрации веществ А и В равны 1 моль/л. Найти константу равновесия и концентрации веществ А, В и АВ.
