
- •Химические реакции метана
- •I. Электрофильное присоединение по двойной связи
- •II. Радикальное гидробромирование алкенов (эффект Хараша)
- •Химические реакции непредельных углеводородов
- •Окисление алкенов без разрыва по двойной связи
- •Окисление алкенов с разрывом молекулы по двойной связи
- •Промышленное использование этилена
- •Полимеризация
- •Суммарное уравнение реакции:
- •Методы синтеза алкинов
- •Ацетилен нс≡сн, этин
- •Химические свойства бензола
- •I. Электрофильное замещение
- •2) Бромирование изопропилбензола
- •Реакции электрофильного замещения (se) в бензоле
- •Правило ориентации в реакциях электрофильного замещения в ряду производных бензола
- •Правило ориентации в реакциях электрофильного замещения в ряду производных нафталина
- •Химические реакции нафталина
- •Химические реакции антрацена и фенантрена
Лекция № 2
АЛКАНЫ И ЦИКЛОАЛКАНЫ
Химические реакции метана

Лекция № 2
АЛКЕНЫ, ДИЕНЫ
НОМЕНКЛАТУРА ГЕОМЕТРИЧЕСКИХ ИЗОМЕРОВ
Цис-транс-номенклатура
Цис-изомеры – геометрические изомеры, в которых заместители, образующие главную углеродную цепь в молекуле вещества, расположены по одну сторону относительно двойной связи (или плоскости цикла).
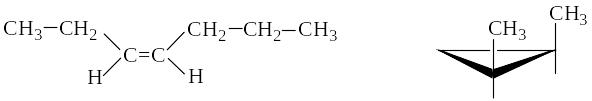
цис-гептен-3 цис-1,2-диметилциклопропан
Транс-изомеры – геометрические изомеры, в которых заместители, образующие главную углеродную цепь в молекуле вещества, расположены по разные стороны относительно двойной связи (или плоскости цикла).

транс-2-метилгексен-3 транс-1,2-диметилциклопентан
Лекция № 2
I. Электрофильное присоединение по двойной связи
Гидробромирование бутена-1:
С2H5–CH=CH2 + HBr ─→ С2H5–CHBr–CH3
Механизм АЕ :
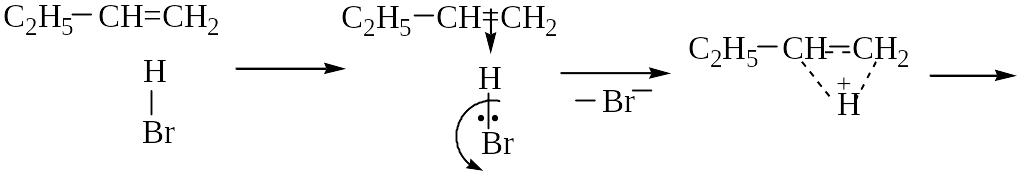
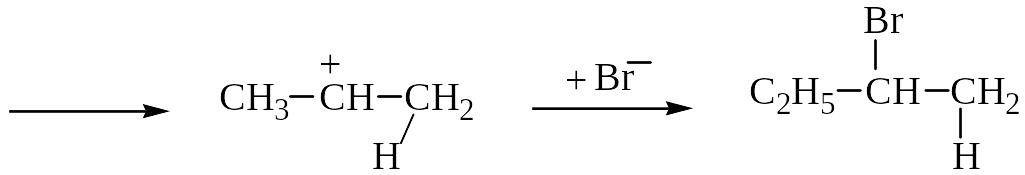
вторичный катион устойчивей, чем первичный СH3(CH2)2CH2+
Взаимодействие
несимметричного реагента![]() по двойной связи несимметричного алкена
(где RR"
водород или алкил) протекает по
правилу Марковникова:
катионная часть Х+
(обычно Н+)
присоединяется к более гидрогенизированному
атому углерода, а анионная часть Y
ко второму, менее гидрогенизированному
ненасыщенному С-атому:
по двойной связи несимметричного алкена
(где RR"
водород или алкил) протекает по
правилу Марковникова:
катионная часть Х+
(обычно Н+)
присоединяется к более гидрогенизированному
атому углерода, а анионная часть Y
ко второму, менее гидрогенизированному
ненасыщенному С-атому:

![]() Н Н
Н Н С1
Н Н
Н Н С1
![]() Br
C1
ОН OSO3H
ОН
Br
C1
ОН OSO3H
ОН
Лекция № 2
II. Радикальное гидробромирование алкенов (эффект Хараша)
Протекает в присутствии пероксидов протекает (механизм AR) :
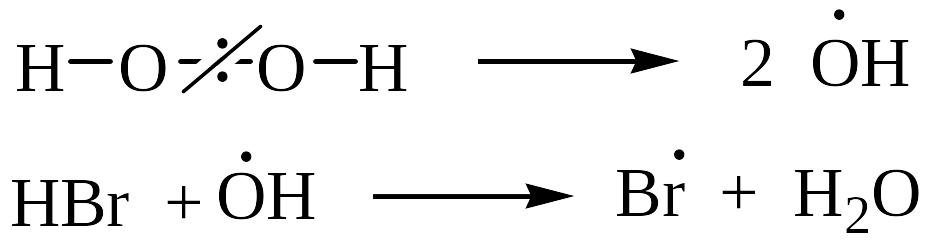
![]()
вторичный радикал более устойчив,
чем первичный радикал С2H5CHBrCH2.
![]()
Следует подчеркнуть, что только HBr присоединяется по механизму AR против правила Марковникова; остальные галогеноводороды не реагируют по пероксидному эффекту: HCl имеет слишком полярную связь и не расщепляется гомолитически, а HI сильный восстановитель и разрушает пероксиды.
Лекция № 2
Химические реакции непредельных углеводородов
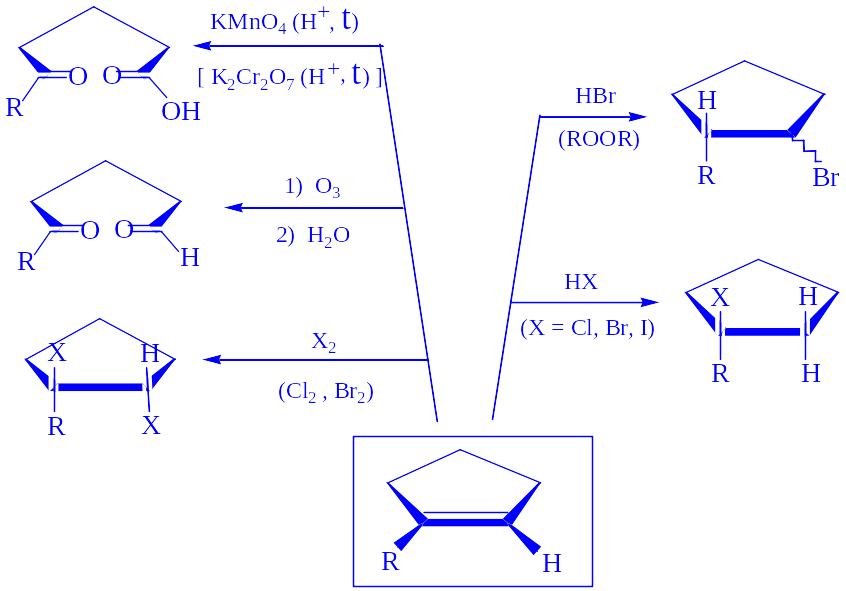

Лекция № 2
Окисление алкенов без разрыва по двойной связи
а) Окисление OsO4 (реакция Криге)
или разбавленным раствором КMnO4 при 10 0С (реакция Вагнера)


Механизм подтверждается тем, что при использовании иона MnO4, содержащего 18О, оба атома кислорода в образующемся
цис-гликоле (мезо-соединение) оказываются мечеными, т.е. оба происходят не из растворителя, а из перманганата.
б) Окисление кислородом (Ag; 3500C) или надкислотами


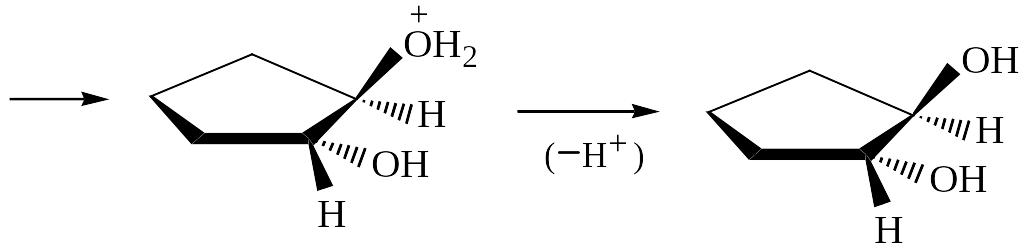
Поскольку атака циклического эпоксида осуществляется «сзади», происходит обращение конфигурации атакуемого атома углерода, что приводит к образованию транс-диола-1,2.
Лекция № 2
