
«МАТИ» - Российский государственный технологический университет имени К.Э.Циолковского
Кафедра «Технология производства двигателей летательных аппаратов»
Реферат
по дисциплине «ХИМИЯ»
Тема: «Титан (Ti)»
Выполнил: студент: Брысов Е.И. группа: 2ДЛА-1ДБ-252
Преподаватель: Евдокимов С. В.
Дата: 7 ноября 2012 г
Общая характеристика
Титан (Titanium, Ti)- это химический элемент IV группы периодической системы элементов Д. И. Менделеева. Порядковый номер 22, атомный вес 47,90. Состоит из 5 устойчивых изотопов.
Титан относится к числу наиболее распространённых в природе элементов, его содержание в земной коре составляет 0,6% (весовых). Встречается главным образом в виде двуокиси TiO2 или её соединений — титанатов. Известно свыше 60 минералов, в состав которых входит титан Он содержится также в почве, в животных и растительных организмах. Ильменит FeTiO3 и рутил TiO2 служат основным сырьём для получения титана.
Физические и химические свойства
Титан

Аморфный
Кристаллический



Аморфный
титан – это темно-серый порошок плотностью
~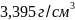 .
Кристаллический
титан имеет плотность
.
Кристаллический
титан имеет плотность
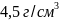 .
.

Титан — легкий серебристо-белый металл. Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей плёнкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Титановая пыль имеет свойство взрываться. Температура вспышки 400 °C. Титановая стружка пожароопасна.
Титан:
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также в тонкой стружке или проволоке титан пирофорен.
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF, H3PO4 и концентрированной H2SO4).
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2−.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанаты:
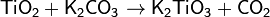
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных условиях — бесцветная жидкость, сильно дымящая на воздухе, что объясняется гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек HCl ивзвеси гидроксида титана.
Активно поглощает газы (водород, кислород, азот), которые делают его очень хрупким.
Добавление к кислотам окислителя предохраняет металл от коррозии при комнатной температуре. В соединениях проявляет валентность 2, 3 и 4.
Электронная формула титана имеет вид:1s2|2s22p6|3s23p63d2|4s2.
Порядковый номер титана в периодической системе химических элементов Д.И. Менделеева – 22. Номер элемента обозначает заряд ярда, следовательно у титана заряд ядра - +22, масса ядра – 47,87. Титан находится в четвертом периоде, в побочной подгруппе. Номер периода указывает на количество электронных слоев. Номер группы обозначает количество валентных электронов. Побочная подгруппа указывает на то, что титан относится к d-элементам.
Титан имеет два валентных электрона на s-орбитали внешнего слоя и два валентных электрона на d-орбитали предвнешнего слоя.
Квантовые числа для каждого валентного электрона:
|
3d1 |
3d2 |
4s1 |
4s2 |
N |
3 |
3 |
4 |
4 |
l |
2 |
2 |
0 |
0 |
ml |
-2 |
-1 |
0 |
0 |
ms |
+1/2 |
+1/2 |
+1/2 |
-1/2 |
С галогенами и водородом Ti(IV) образует соединения вида TiX4, имеющие sp3→q4 вид гибридизации.
Титан – металл. Является первым элементом d-группы. Наиболее устойчивым и распространенным является Ti+4. Так же существуют соединения с более низкими степенями окисления – Ti0, Ti-1, Ti+2, Ti+3, но эти соединения легко окисляются воздухом, водой или другими реагентами в Ti+4. Отрыв четырех электронов требует больших затрат энергии, поэтому ион Ti+4 реально не существует и соединения Ti(IV) обычно включают связи ковалентного характера. Ti(IV) в некоторых отношениях сходен с элементами – Si, Ge, Sn и Pb, особенно с Sn.
