
12.Атомное ядро
12.1. Состав и характеристика атомного ядра
Ядра атомов состоят из двух видов элементарных частиц - протонов и нейтронов. Эти частицы носят название нуклонов.
Протон.
Протон
(р)
– это ядро атома водорода. Он обладает
зарядом
+е
и массой
![]() =938,2
МэВ (
масса электрона, выраженная в единицах
энергии, составляет
=938,2
МэВ (
масса электрона, выраженная в единицах
энергии, составляет
![]() =0,511
МэВ). Таким
обр.,
=0,511
МэВ). Таким
обр.,![]() = 1836
= 1836
![]() .
.
Протон имеет спин, равный s = 1/2), и собственный магнитный момент
![]() ,
,
Где
![]() эрг/гаусс —
единица магнитного момента, называемая
ядерным магнетоном.
эрг/гаусс —
единица магнитного момента, называемая
ядерным магнетоном.
![]() в
1836 раз меньше магнетона Бора
в
1836 раз меньше магнетона Бора
![]() .
Следовательно, собственный
магнитный момент протона примерно в
660 раз меньше, чем магнитный момент
электрона.
.
Следовательно, собственный
магнитный момент протона примерно в
660 раз меньше, чем магнитный момент
электрона.
Нейтрон. Нейтроном (n) называется не обладающая электрическим зарядом частица с массой
![]() ,
,
очень
близкой к массе протона. Разность масс
нейтрона и протона mn — гпр составляет
1,3 МэВ, т. е. 2,5
![]() .
.
Нейтрон
обладает спином, равным s =1/2, и (несмотря
на отсутствие электрического заряда)
собственным магнитным моментом
![]()
(знак минус указывает на то, что направления собственных механического и магнитного моментов противоположны).
В
свободном состоянии нейтрон нестабилен
(радиоактивен)— он самопроизвольно
распадается, превращаясь в протон и
испуская электрон (![]() )
и еще одну частицу, называемую антинейтрино
(
)
и еще одну частицу, называемую антинейтрино
(![]() )
. Период полураспада равен ~ 12
мин.
Схему распада можно записать следующим
образом:
)
. Период полураспада равен ~ 12
мин.
Схему распада можно записать следующим
образом:
![]()
Масса покоя антинейтрино равна нулю. Масса нейтрона, как мы видели, больше массы протона на 2,5 . Следовательно, масса нейтрона превышает суммарную массу частиц, фигурирующих в правой части уравнения, на 1,5 , т. е. на 0,77 МэВ. Эта энергия выделяется при распаде нейтрона в виде кинетической энергии образующихся частиц.
Характеристика атомного ядра. Количество протонов Z, входящих в состав ядра, определяет его заряд, который равен +Ze. Число Z называется атомным номером (оно определяет порядковый номер химического элемента в периодической таблице Менделеева) или зарядовым числом ядра.
Число нуклонов А (т. е. суммарное число протонов и нейтронов) в ядре называется массовым числом ядра. Число нейтронов в ядре равно N = A - Z.
Для
обозначения ядер применяется символ
![]() ,где
под X
подразумевается химический символ
данного элемента. Справа вверху ставится
массовое число, слева внизу — атомный
номер (последний значок часто опуcкается).
Большинство химических элементов имеет
по нескольку разновидностей —
изотопов, отличающихся значениями
массового числа А. Так, например, водород
имеет три изотопа:
Н1
—обычный водород, или протий (Z=1,
N
= 0), H2
—тяжелый водород, или дейтерий (Z
= 1, N
= 1), Н3-тритий
(Z=
1, N
= 2). Изотопы представляют собой ядра с
одинаковым числом протонов Z.
Ядра с одинаковым массовым числом А
называются изобарами. В качестве примера
можно привести
,где
под X
подразумевается химический символ
данного элемента. Справа вверху ставится
массовое число, слева внизу — атомный
номер (последний значок часто опуcкается).
Большинство химических элементов имеет
по нескольку разновидностей —
изотопов, отличающихся значениями
массового числа А. Так, например, водород
имеет три изотопа:
Н1
—обычный водород, или протий (Z=1,
N
= 0), H2
—тяжелый водород, или дейтерий (Z
= 1, N
= 1), Н3-тритий
(Z=
1, N
= 2). Изотопы представляют собой ядра с
одинаковым числом протонов Z.
Ядра с одинаковым массовым числом А
называются изобарами. В качестве примера
можно привести
![]() и
и
![]() .
Ядра с одинаковым числом нейтронов
N=A
—Z
носят название изотонов (
.
Ядра с одинаковым числом нейтронов
N=A
—Z
носят название изотонов (![]() ,
,![]() ).
Наконец, существуют радиоактивные ядра
с одинаковыми Z
и А,
отличающиеся периодом полураспада. Они
называются изомерами. Например, имеется
два изомера ядра
).
Наконец, существуют радиоактивные ядра
с одинаковыми Z
и А,
отличающиеся периодом полураспада. Они
называются изомерами. Например, имеется
два изомера ядра
![]() ,
у одного из них период полураспада равен
18 мин, у другого — 4,4 часа. Радиус ядра
довольно точно определяется формулой:
,
у одного из них период полураспада равен
18 мин, у другого — 4,4 часа. Радиус ядра
довольно точно определяется формулой:
![]() ферми
ферми
( 1ферми=
1ферми=
![]() см).
В настоящее время известно около 1500
ядер, различающихся Z, либо А, либо и
тем и другим. Около четверти
этих ядер устойчивы, остальные
радиоактивны. Многие ядра были получены
искусственным путем с помощью ядерных
реакций.
см).
В настоящее время известно около 1500
ядер, различающихся Z, либо А, либо и
тем и другим. Около четверти
этих ядер устойчивы, остальные
радиоактивны. Многие ядра были получены
искусственным путем с помощью ядерных
реакций.
В природе встречаются элементы с Z от 1 до 92, исключая технеции (Тс, Z = 43) и прометий (Pm, Z = 61). Плутоний (Pu, Z = 94) после получения его искусственным путем был обнаружен в ничтожных количествах в природном минерале — смоляной обманке. Остальные трансурановые (т. е. заурановые) элементы (с Z от 93 до 104) были получены только искусственным путем посредством различных ядерных реакций.
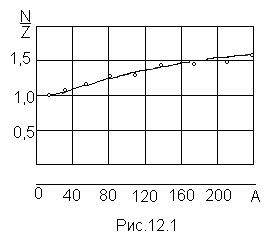
Для устойчивых ядер характерно определенное отношение числа нейтронов N к числу протонов Z. У легких ядер это отношение близко к единице. По мере увеличения числа нуклонов в ядре N/Z растет, достигая для урана значения 1,6 (рис. 12.1, на котором по оси абсцисс отложено массовое число А, по оси ординат — отношение N к Z; точки на рисунке соответствуют отдельным стабильным ядрам).
Спин ядра. Спины нуклонов складываются в результирующий спин ядра. Спин нуклона равен 1/2. Поэтому согласно квантовым законам сложения моментов квантовое число спина ядра I будет полуцелым при нечетном числе нуклонов А и целым или нулем при четном А. Спины ядер I не превышают нескольких единиц. Это указывает на то, что спины большинства нуклонов в ядре взаимно компенсируют друг друга, располагаясь антипараллельно. У всех четно-четных) ядер (т.е. ядер с четным числом протонов и четным числом нейтронов) спин равен нулю.
Результирующий
момент ядра
![]() складывается с моментом электронной
оболочки
складывается с моментом электронной
оболочки
![]() в полный момент импульса атома
в полный момент импульса атома![]() ,
который определяется квантовым числом
F.
,
который определяется квантовым числом
F.
С
механическими моментами связаны
магнитные моменты. Взаимодействие
магнитных моментов электронов и ядра
приводит к тому, что состояния атома,
соответствуюшие различным взаимным
ориентациям
,
и
(т. с. различным F),
имеют немного отличающуюся энергию.
Взаимодействием моментов
![]() и
и
![]() обусловливается тонкая структура
спектров. Взаимодействием
и
определяется сверхтонкая структура
атомных спектров. Расщепление спектральных
линий, соответствующее сверхтонкой
структуре, настолько мало (порядка
нескольких сотых ангстрема), что может
наблюдаться лишь с помощью приборов
самой высокой разрешающей силы.
обусловливается тонкая структура
спектров. Взаимодействием
и
определяется сверхтонкая структура
атомных спектров. Расщепление спектральных
линий, соответствующее сверхтонкой
структуре, настолько мало (порядка
нескольких сотых ангстрема), что может
наблюдаться лишь с помощью приборов
самой высокой разрешающей силы.
