
- •Иммунология. Часть I. Структура и функции иммунной системы
- •Глава 1. Основные представления
- •Глава 2
- •Глава 5. T–лимфоциты. Главный комплекс гистосовместимости
- •7.3.3.1. Хемокины
- •7.3.3.2. Рецепторы для цитокинов
- •7.3.3.3. Биологические свойства пар «цитокин — клетка–мишень»
- •Глава 9
- •Часть II. Иммунная система и патология
- •Аллергические болезни
- •Послесловие
- •Литература
- •Краткий словарь терминов
- •Иммунологические характеристики крови
Аллергические болезни
14.1. Определение терминов
Термин «аллергия» в 1906 г. ввел австрийский педиатр К. Пирке для обозначения состояний необычно повышенной реактивности у детей, которые он наблюдал иногда при инфекционных болезнях или при сывороточной болезни.
Allos — другой, иной, не такой как все. Синоним аллергии — реакции гиперчувствительности. Острое и сильно выраженное проявление гиперчувствительности называют ещё анафилаксией (anaphylaxis как противоположность prophylaxis). И если «профилактический» — защитный, то «анафилактический» — противоположный защитному, т.е. разрушающий. Суть аллергических реакций, позволяющая отличать их от других реакций, заключается в том, что они в принципе не защитные, так как развиваются равно как на биологически безопасные воздействия, так и на опасные, т.е. факт опасности воздействия не имеет никакого значения. Поэтому аллергия — всегда патология, защитного «смысла» в ней нет. Механизмы развития аллергических реакций — те же (но только с элементом патологии) эффекторные иммунные и доиммунные механизмы резистентности млекопитающих к воздействиям факторов внешней среды. При аллергии человек может смертельно задохнуться в ответ на попадание на его барьерные ткани минимальных количеств пыльцы берёзы или от запаха рыбы и др.
В 1930 г. Р. Кук классифицировал реакции гиперчувствительности на немедленные (развиваются в пределах 30 мин от момента воздействия) и замедленные (развиваются спустя 24–48 ч или позже после воздействия). Немедленные реакции — это гладкомышечные и сосудистые реакции: спазмы мускулатуры бронхов и ЖКТ, расширение сосудов, падение давления крови в сосудах, повышение проницаемости сосудистых стенок, выпот сыворотки или плазмы в ткани, увеличение секреции слизи на слизистые оболочки. Эти процессы вызваны «дружным» выбросом в участок тканей (местный процесс) или в кровь (системный процесс) биологически активных медиаторов из гранул тучных клеток и базофилов, что называют активацией и дегрануляцией тучных клеток и базофилов.
Как
известно, медиаторы тучных клеток и
базофилов делят на
4
группы — вазоактивные амины и
протеогликаны (гистамин, гепарин),
липидные медиаторы (лейкотриены,
простагландины, ФАТ), ферменты (триптаза,
химаза, карбоксипептидаза, катепсин
G),
цитокины (TNF–,
ИЛ–4, –13, –3, –5, GM–CSF).
На тучных клетках и базофилах есть
несколько видов иммунорецепторов —
Рц
для Fc–фрагментов
иммуноглобулинов. Среди них имеются
Рц, через которые клетки активируются,
и Рц, через которые активация клеток
подавляется. Активирующий иммунорецептор —
высокоаффинный Рц для IgE
(связывающий свободные IgE) —
FcRI:
перекрестное связывание этого Рц через
IgE–АТ
Аг вызывает дегрануляцию тучных клеток
и базофилов. Однако есть и другие факторы,
способные вызвать дегрануляцию без
участия IgE
и Аг. С точки зрения «чистой» иммунологии,
дегрануляция тучных клеток по любому
механизму удовлетворяет понятию
«аллергия», если порог раздражения у
конкретного человека много ниже, чем у
большинства людей. Но в классической
аллергологии антигензависимую
дегрануляцию тучных клеток и базофилов
и патофизиологические последствия
этого принято называть истинной
аллергией, а антигеннезависимую
дегрануляцию с теми же патофизиологическими
последствиями псевдоаллергией. Будем
придерживаться этого деления. Есть ещё
один термин, который следует определить
без разночтений:
Атопия — IgE–опосредованная аллергия.
Факторы, приводящие к дегрануляции тучных клеток и базофилов, приведены в табл. 14.1.
Таблица 14.1. Факторы активации и дегрануляции тучных клеток и базофилов
При истинной аллергии (IgE–oпoсредованной) |
При псевдоаллергиях (IgE–независимая) |
Перекрестная
сшивка Fc |
1.
Перекрестная сшивка Fc |
|
2.
Перекрестная сшивка Fc |
|
3. Вещество P |
|
4. Продукты деградации коллагена |
|
5. Хемокины (ИЛ–8, MCP–1, MIP–1a, RANTES) |
|
6. Цитокины (ИЛ–3, GM–CSF) |
|
7. Продукты активированного комплемента — анафилотоксины — C5a, C3a |
|
8. ЛС (опиаты, ацетилсалициловая кислота, НПВС, цитостатики, радиоконтрастные вещества) |
|
9. Физические факторы (физические нагрузки, переохлаждение, инсоляция) |
Хотя в некоторых контекстах термины «аллерген» и «Аг» — синонимы по сути, следует иметь в виду, что на практике любой аллерген — это Аг, но не наоборот: не всякий Аг — аллерген. Это означает, что аллергены отличаются некими особыми физическими и химическими свойствами, а также особенностями поступления в организм, т.е. аллергены — как бы подмножество во множестве Аг вообще. Если аллергены — белки, то чаще всего это ферменты протеазы. Аллергены имеют относительно невысокую молекулярную массу, способны сорбироваться или агрегироваться в мелкие частицы и в таком виде проникать (диффундировать) в слизистые секреты и покровные ткани, без видимого травмирования покровных тканей. При этом аллергены хорошо растворимы и легко элюируются в жидкие среды организма. Аллергены отличаются химической стабильностью in vivo (не метаболизируются, по крайней мере быстро). Если аллергены — не белки, то их отличает способность вступать в химические соединения с собственными белками организма.
Аллергены проявляют своё действие в крайне малых дозах. Например, патогенно значимая суммарная доза аллергенов амброзии может составлять всего 1 мкг за год.
14.2. Аллергены
Аллергены классифицируют по разным принципам. В практической клинической работе удобно группировать их либо по происхождению (аллергены пыльцы растений, яды насекомых, эпидермис или выделения животных, пищевых продуктов, ЛС и т.п.), либо по «входным воротам» поступления в организм (ингаляционные или аэроаллергены, контактные, пероральные), либо по встречаемости в тех или иных условиях (бытовые, профессиональные) и т.п.
Перечислим вещества из разных химических групп, на которые у людей чаще, чем на другие развиваются аллергические реакции:
Белки
Пищевые компоненты (яйца, молоко, орехи, ракообразные, моллюски, бобовые)
Яды пчёл, ос
Компоненты вакцин (кори, гриппа, столбнячного токсоида)
Гормоны (инсулин, АКТГ, ТТГ)
Сыворотки и препараты крови
Ферментные препараты (стрептокиназа)
Латекс (хирургические перчатки, эндотрахеальные трубки, презервативы и др.)
Белковые компоненты клещей домашней пыли, пыльцы трав и деревьев, выделений животных
Гаптены
Антибиотики (пенициллины, цефалоспорины)
Миорелаксанты
Витамины (тиамин и др.)
Цитостатики (цисплатин, циклофосфамид, цитарабин)
Опиаты
Полисахариды
Декстраны
Декстран–железо
14.3. Замедленные реакции гиперчувствительности
Замедленные реакции гиперчувствительности — это иммунное воспаление по любому другому эффекторному механизму, кроме «IgE/тучные клетки или базофилы» [ГЗТ (Th1/макрофаги); ЦТЛ (CD8+); АЗКЦТ и др.] (типы II, III и IV по Джеллу и Ваксману), при котором интенсивность воспалительного и деструктивного процесса неадекватна биологической опасности и дозе аллергена. Замедленность означает, что патологический процесс развивается в течение от суток до нескольких десятков суток после попадания аллергена в организм.
14.4. Эпидемиология аллергических болезней
Как любой иммунный ответ, аллергический иммунный ответ — это взаимодействие внешнего аллергена и внутренних факторов организма. Медицинская статистика во всем мире показывает необыкновенно большое возрастание частоты встречаемости аллергических болезней во второй половине XX в. по сравнению с первой половиной и предыдущими периодами. В западных странах количество больных аллергиями в настоящее время составляет в среднем 20% всего населения, местами — до 40–50%. Существенно меньше таких больных (единицы процентов) в сообществах, ведущих более «первобытный» образ жизни. Такая быстрая динамика прироста числа больных аллергиями определённо свидетельствует, что в этиологии аллергий имеет значение не генетическая предрасположенность как таковая, ибо геном человека за менее чем 100 лет не изменился, а быстро нарастающее несоответствие физиологической нормы реакции биологического вида Homo sapiens факторам внешней среды, очевидно антропогенным. Причём проблема не только в загрязнениях окружающей среды неоантигенами. Для современных больных аллергией вполне аллергены пыльца берёзы, тимофеевки, эпителий кошки — их не отнесешь к экологически новым. Проблемы образа жизни современных людей (особенно в городах) глубоки и многофакторны. Достоверная научная эпидемиология аллергических болезней чётко показывает, что людям как обществу, чтобы меньше болеть, необходимо не столько делать новые лекарства (а перед этим «наживать» новые болезни), сколько познать законы своего существования в согласии с природой и следовать им, а не нарушать с безумным и массовым упорством.
Недавние исследования по эпидемиологии аллергических болезней в сочетании с исследованиями в области молекулярной иммунологии дали довольно неожиданные результаты. Например, получены данные о количественных закономерностях индукции иммунного ответа в виде синтеза IgE на гельминтные инфекции. Концентрация IgE в крови на пике ответа в среднем едва достигает 30 мкг/мл, что на порядок с лишним меньше концентрации самого малочисленного из подклассов IgG — G4 (его концентрации в сыворотке составляют 600–700 мкг/мл). Но относительно исходных фоновых концентраций прирост IgE составляет не менее двух порядков (а то и три), что значительно больше, чем для любого из подклассов G. Самое интересное, что природное место основной массы IgE не в крови (в крови остаётся менее 1% синтезированного IgE): более 99% IgE организм секретирует через эпителий ЖКТ в просвет кишки. Просвет кишки — типичное место большинства известных гельминтных инвазий.
Зоологам известно, что у позвоночных животных гельминтные инфекции являются самым сильнодействующим внешним фактором, контролирующим численность и ареалы обитания популяций животных. Вероятно, гельминтные инфекции — мощный фактор естественного отбора защитных структур и функций в иммунной системе позвоночных. И человек по своей природе вряд ли имеет основания быть исключением. Эпидемиологические исследования показали, что у людей прослеживается сильная обратная корреляция между гельминтозами и аллергическими болезнями — чем меньше гельминтозов, тем больше аллергических болезней. Исследования проводили в экологически однородных регионах, но на группах населения, ведущих значительно различающийся образ жизни (разные социальные слои).
В Венесуэле, в одной стране, на одном экологическом фоне обследовали группу богатых и образованных людей, ведущих санированный образ жизни, и группу аборигенов, ведущих антисанитарный образ жизни. Среди «антисанитарных» аборигенов гельминтозы выявлены у 88% обследованных (у детей тотально), средний уровень общего IgE в сыворотке крови у них составил 13 тыс. ME/мл, но при этом аллергические болезни в этой группе выявлены менее чем у 2% человек. Другая картина у богатых и образованных сограждан: гельминтозы обнаружены менее чем у 10% человек, средний уровень общего IgE в сыворотке крови 370 ME/мл, аллергические болезни — у 43% человек. Исследование проводили специалисты из США в течение 5 лет, предполагать гипо- или гипердиагностику аллергий нет оснований. Сходную картину выявили при сравнительном обследовании цивилизованных жителей западной Австралии и живущих неподалеку аборигенов из Папуа Новая Гвинея. Среди западных австралийцев бронхиальная астма обнаружена у 28% взрослого населения и у 7% детей, среди аборигенов Папуа у взрослых — у 0,3% населения, у детей астмы не нашли. Из этого ни в коем случае не следует, что для профилактики аллергий детей надо заражать гельминтозами. Но эти данные свидетельствуют об очень большом значении внешних факторов среды и образа жизни для онтогенеза иммунной системы в постнатальном периоде. Естественно приобретаемые гельминтозы в детстве обеспечивают такое развитие пропорций в субпопуляциях лимфоцитов, которое на всю оставшуюся жизнь предохраняет организм, например от аллергий. Конечно, гельминтозы — не единственный фактор, программирующий постнатальное развитие иммунной системы, но это лишь пример, иллюстрирующий более общую «гигиеническую гипотезу» (изменение характера питания цивилизованных людей в сторону использования очищенных, стерилизованных и консервированных продуктов, широкое применение антибиотиков, соответственно — неизбежное изменение микробов кишечника и т.д.).
Приведём примеры реакций (и соответствующих нозологий) гиперчувствительности немедленного и замедленного типов (табл. 14.2; 14.3).
Таблица 14.2. Примеры IgE–опосредованных аллергических болезней
Синдром |
Типичные аллергены |
Пути поступления аллергенов в организм |
Типичные клинические симптомы |
Системная анафилаксия (анафилактический шок) |
Продукты крови (сыворотка), ЛС, яды, пищевые продукты. Ужаления насекомых |
Парентерально или быстрая абсорбция со слизистых оболочек |
Расширение сосудов (коллапс), повышение проницаемости сосудов (отёки), окклюзия трахеи и бронхо-спазм, спазм гладкой мускулатуры ЖКТ. Высока вероятность летального исхода |
Крапивница |
Внутрикожное введение разных аллергенов, пищевые продукты |
Внутрикожно, подкожно, перорально |
Волдыри и покраснение кожи в результате локального увеличения проницаемости сосудов и кровотока в участках кожи |
Аллергический ринит (сенная лихорадка) или риноконъюктивит |
Пыльца растений, аллергены клещей домашней пыли |
Ингаляционно |
Отёк, раздражение слизистой оболочки носа (заложенность и зуд), экссудация жидкости (ринорея) |
Бронхиальная астма |
Пыльца растений, аллергены пыли и другие аэроаллергены, иногда пищевые и иные |
Ингаляционно |
Воспаление дыхательных путей, бронхоспазм, усиление слизистой секреции в бронхах |
Атопический дерматит |
Аллергены клещей домашней пыли, микроскопических грибов, пищевые |
Через кожу и слизистые оболочки |
Хронический воспалительный процесс в коже, сопровождаемый зудом |
Пищевая аллергия |
Аллергены различных пищевых продуктов |
Перорально |
Тошнота, диарея, зуд кожи, крапивница (сыпь), анафилаксия |
Таблица 14.3. Примеры реакций гиперчувствительности с разными механизмами повреждения тканей
|
Механизм повреждения тканей |
||||
|
тип I |
тип II |
тип III |
тип IV |
|
|
IgE |
IgG |
IgG |
Тh1 |
CD8+ ЦТЛ |
Тип аллергенов |
Растворимые |
Ассоциированные с мембранами клеток или с матриксным веществом |
Растворимые |
Растворимые |
Клеточные |
Исполнители эффекторных реакций |
Тучные клетки и базофилы |
Комплемент;
Fc |
Комплемент; нейтрофилы; макрофаги |
Активированные макрофаги (ГЗТ) |
ЦТЛ |
Примеры |
Системная анафилаксия; аллергический ринит; аллергическая астма |
Аллергические реакции на некоторые ЛС (пенициллины) |
Сывороточная болезнь; реакция Артюса |
Контактный дерматит |
Контактный дерматит; синдромы Стивенса–Джонсона и Лайелла |
Кратко опишем аллергический ринит, бронхиальную астму, системную анафилаксию, крапивницу, атопический дерматит и синдромы эпидермального некролиза (как осложнения при приёме ЛС).
14.5. Аллергический ринит
Аллергический ринит — воспалительное заболевание слизистой оболочки носа. Патогенез атопический, т.е. в нем участвуют IgE и медиаторы тучных клеток. IgE специфичны к тем или иным ингаляционным аллергенам. Чаще всего причинными бывают аллергены пыльцы трав и деревьев (сезонный ринит — компонент сенной лихорадки), но бывают и аллергены домашней пыли, споры грибов и др. (при ринитах круглогодичного течения). Клинические симптомы: заложенность носа вследствие отёка слизистой, зуд, ринорея. Дифференциальный диагноз аллергического ринита в отличие от риновирусного или иного ринита инфекционной этиологии помогают поставить лабораторные анализы на содержание триптазы тучных клеток в носовом секрете и обнаружение аллерген–специфических АТ класса E в сыворотке крови.
Лечение. В случае точного выявления причинного(ых) аллергена(ов) эффективное и долгосрочное лечение состоит в курсах иммунизации причинным аллергеном — специфической иммунотерапии (СИТ) в периоды ремиссии. Для купирования острых симптомов патогенетически обоснованная медикаментозная терапия заключается в назначении антигистаминных препаратов, сосудосуживающих капель в нос, препаратов кромоглициевой кислоты, топических (назальных) ГКС.
14.6. Бронхиальная астма
Суть заболевания заключается в хроническом воспалении слизистой оболочки дыхательных путей с синдромом гиперреактивности бронхов. Определяющие клинические симптомы: кашель, «свистящее» дыхание, затрудненный выдох, поверхностное дыхание, возможны диспноэ, потеря голоса, цианоз, синкопальные состояния от физических нагрузок (как следствие гипоксии). Вспомним, что без кислорода мозг может жить малое количество минут, поэтому заболевание, приводящее к затрудненному дыханию, весьма серьёзно.
Дифференциальный диагноз требует исключения опухолей в крупных дыхательных путях, попадания туда инородного тела (в том числе пищи при гастроэзофагальной аспирации), недостаточности левого желудочка сердца, рекуррентных эмболий малых сосудов лёгких, васкулита (Чёрджа–Стросс).
Если ни пациенту, ни врачам не удаётся выявить внешние этиологические факторы астмы, то её классифицируют как идиопатическую или эндогенную. В большинстве случаев, однако, бронхиальная астма имеет выявляемые внешние этиологические факторы, в том числе и аллергическая бронхиальная астма. При аллергической бронхиальной астме наиболее частыми причинными аллергенами являются аэроаллергены, поступающие в организм через дыхательные пути (пыльцевые, пылевые, эпидермальные), но бывают и пищевые или иные. При этом этиологическими кофакторами часто служат вирусные инфекции, тропные к эпителию дыхательных путей (рино- и коронавирусные). Большую кофакторную роль могут играть профессиональные факторы воздействия на органы дыхания (мучная и древесная пыль, соли платины, карбид вольфрама, смолы, изоцианаты и др.).
При любой этиологии астмы патоморфологическая картина воспалительного процесса в дыхательных путях сходна: обструкция мелкокалиберных дыхательных путей слизью, содержащей фибрин и эозинофилы; эпителий бронхов истончен и слущивается в просвет воздухопроводящих путей; базальная мембрана тоже истончена; в субэпителиальном слое фиброз; слизистая оболочка в целом отечна, кровеносные сосуды расширены; в тканях выраженный клеточный инфильтрат из эозинофилов, T–лимфоцитов и нейтрофилов. Состояние эозинофилов своеобразно: они не только активированы, но и разрушаются цитолизом с высвобождением кластеров свободных гранул эозинофилов. Существенным патоморфологическим процессом в стенке дыхательных путей при бронхиальной астме является выраженная экссудация белков плазмы из сосудов микроциркуляторного русла. Для всех форм заболевания характерно повышение неспецифической реактивности бронхов, выражающееся в том, что приступ обструкции дыхательных путей может возникнуть в ответ на разные раздражители типа холодного воздуха, неорганической пыли, табачного дыма, запахов парфюмерии, красок и т.п.
Рассмотрим патогенез аллергической бронхиальной астмы. За последнее время он более или менее изучен, открытым остаётся всё тот же вопрос о первичных причинах начала болезни (почему пыльца берёзы или мятлика, например, для данного человека так вредоносна?).
Механизм
развития хронического воспалительного
процесса в дыхательных путях при
атопической бронхиальной астме состоит
в патологической продукции
аллерген–специфических IgE
(по неизвестным причинам), фиксации их
в тканях слизистой оболочки дыхательных
путей и индукции там иммунного воспаления
с участием тучных клеток и эозинофилов,
поддерживаемого так долго (или с такой
периодичностью), как продолжается (или
возобновляется) поступление в дыхательные
пути специфического аллергена(ов). При
попадании специфического аллергена в
дыхательные пути у больного развивается
либо только однофазная ранняя реакция
бронхоспазма, которая заметна уже через
5–10 мин (с пиком через 15–20 мин) от момента
попадания аллергена в дыхательные пути
(ОРФ — ответ ранней фазы), либо, кроме
ОРФ, через 3–9 ч (с пиком в среднем на 5-м
часу) развивается ещё ответ поздней
фазы (ОПФ). ОРФ разрешается через 1–2 ч.
ОПФ продолжается от нескольких часов
до нескольких суток. В отличие от ОРФ
ОПФ объясняется не спазмом крупных
дыхательных путей, а закупоркой множества
мелких дыхательных путей. Наличие ОПФ
свидетельствует о более тяжёлой
клинической форме бронхиальной астмы,
чем в случаях, когда есть только ОРФ.
Механизмы развития ОРФ и ОПФ зависят
от аллерген–специфических IgE
и тучных клеток. Только ОРФ — результат
действия медиаторов гранул тучных
клеток, выбрасываемых немедленно после
связывания аллергена с IgE
на FcRI,
в первую очередь гистамина. ОПФ —
результат действия медиаторов тех же
активированных тучных клеток, но других
медиаторов, для синтеза и секреции
которых требуется несколько часов, —
метаболитов арахидоновой кислоты
(лейкотриены, простагландины, ФАТ) и
цитокинов (ИЛ–4, –13, –8, –1, –5, –6 и –3;
TNF;
GM–CSF).
Липидные медиаторы ответственны за
длительную обструкцию дыхательных
путей за счёт как бронхоспазма, так и
повышенного отделения слизи. Цитокины
ответственны за хемотаксис, экстравазацию,
активацию лимфоцитов (в первую очередь
Th2), эозинофилов и нейтрофилов (табл.
14.4).
Таблица 14.4. Относительный вклад отдельных медиаторов тучных клеток в формирование патологических симптомов приступа бронхиальной астмы
Симптом |
Медиаторы |
|||
|
Гис |
Лейкотриены |
ФАТ |
Пг |
Бронхоконстрикция |
+++ |
LTD4 >LTC4 >LTE4 |
|
ПгD2; ПгF2 |
Отёк слизистой |
+++ |
LTC4, LTD4 |
++ |
ПгE2 |
Секреция слизи |
— |
LTC4, LTD4 |
++ |
— |
Хемотаксис и активация лимфоцитов и лейкоцитов в тканях дыхательных путей |
|
LTE4 |
++++ |
|
Повышение неспецифической реактивности бронхов |
|
LTB4, кратковременно |
+++ |
ПгD2, не более 30 мин |
Примечания. LT — лейкотриен, ФАТ — фактор активации тромбоцитов, Пг — простагландин, Гис — гистамин
Лейкотриены LTD4, LTC4 и LTE4 в совокупности патофизиологи называют медленно реагирующей субстанцией анафилаксии.
Чтобы в дальнейшем были понятны точки приложения ЛС, приведём основные биохимические пути синтеза липидных медиаторов тучных клеток.
Из фосфолипидов мембран клетки под катализом фосфолипазы А2 образуется арахидоновая кислота. Из нее как из субстрата под катализом разных ферментов образуются разные продукты: под катализом 5–липооксигеназы — LTA4. Из LTA4 под катализом LTA4–гидролазы образуется LTB4, а под катализом LТС4–синтетазы — LTC4, LTD4 и LTE4. Под катализом циклооксигеназы из той же арахидоновой кислоты образуются простагландины.
LTB4 является весьма сильным хемоаттрактантом для нейтрофилов и эозинофилов.
В
патогенезе бронхиальной астмы эозинофилам
принадлежит особая роль как
клеткам–эффекторам деструкции тканей.
ИЛ–5, GM–CSF
и ИЛ–3, продуцируемые в повышенных
количествах у больных Т4–лимфоцитами
и активированными тучными клетками,
являются активаторами как эозинофилопоэза
в костном мозге, так и зрелых эозинофилов
на месте — в тканях дыхательных
путей. Активированные эозинофилы,
продуцируют и секретируют по сигналу
с IgE
на FcRII
несколько высокотоксичных белков (КБЭ,
ГБЭО, пероксидазу эозинофилов), а также
LTC4.
Кроме того, пероксидаза эозинофилов
катализирует образование супероксидного
аниона и пероксида водорода, а также
гипохлорной кислоты. Эозинофилы
секретируют эти метаболиты в своё
микроокружение, что в совокупности
вызывает повреждение тканей, в том числе
гибель эпителия. Кроме того, стимулированные
ИЛ–4 Т4–лимфоциты начинают вырабатывать
повышенные количества ИФН,
что стимулирует миофибробласты к
пролиферации и продукции коллагенов
типов III
и V
в интерстициальных пространствах под
базальной мембраной. В результате
нарушается водно–солевой обмен и
эластичность воздухопроводящих путей.
Диагноз аллергической бронхиальной астмы ставят по совокупности данных анамнеза, физикально выявляемым симптомам, по данным лабораторного анализа на аллерген–специфические IgE или/и кожных проб с предполагаемыми аллергенами, инструментального обследования параметров функции внешнего дыхания (патогномонично для бронхиальной астмы уменьшение значения объёма форсированного выдоха за первую секунду — ОФВ1). Подозрение именно на аллергическую этиологию бронхиальной астмы возникает, если у пациента уже есть диагноз других проявлений атопии, в первую очередь аллергического ринита.
Лечение. Программа лечения складывается из 4 основных направлений:
элиминационные
мероприятия — устранение насколько
это возможно или снижение воздействия
аллергена, если его удалось выявить;
медикаментозное
лечение, направленное на улучшение
функции внешнего дыхания (купирование
острых приступов бронхоспазма и их
профилактика), снижение неспецифической
реактивности бронхов за счёт направленной
интенсивной противовоспалительной
терапии в отношении дыхательных путей;
аллерген–специфическая
иммунотерапия (АСИТ) в периоды ремиссии;
активная
просветительская работа врачей с
пациентом с целью выработки у него
понимания необходимости строгого
самоконтроля
за
своим поведением (избегание контактов
с аллергеном, а также с неспецифическими
факторами раздражения бронхов (холодный
воздух, табачный дым, острые запахи,
запыленность и т.д.). Поскольку заболевание
бронхиальной астмой чревато смертельным
приступом удушья, у каждого больного в
сознании и на бумаге должен быть
разработанный врачом план экстренных
мер по спасению жизни (кризиc–план),
которые можно попытаться реализовать
вне стационара (там, где случится
приступ).
Конкретная программа медикаментозного лечения зависит от реального состояния больного: приступ или межприступный период, частота наступления приступов, тяжесть их протекания, клиническая картина в межприступный период, возраст больного, длительность развития заболевания, сопутствующие заболевания.
Если
больной поступил в состоянии приступа
астмы, то купирование бронхоспазма
осуществляют средствами неотложной
помощи — симпатомиметики, 2–aгoнисты
быстрого действия, метилксантины
быстрого действия, холинолитики, ГКС.
При тяжёлых и среднетяжёлых приступах
применяют препараты для парентерального
введения. При приступах лёгкого течения
используют ингаляторные или пероральные
формы препаратов.
Бронходилататоры —
средства симптоматической терапии. К
ним относят 2–агонисты
[сальбутамол,
салметерол,
формотерол,
фенотерол
и др.] — препараты, действующие
непосредственно на 2–Рц
гладких мышц, вызывая их расслабление
и, следовательно, бронходилатацию.
Эффект наступает уже через 10 мин,
достигает максимума через 2 ч, продолжается
6–12 ч (в зависимости от формы препарата
и индивидуального ответа организма).
Побочные эффекты, типичные для 2–агонистов
и серьёзные, — это гипокалиемия,
тремор, тахикардия, возможна сердечная
аритмия. При назначении 2–агонистов
рекомендуют соблюдать следующие правила:
1) монотерапия не показана, за исключением случаев единичных приступов с нормальными показателями функции внешнего дыхания вне приступа;
2) показано сочетание с топическими ГКС.
2–агонисты
для применения per
os
(bambuterol)
являются компонентом «кризиc–плана»
и их рекомендуют для попытки прерывания
внезапно возникшего приступа.
Метилксантины — теофиллин, аминофиллин — проявляют бронхорасширяющее действие, усиливают мукоцилиарный клиренс бронхов, улучшают до некоторой степени сократительную способность ослабленных воспалением мышц бронхов, но имеют выраженные побочные эффекты (раздражение ЦНС, гипотензия, тахикардия, аритмия сердца). Тем не менее в остром приступе астмы иногда применяют внутривенно аминофиллин.
Теофиллин
пролонгированного действия (капсулы
ретард) иногда назначают в схеме
поддерживающей терапии у пациентов, у
которых проявились побочные эффекты
2–агонистов.
Эпинефрин (адреналин) не является средством поддерживающей терапии при бронхиальной астме, но как при всех аллергических заболеваниях, он служит средством спасения жизни в случае острого состояния с угрозой для жизни или явлениями системной анафилаксии. Если процесс развития анафилаксии пошел, то адреналин начинают вводить внутримышечно по 0,5 мл раствора 1:1000 каждые 30 мин под контролем основных симптомов общего состояния (АД, явлений бронхоспазма, отёков, спазма гладкой мускулатуры ЖКТ и др.).
Таким
образом, аптечка кризиc–плана больного
астмой должна содержать как минимум:
адреналин, преднизолон,
2–агонисты
адренорецепторов и плюс индивидуально
для каждого пациента совместимые
препараты для коррекции сопутствующих
заболеваний, если таковые имеются. Кроме
того, больному следует иметь при себе
информацию (например, в виде браслета)
о своём заболевании и кризиc–план.
В межприступный период назначают базисную противовоспалительную терапию, состав ЛС и длительность курсов зависят от степени тяжести заболевания (тяжёлое, среднетяжёлое, лёгкое), ответа организма пациента на различные препараты, от анамнеза.
Противовоспалительная терапия. В качестве противовоспалительных препаратов при бронхиальной астме применяют глюкокортикоиды, кромоглициевую кислоту, антилейкотриеновые препараты. Учитывая серьёзность побочных эффектов глюкокортикоидов, решение об их назначении принимают, лишь убедившись в недостаточной эффективности негормональных препаратов. Желательно решать вопрос о назначении глюкокортикоидов и подбирать минимальные эффективные дозы под контролем содержания в крови пациента эозинофильного катионного белка — единственного в настоящее время маркёра интенсивности эозинофильного воспалительного процесса в тканях. Нечасто, но бывают случаи стероидрезистентной бронхиальной астмы. Они представляют бoльшую проблему для лечения, чем случаи, купируемые ГКС. ГКС давно известны своим противовоспалительным действием. Чтобы дифференцировать случаи стероидрезистентной астмы (если возникли такие подозрения), назначают 2–недельный курс преднизолона перорально: при стероидчувствительной форме наступает видимое улучшение. В последние годы для основного курса лечения применяют ингаляторные лекарственные формы ГКС (топические), например беклометазон, будесонид, флутиказон. Однако не следует забывать, что и топические ГКС всасываются со слизистых оболочек и при дозах 1600–2000 мкг в день при длительном применении могут вызывать типичные побочные эффекты (остеопороз, истончение кожи, задержку роста у детей и др.). Поддерживающую терапию топическими ГКС обычно проводят дозами 200–600 мкг в сутки в пересчёте на беклометазон. Эффект оценивают по объёму форсированного выдоха и уровню неспецифической реактивности бронхов. Иногда непрерывный курс ГКС продолжают до 6 мес в году, в тяжёлых случаях — перманентно. В острой ситуации приступа или в тяжёлых хронических случаях назначают перорально преднизолон в дозе 30–40 мг в течение 5 дней с постепенным уменьшением доз в последующие 10 дней до минимальных клинически значимых (10–20 мг, лучше 7,5 мг). Клинический ответ на ударную дозу преднизолона должен проявиться уже через 2 часа и достигнуть максимума примерно через 16 ч. Такая доза перорально входит в кризиc–план. Краткосрочная пероральная терапия преднизолоном вызывает незначительные побочные эффекты (задержка жидкости в организме, головная боль) и не всегда.
Антихолинергический
препарат —
ипратропия
бромид —
относительно избирательно действует
(снижает тонус) на ветви блуждающего
нерва, иннервирующие дыхательные пути,
синергичен с 2–агонистами
в отношении эффекта бронходилатации.
Показан в сочетании с топическими ГКС
больным с признаками повышенного
отделения слизи в дыхательные пути и
мучительным кашлем. Во время острого
приступа астмы ипратропия бромид (500
мкг в аэрозольной форме, каждые 4 ч)
добавляют к 2–агонистам
до снятия приступа.
В щадящем образе жизни больного астмой имеет значение исключение из диеты ряда продуктов, содержащих раздражающие компоненты, которые могут неспецифически спровоцировать приступ:
1) пищевые консерванты Е220, 221, 222, содержащие двуокись серы и метабисульфит, обладающие прямым раздражающим действием на дыхательные пути;
2) пищевые добавки — тартразин и красители (Е102);
3) пищевые продукты, содержащие гистамин или высвобождающие гистамин факторы
4) нитриты, глутамат натрия.
Несмотря на прогресс в средствах диагностики и в производстве фармакологических препаратов, мировая статистика показывает, что в последние 5 лет во многих странах смертность от бронхиальной астмы возросла. Угрожающие жизни приступы могут развиваться у пациентов, клиническую картину у которых расценивали как умеренно выраженную, а не только у заведомо тяжелобольных. Выделяют следующие группы повышенного риска среди больных бронхиальной астмой.
1. Больные, имеющие (или имевшие) эпизоды анафилаксии в ответ на:
а) пищевые добавки (метабисульфит, глутамат натрия, тартразины);
б) ЛС (ацетилсалициловая кислота и другие НПВС);
в) ингаляцию двуокиси серы, табачного дыма, специфических химических соединений, бытовых аэрозолей;
г) укусы насекомых;
д) инъекции пенициллина.
2. Психически лабильные больные с выраженной повышенной неспецифической реактивностью бронхов, плохо понимающие своё состояние и недооценивающие его серьёзность, впадающие в панику, не способные применить кризиc–план или вовсе не имеющие его.
3. Больные с рекуррентным ангионевротическим отёком гортани и языка, попавшие в специальные клинические ситуации (например, необходимость интратрахеального наркоза при хирургических вмешательствах и т.п.).
14.7. Атопический дерматит
Атопический дерматит (АтД) — хроническое воспалительное заболевание кожи с участием в патогенезе АТ класса Е. В западных странах АтД встречается достаточно часто — у 10% населения, преимущественно у детей до пубертантного возраста. Воспалительный процесс часто локализуется на сгибательных поверхностях конечностей, но может охватывать и существенно бoльшие области кожи. Отличительным симптомом АтД является зуд в поражённых участках кожи, нередко весьма сильный. Примерно у 80% пациентов с АтД значительно повышен уровень общего IgE (до десятков тысяч ME в 1 мл), у 20% он в пределах нормы. АтД с высоким содержанием общего IgE в крови иногда называют тяжёлым атопическим синдромом. На гистологических препаратах биопсии кожи наблюдают повышенное содержание в дерме инфильтрирующих лимфоцитов и микроваскуляризацию эпидермиса. Причинными аллергенами чаще всего бывают клещи домашней пыли — Dermatophagoides pteronyssinus и Dermatophagoides farinae, микроскопический гриб Pytirosporum orbicularae и P. ovale, пищевые аллергены яйца, молока, орехов, рыбы, ракообразных, моллюсков или др.
АтД может сочетаться с крапивницей и ангионевротическими отёками, а также респираторными аллергическими заболеваниями.
Лечение атопического дерматита состоит в назначении антигистаминных препаратов, ГКС наружного применения, ЛС, ингибирующих выброс медиаторов из тучных клеток (кетотифен и др.), гипоаллергенной диеты. В случае инфицирования расчесов кожи показаны противомикробные препараты наружного применения. Нередко возникает необходимость в седативных препаратах, особенно на ночь (постоянный зуд мешает спать).
14.8. Системная анафилаксия
Системная анафилаксия — наиболее драматическое клиническое проявление массивного высвобождения медиаторов из гранул тучных клеток и базофилов. Она характеризуется быстрым наступлением симптомов (в пределах 30 мин от момента воздействия причинного фактора) во многих органах и потенциально смертельно опасна.
Собственно
анафилаксией
принято
называть патологический процесс,
инициация которого происходит через
взаимодействие Аг — IgE–FcRI —
тучная клетка/базофил. Но дегрануляция
тучных клеток/базофилов может происходить
под действием множества других факторов,
кроме «Аг–IgE» (см. табл. 14.1). IgE–независимые,
но по симптомам такие же процессы принято
называть анафилактоидными.
Клинически
анафилаксия и анафилактоидные реакции
неотличимы,
но
терапевтическая тактика одинакова
только в острый период и различна в
межприступные периоды. Поэтому
дифференциальная диагностика, с одной
стороны, нужна, с другой — представляет
немалые трудности и посильна клиницистам
высокой квалификации. В дальнейшем при
описании клинической картины болезни
мы будем говорить для краткости об
анафилаксии, но все тоже самое применимо
к анафилактоидным реакциям.
Клиническая картина. Анафилаксия развивается через несколько минут после причинного воздействия, и смерть может наступить через несколько минут. Но процесс может затянуться и на несколько часов и даже дней. Патологоанатомически наблюдают следующее:
1) отёк верхних дыхательных путей (включая гортань), что может привести к острому удушью;
2) бронхоконстрикцию, усиленную секрецию слизи в нижних дыхательных путях, субмукозный отёк, застой крови, эозинофильную инфильтрацию;
3) отёк лёгких, иногда геморрагии и ателектазы;
4) системную вазодилатацию периферических сосудов, повышение проницаемости сосудов, отёки в тканях и уменьшение объёма крови внутри сосудов, соответственно резкое падение кровяного давления, «побледнение» сердечной мышцы (ухудшение кровоснабжения миокарда), ишемию почек и других внутренних органов;
5) застойные явления в печени, селёзенке, стенке кишечника;
6) отёк кожи;
7) спазмы гладкой мускулатуры мочевыводящих путей и кишечника.
Проявления со стороны респираторной системы превалируют в 70% случаев системной анафилаксии, со стороны сердечно–сосудистой системы — в 25% случаев.
Патогенез анафилаксии объясняется системным массивным выбросом медиаторов тучных клеток и базофилов.
Клиническая манифестация анафилаксии чаще всего выглядит следующим образом: сыпь, часто в виде крапивницы; симптомы ринита и конъюнктивита; ангионевротический отёк, особенно в области лица и шеи, верхних дыхательных путей и конечностей; симптомы астмы; рвота, диарея и колики в животе; непроизвольное мочеиспускание, гипотензия. Могут наблюдаться также цианоз, аритмия сердца и потеря сознания.
При IgE–опосредованной анафилаксии на пищевые аллергены симптомы могут развиваться во времени двухфазно: после первичной манифестации наступает относительно бессимптомный период, а за ним вновь симптоматический и, как правило, более тяжёлый и продолжительный; в некоторых случаях больных поддерживают на ИВЛ и на вазопрессорных препаратах в течение нескольких дней и даже недель.
Из «причинных» аллергенов системную анафилаксию вызывают, как правило, 3 типа: яды жалящих насекомых (перепончатокрылых — пчёл и ос), пищевые аллергены и ЛС.
Как всякая пищевая аллергия, системная анафилаксия на пищевые аллергены чаще поражает маленьких детей, но может быть и у взрослых, особенно с тяжёлыми воспалительными заболеваниями ЖКТ. В раннем детстве (до 3 лет) наиболее часто «причинными» продуктами бывают яйца, коровье молоко, соя, в более старшем возрасте и у взрослых — арахис, древесные орехи (бразильский, фундук, грецкий), ракообразные. В случае истинной аллергии на пищевые продукты тесты на специфические IgE положительны. Анафилаксию могут вызвать следовые количества специфических аллергенов (запахи, следы на посуде).
Специального внимания при сборе и анализе анамнеза, а также специальных приёмов физикальной диагностики требуют случаи анафилаксии, инициируемой физическими факторами: холодовой, связанный с физическими нагрузками (особенно после приёма определённой пищи).
Лечение. В остром периоде системная анафилаксия требует экстренных, часто реанимационных мер.
Если
ведущим симптомом является бронхоспазм,
то в первую очередь применяют аэрозольные
формы бронходилататоров (2–адреноагонистов).
Если симптоматика тем не менее продолжает
нарастать и присоединяются сосудистые
явления, то применяют кислородную маску
и эпинефрин (адреналин) внутримышечно
[по 0,3–0,5 мл раствора 1:1000 (у детей по
0,01–0,015 мл/кг) с интервалами 5–10 мин под
контролем ответа организма]. Внутривенное
введение адреналина резервируют на
случай развития тяжёлого шока или
респираторной асфиксии (кроме того,
внутривенное введение адреналина может
вызвать аритмию сердца). При внутривенном
введении применяют метод инфузии
раствора в разведении 1:10 тыс. со скоростью
не больше 1 мл/мин. В тяжёлых случаях
адреналин вливают с большим объёмом
кровезаменителей (предпочтительны
коллоидные растворы типа полигелина)
в течение нескольких часов в дозе 5–15
мкг/мин. Для профилактики поздней фазы
вводят ГКС.
В межприступном периоде в случае удачной диагностики, выявившей этиологические фактор(ы), главное — строго избегать контактов с аллергеном, холодом и другими провоцирующими воздействиями. В случае анафилаксии на укусы перепончатокрылых насекомых эффективна специфическая иммунотерапия в течение 3–5 лет (иммунизация специфическим Аг в течение 4–6 нед 1 раз в 1 год).
14.9. Пищевая аллергия
Кратко обсудим, что такое пищевая аллергия, поскольку она особенно трудна для корректной диагностики: её необходимо отличать от явлений непереносимости тех или иных продуктов (в основе которой лежит дефицит пищеварительных ферментов или кофакторов пищеварения), а также от проявлений токсичности тех или иных компонентов пищи.
Для диагностики именно аллергии на пищу необходимо:
1) чётко выявить воспроизводимость патологических симптомов в «слепых» провокационных тестах на инкапсулированные пищевые Аг;
2) методами лабораторной диагностики показать наличие иммунных механизмов патогенеза.
Пищевая аллергия встречается у 4–6% детей в возрасте до 3 лет, у 1–2% детей более старшего возраста и менее чем у 1% взрослых. Склонность детей младшего возрасти к пищевой аллергии объясняется тем, что у детей выше проницаемость кишечного барьера для нерасщеплённых пищевых веществ.
Если аллергия проявляется в возрасте до 2–3 лет, то, как правило, к подростковому возрасту человек из нее «вырастает» (укрепляется пищеварительный барьер и клинические симптомы аллергии исчезают). Если аллергия проявляется у ребенка после 3 лет, то вероятность того, что он из нее «вырастет», меньше.
Наиболее распространённые пищевые аллергены — гликопротеины с молекулярной массой 18–36 тыс. Они устойчивы к термической обработке и кислой среде. Для 80–90% детей с пищевой аллергией причинные аллергены содержатся в небольшом числе продуктов — это яйца, молоко, арахис, соя, пшеница. Для большинства взрослых аллергенны арахис, ракообразные, рыба.
Непереносимость пищевых продуктов проявляется головной болью, недомоганием, вялостью, миалгией. Нередко отмечают симптомы, неотличимые от аллергии: крапивница и реже ангионевротический отёк.
Клинические проявления пищевой аллергии у детей — это чаще всего экзема и желудочно-кишечные расстройства. При высоком уровне аллерген–специфических IgE при попадании аллергена per os вероятны острые проявления: отёк губ, языка и горла; чувство жжения, затем рвота, спазмы в животе, боль и диарея. По мере всасывания аллергена и распространения его по организму могут развиться генерализованная крапивница, бронхоспазм, в тяжёлых случаях — системная анафилаксия.
Отрицательные данные лабораторных анализов на IgE–АТ к пищевым аллергенам имеют большое диагностическое значение в плане исключения аллергической природы заболевания. Для подтверждения диагноза пищевой аллергии наиболее информативны слепые, контролируемые плацебо провокационные тесты. Дифференциальный диагноз поставить трудно, помогает высокоточная лабораторная диагностика.
Лечение. Элиминационная диета, причём исключают не только продукты, в которых выявлены специфические аллергены, но и довольно много продуктов, содержащих факторы неспецифической дегрануляции тучных клеток: природные салицилаты, консерванты (двуокись серы, метабисульфит), пищевые добавки (тартразин, красители и др.). В случае астматических проявлений пищевой аллергии применяют описанное выше противоастматическое лечение, в случае общей анафилаксии — описанную выше интенсивную терапию, в случаях, когда ведущим проявлением служит крапивница, — соответствующее лечение.
Анализ значения пищевых продуктов в этиологии заболевания начинают после сбора анамнеза с апробации элиминационных диет. В первую очередь начинают с диеты с пониженным содержанием природных салицилатов, пищевых консервантов и пищевых красителей. Для этого из рациона минимум на 3–4 нед исключают продукты, содержащие в значительных количествах салицилаты, консерванты и красители. К продуктам со значительным количеством природных салицилатов относятся многие фрукты и овощи (малина, красная смородина, черная смородина, вишня, слива, ананас, апельсины, мандарины, грейпфрут, киви, авокадо, томаты, баклажаны, огурцы, арбуз и др.), травы и приправы (мята, укроп, острые перцы и др.), мед, чай, натуральный кофе, цикорий, вина (портвейны, ликеры, сухие вина, ром), пиво. Не следует также забывать, что салицилаты могут быть в парфюмерных изделиях, зубных пастах, а также в ЛС (ацетилсалициловая кислота и др.). Таким образом, на период испытания элиминационной диеты надо тщательно подобрать средства личной гигиены и ЛС и исключить всё, что содержит салицилаты. Кроме того, следует избегать бытовых аэрозолей и прочей бытовой химии.
Консерванты добавляют во все коммерческие продукты питания длительного хранения: во фруктовых соках используют бензоаты, в сухофруктах — сорбат или двуокись серы, в мясных изделиях — нитриты, в продуктах, содержащих дрожжи, — пропионат, в жиросодержащих продуктах — антиоксиданты.
Пищевые красители (тартразин, эритрозин и др.) используют во многих коммерческих продуктах.
Производители обязаны уведомлять на этикетках изделий о содержании конкретных консервантов и красителей.
При первой попытке применения элиминационной диеты исключают все коммерческие продукты длительного хранения (консервированные, сушеные) и составляют меню из основных свежеприготовленных продуктов (говядина, баранина, свинина, домашняя птица без кожи, крольчатина, свежая рыба, яйца, любая крупа, кроме кукурузы, свежее масло без антиоксидантов, бананы, груши, петрушка, чеснок и т.п.), не применяя перечисленные выше продукты с высоким содержанием природных салицилатов. Если через 3–4 нед диагностически значимый результат не получен, то ещё на 2–3 нед назначают более «узкую» диету. Например, разрешены баранина, телятина, домашняя птица без кожи, яйца, подсолнечное масло без тепловой обработки и антиоксидантов, белый картофель, белый рис, саго, пшеничные хлопья, груша без кожуры, белый сахар, из приправ — соль, петрушка, лимонная кислота. Исключены все виды соленого и обработанного мяса (колбасы, ветчина и т.п.), сыры, все виды маргаринов и масел с антиоксидантами, все фрукты (кроме очищенной груши), другие крупы, мед, заменители сахара, уксус, специи, натуральный лимонный сок. Если и в данном случае диагностически значимый результат не получен, пробуют элиминационные диеты с исключением каких–либо частных продуктов, если об этом есть данные в анамнезе больного. Если причинный(е) продукт(ы) не выявлен(ы), то, вероятно, у больного не пищевая аллергия и значение пищевых продуктов в этиологии невелико.
Есть ещё такое редкое проявление иммуноопосредованной патологии ЖКТ, как эозинофильный гастроэнтерит. Как правило, он бывает у пациентов с тяжёлой атопией. Слизистые оболочки желудка и кишечника инфильтрированы эозинофилами. Клинически болезнь проявляется хроническими или рекуррентными желудочно-кишечными симптомами, сопровождаемыми мальабсорбцией, железодефицитной анемией, иногда асцитом. Лечат ГКС, кромоглициевой кислотой и кетотифеном.
14.10. Крапивница и ангионевротический отёк
Крапивница — чётко очерченный процесс в коже в виде зудящих папул или волдырей размером от нескольких миллиметров до нескольких сантиметров с эритематозом по периферии волдырей и между ними. Крапивница развивается быстро после этиологического воздействия. Острая крапивница саморазрешается в течение нескольких часов. Встречается рекуррентная хроническая крапивница.
Ангионевротический отёк — отёк подкожных и субмукозных тканей, преимущественно в области головы, шеи, ладоней рук, подошв стоп и половых органов. В 45% случаев ангионевротический отёк сочетается с крапивницей, так как они имеют общий патогенез.
Крапивница и ангионевротический отёк в той или иной форме поражают не менее 15–25% всех людей.
Крапивница и ангионевротический отёк — это локализованные в отдельных участках дермы или в подкожных и субмукозных тканях отёки и покраснения, обусловленные расширением сосудов микроциркуляции и повышением их проницаемости для жидких компонентов сыворотки крови под действием на них гистамина, гепарина и нейтральных протеаз, секретированных из тучных клеток. На биопсии кожи больных хронической крапивницей в периваскулярной соединительной ткани выявляют в 10 раз больше тучных клеток и в 4 раза больше T–лимфоцитов, чем в норме. В случаях острой крапивницы клеточного периваскулярного инфильтрата нет. Вероятно, фактором, предрасполагающим к крапивнице, является дефицит биохимических механизмов распада гистамина в межклеточной соединительной ткани (клиренс гистамина).
Выброс
гистамина из тучных клеток при крапивнице
также может зависеть от «аллергена–IgE–FcRI,
но может зависеть и от других факторов,
способных вызвать дегрануляцию тучных
клеток (см. табл. 14.1). Соответственно
этиологическим факторам крапивница
может быть истинно аллергической
(IgE–опосредованной,
менее 30% случаев); аутоиммунной; вторичной
преходящей при вирусных инфекциях;
возникающей в ответ на физические
воздействия из внешней среды, такие как
инсоляция (солнечная крапивница),
погружение в воду (аквагенная крапивница),
охлаждение тела (холодовая крапивница),
перегрев тела (тепловая), тактильные
воздействия (механические прикосновения
к телу той или иной интенсивности,
особенно вибрации); физические нагрузки
с повышенным потоотделением; некоторые
пищевые продукты, но не в качестве
аллергенов, а за счёт неспецифических
высвобождающих гистамин веществ
(гистаминолибераторов, ими часто бывают
цитрусовые, другие кислые фрукты и
ягоды, шоколад).
Более
70% всех случаев крапивницы
являются
хроническими
или
рекуррентными. Большинство же случаев
хронической крапивницы — не истинная
аллергия, т.е. не зависят от каких–либо
аллергенов. Как уже отмечали, в большинстве
случаев хронической крапивницы
дегрануляцию тучных клеток вызывают
аутоантитела к Рц FcRI.
При отсутствии специальных методов
лабораторного выявления таких аутоантител
свидетельством их присутствия в крови
больного может быть появление волдырей
и покраснения кожи при интрадермальном
введении небольших количеств собственной
сыворотки больного.
У 20–30% больных с хронической крапивницей имеется и васкулит. В таких случаях кожные симптомы могут держаться не менее 24 ч, обычно 3–7 сут. Зуд может быть, но умеренный, превалирует чувство потепления или жжения в очагах. После исчезновения проявлений крапивницы как таковой на её месте остаются синяки или окрашенные пятна. У 70% таких пациентов имеются также симптомы артралгии и артрита, а также возможны боли в животе, тошнота, общая слабость или даже лихорадка. СОЭ обычно повышена и определяется C–реактивный белок.
Этиологическим фактором рекуррентной ангиоэдемы без крапивницы (наследственный ангионевротический отёк) может быть генетический дефект компонента системы комплемента — C1–ингибитора. Нормальные концентрации C1–ингибитора в сыворотке составляют 18–22 мг/л. C1–ингибитор является ингибитором сериновых протеаз, причём не только компонентов комплемента C1r и С1s (для них он единственный ингибитор), но также кининовой системы и фибринолиза (факторов ХIIа, XIIb). При дефиците C1–ингибитора повышены активность системы комплемента в целом, а также продукция вазоактивного брадикинина. Именно брадикинин и ответствен за незудящую (гистамина нет) ангиоэдему. Для профилактики и поддерживающей терапии назначают андрогены, которые, как оказалось, усиливают транскрипцию и трансляцию C1–ингибитора (даназол 400–600 мг/сут). При острой атаке необходима заместительная терапия свежезамороженной плазмой или концентратом C1–ингибитора. Инъекция такого концентрата показана и перед стоматологическими манипуляциями, операциями в области рта и гортани или перед интубацией.
Редко, но встречаются случаи ангионевротического отёка, в основе которого лежит не дефект гена C1–ингибитора, а появление в организме инактивирующих анти–C1i–АТ. В этой ситуации показана иммуносупрессирующая терапия.
Острая крапивница составляет около 30% всех случаев крапивницы и, как правило, имеет аллергическую природу, т.е. специфический(е) аллерген(ы). Различают крапивницу на пищевые аллергены (чаще других аллергены яиц, молока, орехов, ракообразных), контактные аллергены (латекс, растительные и животные продукты), ЛС (пенициллины, сульфаниламиды).
Преходящая крапивница характерна для вирусных инфекций, вызванных, например, вирусами гепатита В и Эпштейна–Барр.
При переливаниях крови и введении кровепродуктов (например, иммуноглобулинов) может произойти излишняя активация системы комплемента иммунными комплексами, и анафилатоксины C5a и C3a вызовут дегрануляцию тучных клеток, в том числе в микроциркуляторном русле кожи, что проявится крапивницей. Крапивницу могут вызвать физические факторы: сдавление, холод, перегрев, инсоляция, вибрация, физические нагрузки.
Среди ЛС есть такие, которые способны вызвать дегрануляцию тучных клеток напрямую, без участия IgE–АТ, и соответственно лекарственную, но не аллергическую крапивницу: ацетилсалициловая кислота, НПВС (напроксен, индометацин и др.), радиоконтрастные препараты, местные анестетики.
Есть компоненты пищи, способные также без участия IgE, напрямую вызвать дегрануляцию тучных клеток. Это все те же продукты, богатые природными салицилатами, а также консерванты (двуокись серы, метабисульфит) и пищевые добавки (тартразины, бензоаты и др.). Этих продуктов следует избегать всем пациентам, причём как с истинной аллергензависимой аллергией, так и с псевдоаллергией.
Бывает и так называемая холинергическая, или нейрогенная, крапивница (крапивница на нервной почве). Высыпания чаще образуются на туловище и конечностях, отмечают некоторое повышение температуры тела и потоотделения (например, при физических нагрузках). Папулы при такого рода крапивнице мелкие, окружённые интенсивным покраснением.
Лечение. Первое и главное — распознать этиологию и, соответственно, перестроить образ жизни таким образом, чтобы избегать патогенных факторов, насколько это зависит от самого больного. Если солнечная крапивница — затеняться от солнца, если холодовая — одеваться так, чтобы не мерзнуть, если выявлен причинный пищевой продукт, никогда не есть его и родственные ему по химическому составу продукты, и т.д. Во всех случаях крапивницы следует думать о диете, по крайней мере не увлекаться продуктами, содержащими неспецифические гистаминолибераторы (фруктами, овощами, шоколадом). Но, к сожалению, не всегда пациент и врачи могут быть уверены в том, что они выявили этиологические факторы крапивницы. В таком случае предпринимают пошаговое симптоматическое лечение, которое корректируют ex juvantibus (по результатам). В ряде случаев ответ организма пациента на конкретное примененное лечение может указать на вероятный этиологический фактор.
Стратегия терапии зависит от тяжести страдания, и каждое следующее назначение делают в зависимости от ответа организма на предыдущее лечение. В случаях спорадических, саморазрешающихся эпизодов крапивницы самое главное в лечебной стратегии — вдумчивое наблюдение пациента за собой с целью определить либо причину, либо хотя бы условия, при которых возникает крапивница. В этих случаях без медикаментозного лечения можно обойтись, если сознательно избегать провоцирующих воздействий. Для подстраховки следует иметь в личной аптечке индивидуально подходящий антигистаминный препарат. (Не зря Даниэль Бове за открытие роли гистамина в патофизиологических реакциях и за разработку антигистаминных ЛС получил ещё в 1957 г. Нобелевскую премию.) Антигистаминные препараты наглядно эффективны. Однако следует иметь в виду, что в силу индивидуальных биохимических особенностей разных людей одному человеку лучше всего помогает один препарат, а другому человеку — другой препарат, т.е. антигистаминные препараты надо подбирать индивидуально.
Самолечение антигистаминными препаратами может таить в себе опасность, несмотря на их безрецептурную продажу.
Более серьёзного терапевтического вмешательства требуют случаи хронической или рекуррентной крапивницы. Если подозрение падает на пищевое происхождение крапивницы, но точная диагностика затруднена или невозможна, то кроме симптоматической коррекции антигистаминными препаратами хорошие и стойкие результаты иногда удаётся достичь ЛС, направленными на ЖКТ. Это лечение воспалительных процессов, если они есть, что способствует уменьшению всасывания недорасщеплённых пищевых веществ во внутреннюю среду. С той же целью назначают курс препаратов пищеварительных ферментов и препаратов кишечных бактерий–симбионтов (бифидобактерии, Escherichia coli и т.п.). Если организм пациента даёт значительный положительный ответ, то ex juvantibus это указывает и на этиологию крапивницы (всасывание в кровь недорасщеплённых пищевых веществ и сенсибилизация организма на них).
В случаях тяжёлого и среднетяжёлого течения крапивницы в течение 5–7 дней или больше может потребоваться парентеральное лечение в стационаре. Начинают с парентерального введения антигистаминных препаратов — внутримышечно или внутривенно капельно (например, 0,1% раствор клемастина 2 мл внутримышечно или 2,5% раствор хлоропирамина в изотоническом растворе NaCl внутривенно) в течение 2–7 дней в зависимости от результата.
При неэффективности назначают глюкокортикоиды парентерально (дексаметазон 4–12 мг внутримышечно или внутривенно, преднизолон 30–90 мг внутримышечно или внутривенно в течение 2–3 дней). В тяжёлых случаях добавляют процедуры дезинтоксикационной терапии — плазмозамещающие средства (например, повидон + натрия хлорид + калия хлорид + кальция хлорид + магния хлорид + натрия гидрокарбонат [гемодез] 200–400 мл внутривенно капельно в течение 3–4 дней). По завершении курса парентерального лечения назначают пероральные антигистаминные препараты (фексофенадин, цетиризин, лоратадин, кетотифен и др. по выбору) длительностью до 1 мес. Кетотифен проявляет также стабилизирующее действие на тучные клетки, и его назначают более длительным курсом — возможно до 6 мес. В трудных случаях к блокаторам H1–Рц добавляют блокаторы Н2–Рц (ранитидин, циметидин, фамотидин).
Если описанная выше лечебная стратегия оказалась неэффективной, то остаётся только попытка тотальной иммунодепрессивной терапии — ГКС пролонгированного действия (например, бетаметазон внутримышечно), и в совсем тяжёлых случаях цитостатики (циклоспорин, метотрексат).
14.11. Аллергические и неаллергические реакции на медикаменты
IgE–опосредованные аллергические реакции на медикаменты (ЛС) встречаются менее чем в 10% всех случаев неблагоприятных реакций на медикаменты. Практически все ЛС вызывают побочные эффекты, у многих — весьма серьёзные, многие — просто токсичны. Среди неспециалистов–иммунологов словосочетание «аллергия на лекарство» используется гораздо чаще, чем есть именно аллергия, а не иной по механизму неблагоприятный эффект ЛС. Поэтому для дифференциальной диагностики лекарственной аллергии необходимы специальные лабораторные исследования на наличие иммунных механизмов в патогенезе патологического процесса. Не менее чем у 30% пациентов развиваются какие–либо отрицательные реакции на лекарства, угрожающих жизни из них около 0,2%.
Аллергию с механизмом типа I подозревают при наличии следующих признаков:
1) в анамнезе есть сведения о приёме данного (или перекрестно реагирующих) препарата в прошлом;
2) острая атака возникает при попадании в организм минимальных доз;
3) симптомы развиваются вскоре после приёма препарата (в пределах 30–45 мин) и по проявлениям похожи на аллергию немедленного типа любой этиологии (на пищевые Аг, укусы насекомых).
Кожные прик–тесты или их аналог in vitro (определение специфического IgE) могут быть информативны, как показывает практика, только в отношении следующих ЛС: пенициллинов, цефалоспоринов, противотуберкулёзных средств, хинидина, инсулинов, антиконвульсантов, миорелаксантов, местных анестетиков. Диагностическое значение имеет определение триптазы тучных клеток в сыворотке крови. Тест на высвобождение гистамина практического диагностического значения в данном случае не имеет.
Если результаты лабораторных методов не дают чёткого ответа, а какой-то препарат под подозрением, но есть серьёзные клинические показания для его применения, то терапевтическую дозу не следует вводить одномоментно: препарат начинают вводить минимальными дозами с интервалами 20–30 мин и, если не возникает осложнений, «добираются» до терапевтической дозы.
Иммуноопосредованные
реакции чаще всего встречаются в
отношении следующих ЛС: пенициллинов,
сульфонамидов, тиазидов, цефалоспоринов,
противотуберкулёзных средств,
миорелаксантов, противосудорожных
средств, тиопентала натрия, хинидина.
Эти ЛС способны связываться с белками
сыворотки или поверхности клеток и
выступать в роли гаптенов. В качестве
полных Аг иммунная система способна
распознавать гормоны и ферменты (инсулин,
АКТГ и др.). Антибиотики из группы
–лактамов
вызывают 40–50% всех случаев неблагоприятных
реакций, ацетилсалициловая
кислота
и другие НПВС (ингибиторы циклооксигеназы) —
17–27%, психотропные препараты —
10–12%.
Существенный клинический факт состоит в том, что наличие вирусных инфекций является сильнодействующим кофактором для развития тяжёлых реакций на лекарства. Например, если обычно в ответ на ампициллин макулопапулёзная сыпь развивается примерно у 5% пациентов, то у пациентов с инфекцией вирусом Эпштейна–Барр — в 70–100% случаев. При введении пенициллина иммунологические реакции разного рода возникают примерно в 8% случаев, но у инфицированных вирусом Эпштейна–Барр в 100% случаев появляется как минимум макулопапулёзная сыпь. Аналогично, если обычно на комбинацию триметоприма с сульфаметролом или с сульфамонометоксимом кожные реакции возникают у 3% пациентов, то у ВИЧ–инфицированных на бессимптомной стадии — в 12% и больных СПИД — в 30–70%.
IgE–опосредованные
анафилактические
реакции развиваются
чаще всего в ответ на антибиотики из
группы –лактамов,
блокаторы нервно–мышечной передачи,
а также, что ожидаемо, на продукты крови.
Анафилактоидные реакции без участия IgE, но зависящие от выброса медиаторов из тучных клеток и базофилов в результате иного воздействия (а именно, прямого воздействия ЛС на тучные клетки или базофилы) развиваются в ответ на ацетилсалициловую кислоту, другие НПВС, рентгенонтрастные препараты. Кроме того, некоторые препараты крови (например, иммуноглобулины) при введении в кровь больного способны активировать систему комплемента, и образующиеся анафилатоксины C5a и C3a, как известно, могут вызвать дегрануляцию тучных клеток.
У некоторых больных образуется значительное количество IgG–АТ к пенициллину, который способен сорбироваться на эритроцитах. В этой ситуации при введении больших доз пенициллина может развиться острая гемолитическая анемия.
Тип
III
повреждающих реакций по Джеллу
и Ваксману —
образование иммунных комплексов —
если развивается, то через 1–3 нед от
начала приёма лекарства. Проявляется
симптомами лихорадки, общей слабости,
крапивницы, артралгии. Реакции такого
рода бывают на ксеногенные сыворотки,
антибиотики из группы –лактамов,
сульфонамиды, стрептомицин,
пропилтиоурацил, фенитоин,
аминосалициловую
кислоту.
Органоспецифическая манифестация неблагоприятных реакций на ЛС.
Кожа.
Наиболее
частые проявления на коже реакции
организма на ЛС типа –лактамов,
сульфонамидов, антиконвульсантов
выглядят как макулопапулёзная сыпь,
эритематоз или кореподобная сыпь. Но
бывают и более травматичные проявления:
многоформная эритема (erythema
multiforme),
эксфолиативный дерматит, везикулярная
(в том числе крупноволдырная) сыпь;
фотосенсибилизация. Зуд и крапивница
с ангиоэдемой нередко развиваются не
по иммунологическим механизмам, а в
результате прямой дегрануляции тучных
клеток под действием ЛС (ацетилсалициловая
кислота,
другие НПВС).
Редко вслед за erythema multiforme патологический процесс в коже прогрессирует в сторону генерализации, в него вовлекаются слизистые оболочки — развивается фебрильный слизисто–кожный синдром, называемый синдромом Стивенса–Джонсона. Кроме значительно выраженной erythema multiforme на коже и слизистых оболочках, развиваются лихорадка и явления общей интоксикации. В наиболее тяжёлых случаях, которые названы синдромом Лайелла, патологический процесс охватывает кожный покров тотально, слизистые оболочки глаз, гениталий, развивается эпидермальный некролиз, эпидермис отслаивается. В среднем при синдроме Лайелла летальность составляет до 35% (рис. 14.1). Чаще других указанные проявления вызывают сульфонамиды, ко–тримоксазол, барбитураты, фенитоин, ацетилсалициловая кислота и другие НПВС. Иммунопатогенез мало изучен. Как правило, описанные клинические симптомы развиваются через 1–3 нед от начала приёма ЛС. В биопсийном материале из очагов поражения кожи находят в повышенном количестве T–лимфоциты. Предприняты исследования по клонированию лимфоцитов из кожи больных с синдромом Лайелла. Выделены сотни (более 400) клонов. Их анализ показал, что бoльшая часть этих лимфоцитов — CD4+ перфорин–гранзимовые киллеры (CD4+–ЦТЛ), есть и CD8+–ЦТЛ и в небольшом проценте присутствуют другие субпопуляции иммунных лимфоцитов.
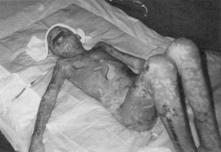
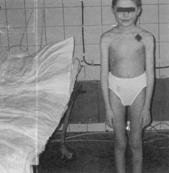
Рис. 14.1. Синдром Лайелла. А. Острая стадия. Синдром Лайелла, или острый тотальный эпидермальный некролиз, развился в ответ на введение в организм терапевтических доз НПВС пиразолонового рада. Как правило, патологический процесс проявляется через 1–3 нед от начала приёма препарата. Первым симптомом неблагополучия бывает erythema multiforme. Если процесс затрагивает слизистые оболочки, то состояние называют синдромом Стивенса–Джонсона. Вероятность быстрого прогрессирования его в тотальный острый эпидермальный некролиз велика. Дифференциальный диагноз достаточно сложен, и его необходимо проводить по крайней мере с генерализованной герпетической инфекцией кожи и слизистых оболочек, буллёзной формой пемфигоида, генерализованными васкулитами, пустулезной формой псориаза. Лечение возможно, но требует специально оборудованного стационара со стерильными палатками, аппаратами ИВЛ, оборудованием и медикаментами для интенсивной терапии, а также специально подготовленного персонала. Б. Тот же пациент после лечения. (Фотографии представлены лечащим врачом — зав. отделением реанимации и интенсивной терапии Института иммунологии МЗ РФ докт. мед. наук Т.В. Латышевой.)
Лечение проводят в режиме реанимации. Защитить обнаженную дерму от инфекции удаётся в условиях стерильных палаток (типа противоожоговых) и с помощью интенсивной противомикробной медикаментозной терапии. Вводят большие объёмы кровезаменителей, глюкокортикоиды. Чрезвычайно важны местное противовоспалительное и эпителизирующее лечение кожи и слизистых оболочек, профилактика их сращения.
Дифференциальный диагноз приходится проводить с буллёзной формой пемфигоида, герпетиформным дерматитом, генерализованным герпесом кожи и слизистых оболочек, генерализованными васкулитами, пустулезной формой псориаза.
Лёгкие. Из реакций лёгких на ЛС наиболее известна реакция на нитрофурантоин, выражающаяся сначала в виде интерстициальных инфильтратов, которые затем могут прогрессировать в лёгочный фиброз. Сходные осложнения связаны с приёмом блеомицина, фенитоина, метотрексата.
Печень. Осложнения со стороны печени характерны при приёме эстрогенов, хлорпромазина, фенитоина, галотана, сульфонамидов, парацетамола.
Кровь. Гемолитическая анемия встречается в связи с приёмом пенициллина, хинина, хинидина и нитрофурантоина. Тромбоцитопения возможна при приёме хинина, хинидина. Механизм известен: препараты или их дериваты сорбируются на поверхности клеток, в ответ на них, как на гаптены, организм вырабатывает АТ, которые связываются с Аг на поверхности клеток, активируют комплемент и фагоцитоз, что в свою очередь разрушает клетки.
Рассмотрим отдельные ЛС.
Пенициллин. Реальная частота иммунологических реакций на пенициллин неизвестна, предположительно около 8%, но при наличии инфекции, вызванной вирусом Эпштейна–Барр, она составляет 100%. Клиническая манифестация может проявляться как (в порядке убывания частоты): сыпь на коже, лихорадка, бронхоспазм, васкулиты, эксфолиативные дерматиты, синдром Стивенса–Джонсона, анафилаксия. Если реакции проявляются в первые 3 дня от начала приёма препарата, то это чаще всего анафилаксия, крапивница, ангионевротический отёк, бронхоспазм. В более поздние сроки отмечаются гемолитическая анемия, нейтропения. Анафилаксия развивается в 0,04% случаев, летальность составляет 0,001%. Выявляемость IgE–сенсибилизации к пенициллину не превышает 80%. Если у человека аллергия на пенициллин, то вероятность реакций на другие антибиотики у него на порядок величины выше, чем в среднем в популяции. С течением лет человек может перестать болеть аллергией на пенициллин. Возможна десенсибилизация методом специфической иммунотерапии.
Ампициллин и амоксициллин. Макулопапулёзная сыпь на коже в связи с приёмом этих препаратов обычно появляется только при инфекции, вызванной вирусом Эпштейна–Барр или цитомегаловирусом, а также у больных хроническим лимфолейкозом. Как правило, IgE–АТ нет даже в тех случаях, когда кожные проявления напоминают крапивницу. Сыпь держится около 1 нед.
Цефалоспорины
и
другие
антибиотики
группы
–лактамов.
Перекрестная
реактивность ЛС этой группы с пенициллином
составляет 10–50%. Наименее реактогенны
карбапенемы (имипенем
+ циластатин
и меропенем).
Сульфонамиды вызывают реакции в виде макулопапулёзной сыпи, иногда сопровождающейся лихорадкой примерно у 3% пациентов, при наличии ВИЧ–инфекции — у 30% или больше в зависимости от стадии инфекции. Перекрестная реактивность противомикробных сульфонамидов ожидаема с ЛС той же природы, но иного назначения — с диуретиками, сахаропонижающими средствами.
Стрептокиназа вызывает аллергические реакции у 17% больных. Для предварительной оценки риска рекомендуется проведение кожной пробы.
Инсулин может вызывать образование против себя IgG– и IgE–АТ. Для диагностики аллергического компонента патогенеза тех или иных неблагоприятных реакций у реципиентов инсулинов показаны кожные тесты и определение IgE/IgG in vitro.
Радиоконтрастные вещества вызывают анафилактоидные реакции примерно у 2% пациентов. IgE–АТ к ним не определяются. Однако даже при умеренно выраженной клинической симптоматике возможен летальный исход. Поскольку предварительные анализы на чувствительность не разработаны, перед применением этих средств для профилактики рекомендуется дать пациенту антигистаминные препараты и ГКС.
Местные анестетики в большинстве случаев вызывают токсические или вазовагальные реакции и менее чем в 1% случаев иммунные реакции, которые проявляются в виде дерматита, крапивницы, ангиоэдемы или даже анафилаксии. Диагностический смысл может иметь предварительное тестирование на коже (только надо предусмотреть, чтобы в препарате не содержался адреналин) или определение IgE in vitro.
При общей анестезии крапивница, бронхоспазм, тахикардия, гипотензия и коллапс как реакция на наркотизирующие препараты или миорелаксанты (суксаметония бромид, суксаметония йодид, суксаметония хлорид, тиопентал натрий, опиаты) отмечаются крайне редко (1:10 тыс.), но с летальностью 4–6%. Чувствительным пациентам перед общим наркозом рекомендуется поставить кожные пробы или провести анализ на специфические IgE.
Кратко подытожим алгоритм диагностики и лечения аллергических болезней.
Дифференциальная
диагностика аллергического патогенеза
заболевания: анамнез, поиск аллергена(ов)
методами лабораторной диагностики
(определение IgE
in
vitro)
и провокационными тестами in
vivo
(кожные пробы; при подкожном введении
малых доз аллергена происходит локальная
дегрануляция тучных клеток и развивается
локальная реакция — волдыри,
покраснение), per
os
капсулы с пищевыми аллергенами (если
аллерген всасывается в кровь, то типично
развитие крапивницы; местно в ЖКТ реакция
в виде сокращения гладких мышц приводит
к рвоте и диарее), ингаляционные
провокационные тесты [аллергический
ринит (верхние дыхательные пути),
астматический бронхоспазм (нижние
дыхательные пути), возрастание секреции
слизи и ирритация эпителия].
Если
выявлен(ы) аллерген(ы) экзогенного
происхождения, то элиминация аллергена
может стать радикальным методом лечения,
если патологический процесс ещё не
вышел в самоподдерживающиеся порочные
круги или не наступили необратимые
органические изменения.
При
том же условии выявления этиологического(их)
аллергена(ов), но невозможности
элиминировать его(их) из среды обитания
рекомендуется такой эмпирический метод,
как специфическая иммунотерапия (СИТ).
Она показана при IgE–опосредованных
аллергиях и состоит в осторожной курсовой
иммунизации больного в течение 3–5 лет
или больше малыми дозами «причинного»
аллергена вне периодов обострения. У
многих больных при этом предположительно
происходит либо иммунное отклонение в
соотношении субпопуляций CD4+
T–лимфоцитов в сторону Тh1, либо супрессия
продукции IgE
на уровне воздействия на ингибирующие
Рц B–лимфоцита. Точные механизмы
лечебного эффекта СИТ неизвестны.
Медикаментозная
терапия показана во всех случаях атаки
аллергического заболевания и не имеет
альтернативы при невозможности
элиминировать аллерген(ы) и неэффективности
СИТ или наличии противопоказаний.
Медикаментозная терапия описана ранее,
в разделах о конкретных нозологических
единицах. Назначение каждого препарата
объясняется представлениями о ведущих
процессах в патогенезе. Наиболее широко
применяют антигистаминные препараты,
препараты, ингибирующие выброс медиаторов
из тучных клеток и других лейкоцитов,
антилейкотриеновые и ГКС. Выбор
препаратов, доз и схем лечения зависят
от нозологической формы, стадии и степени
тяжести клинических проявлений
заболевания.
Другие
назначения зависят от конкретной
нозологической формы болезни, локализации
ведущего и сопутствующих патологических
процессов (при бронхиальной астме —
бронходилататоры, при атопическом
дерматите — средства, способствующие
заживлению кожи, при пищевых аллергиях —
препараты пищеварительных ферментов
и т.д.).
Глава 15
ИММУНОТРОПНАЯ ТЕРАПИЯ И ЕЁ ПРИНЦИПЫ
Принципы иммунотропной терапии. Известно по крайней мере 5 способов воздействия на иммунную систему:
заместительная
терапия
(введение в организм донорских препаратов
иммуноглобулинов, цитокинов, клеток,
цельной донорской крови, плазмы и т.п.);
иммунодепрессия
(антигеннеспецифическая или индукция
антигенспецифической толерантности);
иммуностимуляция
(антигеннеспецифическая);
иммунизация
заданным
Аг.
Есть две разновидности, применяемые в
клинической практике:
вакцинация
(индукция
иммунологической памяти путём иммунизации
целевым Аг);
специфическая
иммунотерапия (СИТ)
аллергических заболеваний (иммунизация
специфическим аллергеном с целью
изменения соотношения факторов
лимфоцитарного иммунитета, индуцирующих
патофизиологические реакции аллергических
процессов);
системная
адаптация
индивидуального организма к условиям
внешней среды: тренировка нервно-сосудистых
реакций (процедуры закаливания),
качественное и полноценное питание,
поддержание или реконструкция в случаях
нарушения естественных биоценозов
между телом человека, его эпителиальными
барьерами и микробами-симбионтами,
психологическая адаптация и т.п.
15.1. Заместительная терапия
Заместительная терапия заключается во введении в организм экзогенных субстанций, которых в данном организме нет совсем или резко не хватает. Наиболее распространённый вид такой терапии — переливание крови при витальных кровопотерях. При принятии решения об использовании заместительной терапии в плане не только медицинской деонтологии, но и юридическом врачи вынуждены и обязаны строго руководствоваться по крайней мере тремя принципами:
заместительную
терапию назначают только по витальным
показаниям — когда альтернативы нет
и без такой терапии больной умрет;
заместительную
терапию необходимо документирование
обосновать данными квалифицированной
и адекватной лабораторной диагностики,
показывающей, чего именно недостает в
организме пациента;
поскольку
тот субстрат, который вводят в организм
при заместительной терапии — ткани
(или их фракции) других людей (доноров)
или животных или продукты генно-инженерной
или клеточной биотехнологии, т.е. это
всегда ксенобиотики,
то
пациенту необходимо сообщить о том, что
существует непросчитываемый риск его
заражения ретровирусными, прионными
или иными инфекциями в результате
данного лечения. Никакой
лабораторный анализ или их множество
в принципе не может доказать отсутствие
инфекционной опасности биогенных
препаратов. Доказать
наличие инфекции можно, но не её
отсутствие.
Вопрос о назначении заместительной терапии встает в двух клинических ситуациях:
при
врождённых генетических дефектах, при
которых в организме нет какого–либо
белка(ов) или каких–либо клеток;
исходно
полноценный организм подвергся какой–либо
травме (кровопотери, ожоги, ионизирующее
облучение, химическое отравление,
цитопатогенные инфекции и т.п.), в
результате чего утрачено значительное
количество какой–либо ткани.
При врождённых дефектах, если отсутствуют какие-то клетки (например, лимфоциты при тяжёлой комбинированной иммунологической недостаточности), заместительной терапией можно считать трансплантацию донорских клеток (костного мозга, лимфоцитов). Если нет отдельных молекул (например, СМЛ, ингибитор C1–компонента комплемента, иммуноглобулины и др.), то заместительная терапия сводится к пожизненным регулярным инъекциям растворов недостающих субстанций. Если это единственный тип молекул, например СМЛ, то возможно применение препарата рекомбинантного белка. Если это большое множество разнообразных молекул, например иммуноглобулинов при агаммаглобулинемиях, то для заместительной терапии пригодны только препараты иммуноглобулинов из крови других людей. Очевидно, что в плане инфекционной опасности рекомбинантные препараты менее угрожающи, но и они не абсолютно безопасны.
Если необходимость в заместительной терапии возникает в результате травматической потери значительной части собственных тканей, то донорское возмещение возможно выполнить однократно. Соответственно риск заразиться вирусами или прионами из лечебного препарата меньше, чем при пожизненном регулярном введении заместителя. Именно в таких клинических ситуациях необходимо особенно тщательно продумывать лечебную стратегию — нельзя ли попытаться спасти жизнь все-таки без введения человеку препаратов из чужой крови или иных тканей людей и животных. Факт применения заместительной терапии должен быть тщательно документирован в истории болезни (с указанием производителя и номера партии введенного препарата) и зарегистрирован в базе данных лечебного учреждения (на случай, если потребуется эпидемиологическое или судебное расследование).
В клиниках, занимающихся иммунодефицитными патологиями, чаще всего используют заместительную терапию препаратами иммуноглобулинов (из крови людей–доноров) или ИФН (рекомбинантных). При применении рекомбинантных интерферонов следует отдавать предпочтение препаратам, в составе которых нет альбуминов из человеческой крови, которые было принято (некоторые производители и до сих пор это делают) использовать для стабилизации биологической активности самого ИФН.
15.2. Иммунодепрессивная терапия
С помощью химиотерапевтических препаратов иммунодепрессивного назначения осуществляют наиболее разработанный в прикладном плане фармакологический контроль иммунной системы.
Иммунодепрессивная терапия в современной медицине необходима реципиентам аллогенных трансплантатов, в тяжёлых случаях аутоиммунных заболеваний и хронического иммунного воспаления. В экспериментах на животных иммунодепрессию можно вызвать ионизирующим облучением, блокирующими моноклональными АТ к функционально-значимым молекулам лимфоцитов и химиопрепаратами.
В клинической практике используют только медикаментозную иммуносупрессию. Дадим краткую характеристику используемых в клинике иммунодепрессивных медикаментов.
Глюкокортикоиды
Глюкокортикоиды воздействуют на организм как регуляторы экспрессии более чем 1% генов, являются индукторами апоптоза активированных лимфоцитов; кроме того, активно влияют на клетки эндотелия кровеносных сосудов. Глюкокортикоиды в тучных клетках индуцируют синтез липокортинов — ингибиторов метаболизма арахидоновой кислоты — источника активных провоспалительных липидных медиаторов (лейкотриенов и простагландинов). В целом глюкокортикоиды обладают комплексным противовоспалительным действием на организм. Их широко применяют для лечения аутоиммунных и аллергических заболеваний. В трансплантологии их использование ограничено, так как значимую супрессию отторжения могут обеспечить только весьма большие дозы ГКС, при которых проявляются побочные эффекты.
Антиметаболиты
Азатиоприн сам по себе неактивен, но в печени больного превращается в активное соединение — 6–меркаптопурин. Последний ингибирует биосинтез de novo пуриновых азотистых оснований, что приводит к остановке биосинтезов ДНК и РНК. Азатиоприн тормозит функционирование и деление T–лимфоцитов и гранулоцитов, мало влияет на B–лимфоциты. Его используют главным образом в трансплантологии. Основные побочные эффекты — нейтропения, тромбоцитопения, анемия.
Метотрексат блокирует превращение фолиевой кислоты в тетрафолат, необходимый для синтеза тимидиловой кислоты. Поэтому метотрексат подавляет биосинтез только ДНК (не РНК) и, следовательно, пролиферацию клеток, в том числе лимфоцитов.
Цитотоксические препараты
К ним относятся алкилирующие агенты, блокирующие синтез ДНК в премитотической фазе клеточного цикла. Циклофосфамид превращается в активное вещество только в печени. Его используют в тяжёлых случаях васкулитов (СКВ, гранулематоз Вегенера и др.) и при трансплантациях костного мозга.
Хлорамбуцил отличается активным воздействием на B–лимфоциты, его применяют преимущественно при лечении злокачественных лимфом.
Иммунодепрессанты из грибов
Циклоспорин
A —
высокогидрофобный циклический пептид
из 11 АК. Он выделен из почвенного гриба
Tolypocladium
inflatum/Cordyceps
subsessilis.
В клетках млекопитающих обнаружили
молекулу — Рц для циклоспорина А —
белок с молекулярной массой 17 кДа,
названный циклофилином.
Циклофилин присутствует во многих
клетках организма, но эффект наномолярных
концентраций циклоспорина А наиболее
выражен именно в T–лимфоцитах, где
комплекс
циклоспорин–циклофилин
вступает во взаимодействие с кальмодулином,
который в свою очередь связывает
кальцийнейрин.
Эти
взаимодействия внутри T–лимфоцита
приводят к нарушению конформации
(фолдинга) факторов транскрипции, и в
результате в T–лимфоците становятся
невозможными биосинтезы многих цитокинов
(ИЛ–2,
–3, –4 и –5, ИФН–
и др.). В итоге в первую очередь не может
произойти пролиферация лимфоцитов и
подавляется иммунное
воспаление. В
настоящее время циклоспорин используют
как обязательный препарат для
иммуносупрессии при трансплантациях
органов. Его применяют при агрессивных
формах аутоиммунных болезней (псориаз,
увеит, апластическая анемия, ревматоидный
артрит), но следует помнить, что ухудшение
наступает сразу после отмены препарата.
Обычно циклоспорин А назначают только
в случае стероидрезистентных форм
заболеваний. На фоне циклоспорина А
усиленно проявляется онкогенный
потенциал герпеc–вирусов —
Эпштейна–Барр, саркомы Капоши и др.
Неходжкинские лимфомы развиваются у
1–10% пациентов, получающих продолжительные
курсы циклоспорина А. Все чаще стала
манифестировать саркома Капоши у
реципиентов органных трансплантатов.
Такролимус (FK 506) — макролид, выделенный из нитчатых бактерий Streptomyces tsukabaensis. Макролиды — соединения, молекула которых имеет множество циклов лактона, к ним присоединено то или иное количество дезоксисахаров.
Такролимус, как и циклоспорин А, вмешивается во внутриклеточные пути проведения сигнала, в которых участвует кальцийнейрин, соответственно блокируется пролиферация лимфоцитов и продукция многих цитокинов. Внутриклеточный акцептор для такролимуса, однако, другой, чем для циклоспорина А, а именно FKBP (FK–Binding Proteins). Оба внутриклеточных акцептора получили групповое название иммунофилины, и оба идентифицированы как пептидилпролил cis-trans-изомеразы. Однако иммуносупрессорные эффекты циклоспорина А и такролимуса, по-видимому, не связаны с изомеразной активностью иммунофилинов. Внутриклеточный механизм действия сиролимуса отличается от такового такролимуса и циклоспорина А, несмотря на то что внутриклеточным акцептором для сиролимуса являются молекулы из семейства FKBP (т.е. те же, что и для такролимуса). Однако комплекс сиролимус–иммунофилин не влияет на активность кальцийнейрина, но блокирует проведение сигнала внутрь клетки с Рц для ИЛ–2 и с Рц для ИЛ–4 и –6.
FK
506 в 10–100 раз сильнее, чем циклоспорин
А, подавляет биосинтез иммуноцитокинов
ИЛ–2, 3, 4, 5, ИФН–
и др. Побочные эффекты те же, что у
циклоспорина.
Сиролимус. Второй известный иммунодепрессант из группы макролидов выделен из бактерий Streptomyces hygroscopicus и назван сиролимусом, или сиролимусом (микроорганизм–источник был обнаружен на острове Рапануи в Полинезии).
Комплекс «сиролимус–иммунофилин» связывается в клетке с протеинкиназой, названной «в его честь» mTOR. Выяснили, что эта киназа фосфорилирует по крайней мере два белка — другую киназу р70 S6 и молекулу PHAS–1, известную как репрессор трансляции белков.
То, что у сиролимуса иные пути фармакологического воздействия на клетку, чем у циклоспорина А и такролимуса, позволяет надеяться на благоприятные терапевтические результаты от их комбинированного применения. Смысл комбинированной терапии — как всегда в стремлении к уменьшению доз каждого отдельного препарата в надежде на то, что лечебные эффекты будут синергичны, а побочная токсичность, наоборот, не будет усиливать друг друга. В настоящее время врачи ряда клиник проводят клинические испытания такой комбинированной терапии на реципиентах органных трансплантатов.
Микофенолат мофетила блокирует синтез пуринов (следовательно, синтез ДНК), а также ингибирует гликозилирование молекул адгезии (следовательно, взаимодействие клеток, в том числе в иммунном ответе) и пролиферацию гладкомышечных клеток.
15.3. Вакцинация
Вакцинация — целенаправленное введение в организм человека заданного Аг в неагрессивной форме и в неагрессивных, но иммуногенных дозах с целью индукции защитного иммунного ответа и формирования иммунологической памяти для профилактики реального инфекционного заболевания в будущем.
Динамика индукции иммунологической памяти при вакцинации и реализации её при вторичном иммунном ответе приведена на рис. 7.2.
Иммуногенность вакцинного препарата зависит от ряда параметров как собственно препарата, так и способа его введения в организм. Эмпирическим путём в экспериментальной и клинической иммунологии накоплен огромный коллективный опыт и выявлены следующие закономерности зависимости силы иммунного ответа от свойств препарата и способов его введения в организм. На примере белковых Аг эти закономерности следующие.
1. Молекулярная масса: чем она больше, тем выше иммунный ответ; существенно снижена иммуногенность пептидов с молекулярной массой менее 2,5 кД.
2. Дозы: для конкретных Аг надо подбирать конкретные оптимальные дозы, как правило, это нечто среднее. Очень низкие и очень высокие дозы менее иммуногенны (вплоть до нуля), чем средние. Что такое «очень» в весовых единицах, зависит от конкретного препарата.
3. Путь введения в организм: наивысшие иммунные ответы при подкожном введении препарата, ниже — при внутрибрюшинном, ещё ниже — при внутривенном и пероральном.
4. Агрегатное состояние препарата: более иммуногенны партикулярные и денатурированные формы, чем растворимые и нативные.
5. Адъюванты: медленное высвобождение иммуногена из композиции с адъювантом способствует более сильному иммунному ответу, чем быстрое рассасывание иммуногена из очага. Адъюванты, содержащие бактериальные вещества, как правило, существенно более эффективны, чем адъюванты, не имеющие отношения к бактериальным продуктам.
Однако не только сила, но и сама возможность развития иммунного ответа конкретной особи на какое–либо вещество зависят ещё и от определённых внутренних свойств организма, на которые нельзя повлиять никакими внешними манипуляциями. Это, во-первых, наследуемая «эволюционная память о патогенах» в «лице» первичных Рц распознавания чужого — PRR и TOLL, во-вторых, также наследуемые биохимические особенности молекул MHC, от которых зависит, будет или не будет и если будет, то насколько эффективно образован комплекс MHC — Аг в профессиональных АПК (дендритных клетках, B–лимфоцитах, макрофагах). Априорно оценить эти два параметра в отношении конкретного Аг в настоящее время практически никто не умеет, хотя теоретически это представляется выполнимым. Поскольку в действительности этого пока никто не делает (нет адекватных методов), то остаётся отдавать себе профессиональный отчет в том, что ответственный и правдивый индивидуальный прогноз результатов вакцинации в настоящее время невозможен.
С учётом сказанного тем не менее вакцинация теоретически является наиболее осмысленным методом иммунотерапии и иммунопрофилактики. Но у современной вакцинопрофилактики есть проблемы. Первая проблема — биогенное (биотехнологическое) происхождение вакцинных препаратов, одна из сторон которого — применение живых аттенуированных вирусных вакцин.
В «аттенуации» (манипуляциях по ослаблению патогенных свойств микроорганизмов in vitro или на животных) скрыта следующая проблема. Дело в том, что «выпуская» аттенуированного в лабораториях, но живого микроба в живые человеческие тела, невозможно прекратить или хотя бы контролировать дальнейшую эволюцию микроорганизма в сторону нарастания его патогенности, генетических рекомбинаций с другими микроорганизмами (а таких фактов много) с образованием новых форм жизни. Поэтому как бы ни хорош был защитный эффект живых вакцин, применяя их, никто не может реально прогнозировать персональный и популяционный риск неблагоприятных последствий для конкретного человека, даже если большинству других людей такая вакцинация не приносит видимого вреда.
Ещё одна проблема уже обсуждалась выше. Она заключается в том, что вакцина — одна на всех людей в популяции, а антигенпредставляющие возможности молекул MHC–I/II у каждого человека свои согласно семейной наследственности. Поэтому закономерным является то, что не каждого человека в принципе может защитить какая бы то ни была стандартная вакцина.
Кроме того, традиционными методами изготовления вакцинных препаратов пока не удалось получить протективных вакцин против многих инфекционных заболеваний (в частности, большинства венерических, паразитарных, многих вирусных). Многие применяемые вакцинные препараты содержат значительное количество (до 90%) примесей, помимо целевого(ых) Аг(ов).
Более 20 лет в Институте иммунологии МЗ РФ под руководством академика Р.В. Петрова и академика РАМН Р.М. Хаитова идут работы по созданию принципиально новых вакцинирующих препаратов контролируемого содержания. В их основе — определённые высокоочищенные Аг, в том числе синтетические или рекомбинантные аналоги протективных Аг возбудителей. Но сам по себе Аг — ещё не вакцина. Для индукции протективного иммунного ответа существенно молекулярное «сопровождение» Аг или носители. В Институте иммунологии ведут приоритетные работы по созданию особых полимерных молекул–носителей для целевых Аг. Эксперименты на животных показывают, что определённые полимерные носители в составе вакцинирующих препаратов позволяют индуцировать значимый иммунный ответ у особей (линий животных), которые по генетическим причинам сами по себе слабо отвечают на данный Аг (фенотипическая коррекция иммунного ответа). Прошла успешные клинические испытания и получила разрешение на применение в клинической практике трехвалентная противогриппозная вакцина «Гриппол». Эту вакцину уже несколько лет применяют для защиты населения от гриппа. Гриппол — первая в мире вакцина–химический конъюгат основного Аг вируса гриппа с полимерным иммуномодулятором.
Разрабатывают аналогичные вакцинные препараты против бруцеллёза, брюшного тифа, лепры, туберкулёза. Эти разработки не имеют аналогов в мире.
Делом разработчиков вакцин должны стать разумное решение проблем и создание вакцинирующих препаратов, удовлетворяющих необходимым критериям:
вакцина
не должна быть источником побочной
биологической опасности;
вакцина
не должна индуцировать патогенные
иммунные процессы (типа усиливающих
инфекцию АТ и др.);
вакцина
должна эффективно индуцировать
протективный иммунитет;
если
цель вакцинации, напротив, подавить
какой–либо нежелательный иммунный
процесс в организме, то вакцинный
препарат должен индуцировать
антигенспецифичную иммунологическую
толерантность (т.е. ареактивность или
делению клона лимфоцитов);
врач–иммунолог
должен уметь контролировать создание
заданного иммунитета у человека с
помощью лабораторных методов.
Общая задача современной медицины и, вероятно, шире — всего общества, но отнюдь не только иммунологии, сосредоточиться, собраться с силами и начать настоящие разработки по созданию биологически безопасных и при этом эффективных в плане защиты от реальных инфекционных заболеваний вакцинных препаратов.
15.4. Иммуностимулирующая терапия
В результате исследований отечественными учёными иммунотропных ЛС стимулирующего назначения в настоящее время в клиническую практику внедрен ряд препаратов:
1) синтетический полимер — азоксимер (N–оксидированное производное полиэтиленпиперазина; авторы: Р.В. Петров, Р.М. Хаитов, А.В. Некрасов. Механизм действия — стимуляция активности макрофагов, а также T– и B–лимфоцитов;
2) миелопид (авторы: Р.В. Петров, А.А. Михайлова и др.) — комплекс пептидов из кроветворного костного мозга свиней. В настоящее время ведут успешные работы по химическому синтезу аналогичных пептидов. Механизм действия «широкомасштабный» — препарат влияет практически на все компоненты иммунной системы;
3) ликопид (авторы: Ю.А. Овчинников, В.Т. Иванов, Т.М. Андронова и др.) — производное мурамилпептидов. Первоначально препарат выделили из клеточной стенки бактерии Lactobacillus bulgaricus, затем его воспроизвели химическим синтезом. В механизме действия на первый план выступает активация макрофагов.
В отечественных справочниках по ЛС описан ещё ряд препаратов (синтетических и природного происхождения) иммуностимулирующего назначения. Материалы по их составу и механизмам действия приведены в специальной периодической литературе и монографиях.
