
- •Иммунология. Часть I. Структура и функции иммунной системы
- •Глава 1. Основные представления
- •Глава 2
- •Глава 5. T–лимфоциты. Главный комплекс гистосовместимости
- •7.3.3.1. Хемокины
- •7.3.3.2. Рецепторы для цитокинов
- •7.3.3.3. Биологические свойства пар «цитокин — клетка–мишень»
- •Глава 9
- •Часть II. Иммунная система и патология
- •Аллергические болезни
- •Послесловие
- •Литература
- •Краткий словарь терминов
- •Иммунологические характеристики крови
Глава 5. T–лимфоциты. Главный комплекс гистосовместимости
5.1. Дифференцировка T–лимфоцитов
Сущность дифференцировки всякого лимфоцита, как Т, так и В, состоит в экспрессии антигенраспознающего Рц и необходимых дополнительных сервисных молекул, чтобы факт распознавания Аг имел действенные последствия, направленные на санацию организма от повреждённых тканей. Эти сервисные молекулы (мембранные, а также секретируемые цитокины) обеспечивают взаимодействие T–лимфоцитов с другими клетками организма.
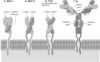
Рис.
5.1.
Структура
белков
надсемейства
иммуноглобулинов
[11]. А. Молекула
MHC класса I состоит из ‑цепи,
внемембранная её часть связана с короткой
цепью 2-микроглобулина.
Б. Молекула
MHC класса II состоит из двух СЕ: более
длинной ‑цепи
и ‑цепи.
Часть каждой цепи выступает на поверхности
клеточной мембраны, цепь содержит
трансмембранный участок и небольшой
фрагмент в цитоплазме. В. Молекула
рецептора T–клеток состоит из двух
цепей:
и .
Каждая цепь предcтавлена двумя
внеклеточными иммуноглобулин–подобными
доменами, cтабилизированными при помощи
S-S cвязей, — вариабельным внеклеточным
NH-концом и цитоплазматичеcким cтабильным
COOH-концом. SH–группа, приcутcтвующая в
цитоплазматичеcком фрагменте ‑цепи,
может взаимодейcтвовать c мембранными
или цитоплазматичеcкими белками.
Г. Мономер
молекулы IgM встраивается в плазматическую
мембрану B-лимфоцитов, это рецептор Аг.
Молекулярная структура рецепторов
T-клеток весьма сходна со структурой
молекул MHC и иммуноглобулина. Разнообразие
структуры рецепторов T-лимфоцитов и
иммуноглобулинов обеспечивается
возможностью сайт-специфической
рекомбинации множества различных генных
сегментов, кодирующих отдельные фрагменты
молекулы.
Антигенраспознающий
Рц T–лимфоцитов обозначают TCR
(T–Cell
Receptor).
TCR
кодируется генами из надсемейства
иммуноглобулинов, т.е. родственниками
генов иммуноглобулинов. Молекула TCR
представляет из себя по размеру и форме
как бы 1/4
молекулы иммуноглобулина — аналог
одного Fab–фрагмента.
TCR
является гетеродимером — состоит
из двух равновеликих полипептидных
цепей. У млекопитающих известно две
разновидности пар цепей в TCR.
В одной паре цепи обозначают
и ,
соответствующие T–лимфоциты — T.
Вторая пара цепей —
и ,
соответствующие T–лимфоциты обозначают
T.
Каждый индивидуальный T–лимфоцит несет
какой–либо один вариант Рц — либо
либо .
В отличие от иммуноглобулинов TCR исключительно трансмембранные молекулы, т.е. T–лимфоцит всегда работает собственным «клеточным телом».
Более
того, в отличие от иммуноглобулинов
TCR
не
способен распознавать
(связывать) растворимые
Аг. Это
относится по крайней мере к T
и подавляющему большинству Аг, за
исключением патогенных суперантигенов.
Что же тогда распознают T–лимфоциты? Природой T–лимфоциты предназначены для распознавания поверхностных структур собственных клеток организма. Если что-то на поверхности своих клеток будет «раздражать» T–лимфоцит (например, примесь вирусных пептидов), то он постарается организовать уничтожение повреждённой клетки.
T–лимфоцит распознаёт (связывается с) комплекс MHC–I или MHC–II с неким пептидом, который и есть Аг в общем понимании. Один определённый участок молекулы TCR вступает в химическую связь с молекулой MHC–I/II, второй участок того же TCR в тот же момент времени вступает в связь с пептидом–Аг. Этот феномен называют двойным распознаванием, или MHC–рестрикцией T–лимфоцитов. Феномен был открыт Р. Цинкернагелем и П. Дохерти, в 1996 г. они получили за это открытие Нобелевскую премию. Их первая публикация в журнале «Nature» относится к 1974 г. и занимает всего половину страницы. Но это открытие многие расценивают как самое значимое в иммунологии за последние 100 лет.
Существенно, что пептид–Аг присоединяется к молекулам MHC не снаружи клетки, т.е. он не сорбируется на поверхности клетки. Пептид–Аг встраивается в комплекс с MHC при формировании конформации молекул MHC после их биосинтеза в клетке и перед их экспрессией на клеточной мембране. Молекул MHC без пептидов вообще не бывает на наружной мембране клеток, они просто не могут быть экспрессированы, не примут правильной конформации, если ещё внутри клетки не вступят в связь с пептидом определённой длины.
Таким
образом, подавляющее большинство
T–лимфоцитов с Рц TCR
не распознают свободных нативных Аг
(ещё раз подчеркнём отличие от
иммуноглобулинов, которые как раз умеют
работать с нативными Аг в том виде, в
каком «судьба забросила» их во внутреннюю
среду организма или даже на слизистые
оболочки). Другие клетки должны каким-то
образом пропустить Аг через себя и
выставить его на своей мембране в
комплексе с MHC–I/II,
чтобы T–лимфоцит «обратил на Аг своё
внимание». Это и есть феномен представления
Аг
(или
презентации
Аг)
T–лимфоциту.
Какие клетки в организме способны быть
АПК и механизмы этого процесса мы
разберём в отдельном разделе, здесь
лишь отметим строгую необходимость
представления Аг T–лимфоциту другими
клетками.
5.2. Рецептор T–лимфоцитов для антигена (TCR)
Вторичная
и третичная структуры Рц TCR
и TCR
похожи, но есть отличия: TCR
по трёхмерной конфигурации больше
похожи на иммуноглобулины. Cтроение
Рц T–лимфоцитов для Аг удобнее рассмотреть
на примере TCR.
T–лимфоциты с –Рц —
это более «привычные» T–лимфоциты,
которые стали известны на несколько
десятков лет раньше, чем T;
99% T–лимфоцитов, проходящих лимфопоэз
в тимусе, — это T.
TCR
TCR
был открыт как особая молекула на
клеточной мембране T–лимфоцитов, с
которой связываются моноклональные
АТ, полученные как специфично реагирующие
с индивидуальным клоном T–лимфоцитов.
С помощью таких АТ «увидели», что на
отдельном T–лимфоците экспрессировано
около 30 тыс. таких антигенспецифичных
молекул. Быстро изучили молекулярную
структуру Рц. Оказалось, что собственно
антигенсвязывающая часть его состоит
из двух равновеликих полипептидных
цепей —
(мол. масса 40–60 тыс., кислый гликопротеин)
и
(мол. масса 40–50 тыс., нейтральный или
основный гликопротеин). Каждая из цепей
имеет по два домена во внеклеточной
части, гидрофобную положительно
заряженную (за счёт остатков лизина и
аргинина) трансмембранную часть и
короткий (из 5–12 остатков АК)
цитоплазматический участок. Между собой
цепи соединены одной дисульфидной
связью выше мембраны. Каждый из
внеклеточных доменов имеет по одному
сайту (месту связывания) гликозилирования
и соответственно гликозилирован.
Наружные
внеклеточные домены обеих цепей имеют
вариабельный АК–состав от Рц к Рц (от
лимфоцита к лимфоциту), гомологичные
V–области
молекул иммуноглобулинов и названные
одноимённо — V–областью
TCR.
Проксимальные домены обеих цепей
гомологичны константным областям
молекул иммуноглобулинов и также названы
одноимённо — C–областью TCR.
Соответственно обозначены и гены,
кодирующие эти области полипептидов:
V
и С,
V
и С.
Именно
V–области
–
и –цепей
вступают в связь с комплексом MHC–I/II —
пептид. Место контакта с пептидом в
–цепи —
участок CDR3,
причём с центральной частью пептида
вступает в связь участок контакта V–J.
Короткий
цитоплазматический участок как у -,
так и –цепи
физически недостаточен для обеспечения
проведения сигнала внутрь клетки. Для
проведения сигнала с TCR
служат входящие в рецепторный комплекс
ещё 6 инвариантных (т.е. одинаковых у
всех T–лимфоцитов) полипептидных цепей:
, ,
две
и две .
Комплекс
+ + 2,
как выяснили, и составляет мембранную
структуру CD3,
идентифицированную раньше по реактивности
с моноклональными АТ, связывающими все
без исключения T–лимфоциты. Цепи ,
и
имеют внеклеточный, трансмембранный
(отрицательно заряженный за счёт остатков
аспарагина и поэтому электростатически
связанный с трансмембранными участками
-
и –цепей)
и цитоплазматический участки. В случае
генетических дефектов в комплексе CD3
–
и –цепи
на мембране T–лимфоцита не появляются.
Это свидетельствует о том, что полипептиды
,
и
необходимы ещё и для формирования
правильной конформации –
и –цепей
и экспрессии их на мембране.
Полипептиды
комплекса CD3 —
,
и
высокогомологичны друг другу. Их гены
локализованы рядом, все в хромосоме 11
у человека, и, очевидно, произошли путём
дупликации от одного предкового гена.
Две –цепи
соединены между собой дисульфидной
связью, в мембране встроены между
трансмембранными участками -
и –цепей
и бoльшая часть полипептидной –цепи
уходит в цитоплазму клетки. Там эта цепь
и «задействуется» в реакциях проведения
сигнала при связывании Аг V–областями
и
на внутриклеточные структуры и процессы.
Во
всех цитоплазматических участках
полипептидных цепей ,
,
и
содержатся последовательности АК —
ITAM,
которыми эти полипептиды взаимодействуют
с протеинтирозинкиназами цитозоля
(активация этих ферментов и составляет
начало биохимических реакций по
проведению сигнала).
Схематически
структура TCR,
состоящего из 8 или 10 (по одной или две
пары
+
на проводящий комплект 2
+
+ +
2)
полипептидных цепей, представлена на
рис. 5.1.
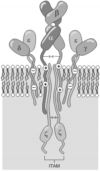
Рис.
5.2.
Строение
рецептора
T–лимфоцитов
для
антигена
(TCR)
(схема). Антигенсвязывающая область Рц
формируется -
и –цепями;
цепи ,
,
(вместе их называют комплексом CD3)
необходимы для экспрессии -
и –цепей,
их стабилизации и, вероятно, проведения
сигнала внутрь клетки; –цепь,
самая «внутриклеточная», обеспечивает
проведение сигнала внутрь клетки.
Рц для Аг присоединяет свои лиганды ионными, водородными, ван–дер–ваальсовыми и гидрофобными связями. Рц достаточно «жив» и подвижен. При связывании с Аг его конформация существенно изменяется. Как показывают исследования с применением самых современных методов с использованием трансгенных по TCR мышей (у которых все T–лимфоциты имеют единственный вариант TCR) и коллекции синтетических пептидов, а также контролируемых комплексов пептидов с растворимыми молекулами MHC, один TCR потенциально способен связывать достаточно много разных Аг (если под Аг понимать 9–членные пептиды): по минимальным оценкам 103, по максимальным — 107, по наиболее точным оценкам порядка 105. Причём один TCR связывает не только родственные по структуре Аг (их понимают как перекрестно реагирующие), но и Аг, не имеющие гомологии в структуре.
5.3.
Гены
-
и
–цепей
рецепторов
T–лимфоцитов
для
антигена
Гены
-
и –цепей
(а также
и –цепей)
устроены гомологично генам иммуноглобулинов
и претерпевают соматическую рекомбинацию
(перестройку ДНК) в процессе дифференцировки
T–лимфоцитов. Это и обеспечивает
генерацию разнообразия антигенсвязывающих
свойств TCR,
оцениваемого так же, как и для
иммуноглобулинов: теоретически порядка
1016–1018
вариантов, реально порядка 109
(соответственно числу лимфоцитов в
организме).
Гены
–цепи
имеют 70–80 V–сегментов
и 61 J–сегмент,
комбинации которых по одному из каждой
области обеспечивают дополнительное
разнообразие антигенсвязывающих свойств
TCR.
Гены –цепи
имеют 52 V–сегмента,
2 D–сегмента
и 13 J–сегментов,
а также 2 C–сегмента, расположенных, как
показано на рис. 5.2. Между V–
и J–сегментами
–цепи
находится локус генов –цепи
второго варианта TCR —
.
Локус
состоит из трёх D–сегментов,
трёх J–сегментов,
одного C–сегмента. V–сегменты
–цепи
(ориентировочно их всего 4) «вкраплены»
среди V–сегментов
–цепи.

Рис.
5.3.
Структура
генов
-
и
–цепей
рецептора
T–лимфоцитов
для
антигена.
Рекомбинация ДНК происходит только при объединении V–, D– и J–сегментов и катализируется тем же комплексом рекомбиназ, инициируемых продуктами генов RAG1 и RAG2, которые действуют при дифференцировке B–лимфоцитов. Только субстрат для рекомбиназ — гены TCR, а не гены иммуноглобулинов в T–лимфоцитах — определяют тканеспецифичные промоторы. Рекомбиназы «узнают» определённые гептамерные или нонамерные последовательности, фланкирующие каждый из сегментов V, J, D и называемые rss (recombination signal sequences) — последовательностями, сигнальными для рекомбинации. Перед каждым V–экзоном имеется L–экзон (от leader sequence — лидерная последовательность), который обязательно транслируется и обеспечивает правильное расположение полипептидной цепи в эндоплазматическом ретикулуме и правильную экспрессию на клеточной мембране (рис. 5.3).
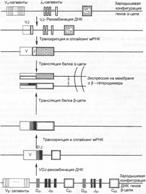
Рис. 5.4. Перестройка и экспрессия генов рецептора T–лимфоцитов для антигена (TCR).
После
перестройки VJ
в генах –цепи
и VDJ
в генах –цепи,
а также присоединения некодируемых N–
и P–нуклеотидов с ДНК транслируется
РНК. Объединение с C–сегментом и удаление
лишних неиспользуемых J–сегментов
осуществляются при сплайсинге первичного
транскрипта.
Гены
–цепи
могут перестраиваться неоднократно
при уже правильно перестроенных и
экспрессированных генах –цепи.
Параметры разнообразия антигенсвязывающих
участков T–клеточных Рц приведены в
табл. 5.1.
Таблица 5.1. Параметры разнообразия антигенсвязывающих областей TCR (Рц T–лимфоцитов для антигена)
Генетический элемент |
Число вариантов |
|
|
|
|
Зародышевое число V–сегментов |
|
|
Зародышевое число D–сегментов |
0 |
2 |
Транскрипция D–сегментов со смещением рамки считывания |
— |
Часто |
Зародышевое число J–сегментов |
|
|
Присоединение N– и P–нуклеотидов |
1 |
2 |
Программа для соматического гипермутагенеза в генах TCR отсутствует (в отличие от генов иммуноглобулинов).
Столь большое число — от 1018 до 109 — потенциально возможных вариантов антигенсвязывающих Рц на лимфоцитах является попыткой медленно размножающихся и медленно эволюционирующих видов многоклеточных организмов «угнаться» за изменчивостью сверхбыстро размножающихся и эволюционирующих инфекционных микроорганизмов. Природа сделала такой шаг — наделила суперизменчивостью в процессе онтогенеза в рамках одного тела единственный гистотип клеток (только лимфоциты) и единственную категорию молекул в этих клетках (антигенраспознающие Рц — TCR, иммуноглобулины). Лимфоцитарный иммунитет есть у очень небольшого числа видов земных многоклеточных животных, напомним — всего у 1,5%. Следовательно, 98,5% видов многоклеточных не имеют лимфоцитарной иммунной системы. Лимфоцитарный иммунитет понадобился для спасения от инфекций особей таких видов животных, которые оставляют единичное потомство — рожают редко и мало детенышей, значит, если не каждому, то большинству надо выжить, чтобы сохранился вид. Лимфоциты со своими Рц появились, возможно, 300 млн лет назад (вероятно, у челюстных рыб). При изучении структуруы генов RAG1 и RAG2, продукты которых начинают перестройку ДНК в генах иммуноглобулинов и TCR, было установлено, что эти уникальные гены RAG похожи на транспозоны. Возникла гипотеза, что гены RAG — ретровирусы по происхождению. Таким образом, возможно именно ретровирусная инфекция древнейших челюстных рыб привнесла новое свойство — соматическую рекомбинацию ДНК. Это свойство оказалось полезным для выживания и закрепилось отбором в лимфоцитах всех вышестоящих видов животных. Так, возможно, и возник лимфоцитарный иммунитет.
5.4. Корецепторные молекулы T–лимфоцитов — CD4 и CD8
TCR
распознаёт Аг–пептид только в связи с
молекулами MHC–I
или II.
Каждый конкретный T–лимфоцит предназначен
для работы с молекулами либо класса I,
либо класса II
MHC. Собственно в связь с MHC (ионными,
ван–дер–ваальсовыми, водородными и
гидрофобными связями) вступают
вариабельные участки полипептидных
цепей
и .
Но со стороны T–лимфоцита есть ещё одна
из двух (у индивидуального лимфоцита
какая-то одна) мембранных молекул,
вступающих в связь с молекулами MHC на
АПК или клетках–мишенях для T–лимфоцитов —
это молекулы CD4
и CD8.
Молекула CD4
имеет химическое сродство и вступает
в связь с инвариантной частью молекулы
MHC–II (2–доменом),
молекула CD8 —
с инвариантной частью молекулы MHC–I
(3–доменом).
Поэтому молекулы CD4
и CD8
называют корецепторными
молекулами
T–лимфоцитов. В экспериментах, моделирующих
отсутствие на клетке этих молекул,
требуются минимум в 100 раз большие дозы
Аг, чтобы активировать T–лимфоцит.
Молекула CD4 — полипептидная цепь с молекулярной массой 55 тыс. Она имеет 4 домена во внеклеточной части и по первичной структуре принадлежит к надсемейству иммуноглобулинов. Цитоплазматический участок молекулы CD4 связан с тирозинкиназой Lck и, вероятно, вносит свой вклад в проведение сигнала внутрь клетки при состоявшемся взаимодействии Рц с лигандом. В процессе активации T–лимфоцита одну молекулу TCR «обслуживают» две молекулы CD4 (происходит димеризация молекул CD4) (рис. 5.4).
Молекула
CD8 —
гетеродимер
из двух цепей, традиционно обозначаемых
и .
В некоторых случаях на клетке обнаруживают
гомодимер из двух –цепей.
Такой гомодимер также имеет свойство
взаимодействовать с молекулами MHC–I.
Во внеклеточной части каждая из -
и –цепей
имеют по одному иммуноглобулинподобному
домену. Между собой цепи соединены
дисульфидной связью. Цитоплазматические
участки цепей CD8
также связаны с тирозинкиназой Lck
(см. рис. 5.4).
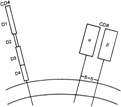
Рис.
5.5.
Структура
молекул
корецепторов
T–лимфоцитов —
CD4
и
CD8
(схема). Молекула CD4 —
полипептидная цепь, имеюшая 4 внеклеточных
домена. При вовлечении в функциональный
процесс молекула CD4,
вероятно, димеризуется. Молекула CD8 —
гетеродимер из –
и –цепей.
Почти
все лимфоциты (99%), дифференцирующиеся
на территории тимуса в постнатальной
жизни, — это T–лимфоциты с TCR;
менее 1% — T–лимфоциты с TCR.
В периферических тканях содержание T
больше 1% и составляет, возможно, 10–50%
всех T–лимфоцитов организма. Но
дифференцируется большинство T
не в тимусе, а в слизистых оболочках, в
первую очередь ЖКТ.
5.5. Дифференцировка T–лимфоцитов в тимусе. Позитивная и негативная селекция тимоцитов
Процессы дифференцировки, происходящие в тимусе, изучены достаточно подробно и представляют следующую последовательность событий.
Тимоциты
дифференцируются из общей стволовой
кроветворной клетки. На клетках–предшественницах
T–лимфоцитов ещё вне тимуса у человека
обнаружены такие мембранные маркёры,
как CD7,
CD2,
CD34
и цитоплазматическая форма CD3.
Коммитированная
к дифференцировке в T–лимфоцит
клетка–предшественница
мигрирует из костного мозга через стенку
венул в кортико-медуллярной области и
оттуда перемещается в субкапсулярную
зону коры тимуса. Здесь происходит
медленная пролиферация клеток —
примерно в течение 1 нед. Характерной
особенностью лимфоидных клеток–предшественниц
является сохранение в них экспрессии
уникального фермента стволовой
кроветворной клетки — теломеразы,
репарирующей
хромосомы. Это указывает на то, что
лимфоциту на его жизненном пути предстоит
ещё не раз пройти циклы пролиферации.
Клетки–предшественницы, коммитированные
к дифференцировке в другие ростки
кроветворения, утрачивают экспрессию
теломеразы необратимо. Из предшественников
лимфоидных клеток будут развиваться
T
(большинство), T
и дендритные клетки тимуса. На тимоцитах,
самыми ранними известными маркёрами
которых являются молекулы CD2
и CD7,
в этот период экспрессированы ещё такие
мембранные молекулы, как CD44
и CD25.
Затем
на клетках исчезают молекулы CD44
и CD25,
клетки физически перемещаются несколько
в глубь коры тимуса. В них начинаются
перестройка генов –цепи
TCR
и экспрессия полипептидного комплекса
CD3.
Экспрессируется инвариантная суррогатная
полипептидная цепь, называемая pT
(р — от partner —
партнёр, мол. масса 33 кД), которая
заменяет собой настоящую –цепь
и позволяет перестроенной –цепи
в комплексе с CD3
оказаться экспрессированной на наружной
клеточной мембране. На данной стадии
деградирует белок RAG2
и ингибируется транскрипция с генов
RAG1
и RAG2.
Клетки активно пролиферируют и
микроскопически выглядят как бласты.
При этом накапливается масса клеток с
уже готовой –цепью,
но с ещё неперестроенными генами –цепи,
что внесет свой вклад в будущее
разнообразие ––гетеродимеров.
В это же время экспрессируются совместно молекулы CD4 и CD8 (по этой причине тимоциты на этой стадии развития называют дважды позитивными — CD4+/ CD8+).
На
следующем этапе клетки перестают
делиться, синтезируют RAG1
и RAG2
и перестраивают V–гены,
причём несколько раз в течение 3–4 сут.
Каждый вариант TCR
с разной –цепью
клетка экспрессирует и «пробуется» на
связывание с комплексами «пептид–MHC»,
экспрессированными на мембранах
эпителиальных клеток тимуса. Обратим
внимание на то, что пептиды в данном
случае свои,
т.е.
являются продуктами катаболизма
собственных белков АПК. Тимоциты, которые
свяжут какой–либо из комплексов
«пептид–MHC» с правильной
(т.е.
средней по силе) аффинностью, получают
сигнал
на выживание и
продолжат дифференцировку. Тимоциты,
которые не свяжут никакой из доступных
комплексов «пептид–MHC», не получат
сигнала на выживание, и в них будет
инициирована программа на апоптоз, они
погибнут. Это и называют позитивной
селекцией тимоцитов.
В
результате позитивной селекции в тимусе
погибает около 90% тимоцитов.
Если какой-то TCR связывает какой-то комплекс «пептид–MHC» со слишком высокой аффинностью, то тимоцит также может погибнуть. Это называют негативной селекцией тимоцитов. В количественном отношении негативная селекция элиминирует существенно меньше тимоцитов, чем позитивная — от 10 до 70% клеток, которые прошли позитивную селекцию.
Неоднократная
перестройка и экспрессия генов –цепи
при одной и той же –цепи
в одном тимоците оставляет шанс на то,
что одна клетка может нести более одного
варианта TCR.
По крайней мере на моделях мышей,
трансгенных по генам
и –цепей,
закономерно обнаруживают второй вариант
Рц на T–лимфоцитах с эндогенной –цепью.
На короткое время с мембраны тимоцитов исчезают обе молекулы корецепторов CD4 и CD8, затем экспрессируется одна из этих молекул: на тимоцитах, TCR которых имеет сродство к молекулам MHC–I, экспрессируется корецептор CD8, и на периферии эти T–лимфоциты на всю свою жизнь будут иметь «паспортную» характеристику CD8+, или Т8. На тимоцитах, TCR которых имеет сродство к MHC–II, экспрессируется корецептор CD4, и на периферии такие T–лимфоциты будут CD4+, или Т4. Есть данные, полученные на экспериментальных моделях на мышах, показывающие, что один и тот же TCR (трансгенный), экспрессированный в паре с CD4, связывает пептид–Аг в комплексе с MHC–II, а экспрессированный в паре с CD8 распознаёт другой пептид–Аг в комплексе с MHC–I.
Анатомически процессы селекции проходят ближе к границе коркового и мозгового слоев тимуса при взаимодействии развивающихся тимоцитов с эпителиальными клетками стромы тимуса и с дендритными клетками костномозгового происхождения. На клетках эпителия тимуса экспрессированы молекулы адгезии LFA–3 и ICAM–1, а на тимоцитах — комплементарные им молекулы адгезии соответственно CD2 и LFA–1. Эти адгезивные взаимодействия удерживают тимоциты на территории тимуса на необходимый период времени. На эпителиальных и дендритных клетках мозговой зоны и на внешних структурах телец Гассаля (телец тимуса) экспрессирована в большом количестве мембранная молекула CD30L (CD30–лиганд). На тимоцитах же, активированных аутоантигенами, экспрессируется молекула CD30. Полагают, что именно взаимодействие CD30L с CD30 между стромой и тимоцитами, имеющими на мембране набор молекул CD4+CD8+CD45R0+CD30+ИЛ–4R+, обеспечивает сигнал на апоптоз для тимоцитов и это и есть негативная селекция аутореактивных клонов тимоцитов.
В кратком виде этапы дифференцировки T–лимфоцитов в тимусе приведены в табл. 5.2. Дифференцировка T–лимфоцитов в тимусе продолжается около 3 нед.
Таблица 5.2. Этапы дифференцировки T–лимфоцитов в тимусе
Анатомическая зона в тимусе |
Мембранный фенотип тимоцитов и их клеточное окружение |
Основные процессы, происходящие с тимоцитами |
Кора периферической зоны |
CD3–/CD4–/CD8– Эпителиальные клетки коры |
Интенсивная пролиферация (митозы) дважды негативных клеток–предшественниц |
|
TCR– Эпителиалъные клетки коры; дендритные клетки |
Экспрессия
|
Глубокие слои коры |
TCR– Эпителиальные клетки; дендритные клетки; макрофаги |
Дважды
позитивные (CD4+
и CD8+)
тимоциты с экспрессированной |
Граница коркового и мозгового вещества |
TCR– Эпителиальные клетки; дендритные клетки; макрофаги |
Дважды
позитивные тимоциты с полноценным
|
Мозговое вещество |
TCR– Эпителиальные клетки мозговой зоны |
Однопозитивные (либо CD4+, либо CD8+) зрелые неиммунные T–лимфоциты |
Рассмотрим некоторые подробности дифференцировки T–лимфоцитов в тимусе.
T
и T
происходят из общей клетки–предшественницы.
В развивающемся тимоците практически
одновременно начинается перестройка
генов ,
и –цепей.
Если обе
и –цепи
успеют перестроиться «in–frame»
(т.е. получится такая ДНК, с которой
возможна транскрипция РНК), то лимфоцит
будет T
.
Но если первой успеет перестроиться
–цепь
и экспрессироваться на мембране в паре
с pT,
то это становится сигналом к запрету
на продолжение перестройки генов
и ,
а также сигналом к пролиферации клетки,
экспрессии корецепторных молекул CD4
и CD8
и чуть позже к перестройке генов и
экспрессии –цепи.
При перестройке генов –цепи
происходит необратимая делеция –локуса,
который расположен внутри генов –цепи.
Непродуктивная с первой попытки
перестройка генов –цепи
не означает, что тимоцит обречен на
гибель. Структура генов –цепи
(см. рис. 5.2) позволяет предпринять ещё
одну попытку, и продуктивность перестройки
генов –цепи
превышает 80%.
Вероятный
лиганд для комплекса pT–
на мембране тимоцитов — молекула
CD81,
экспрессированная на эпителиальных
клетках стромы тимуса.
Перестройка
генов –цепи
происходит неоднократно, пока не
получится продуктивный вариант, причём
без аллельного исключения (т.е. параллельно
на обеих гомологичных хромосомах). До
этапа позитивной селекции на тимоцитах
могут быть экспрессированы два варианта
TCR
с одинаковыми ,
но разными –цепями.
Позитивная селекция оставит единственный
вариант Рц, но иногда может быть и не
единственный.
Позитивная селекция на удовлетворительное связывание с комплексами своих пептидов со своими молекулами MHC происходит на стадии развития тимоцитов с низкой плотностью экспрессии TCR и совместной экспрессией корецепторов CD4 и CD8. Клетки–партнёры тимоцитов в данном процессе, клетки–носители молекул MHC — это эпителиальные клетки стромы коры тимуса. Эпителиальные клетки тимуса продуцируют такие цитокины, как интерлейкины 1, 3, 6 и 7, LIF, GM–CSF. Они же, эпителиальные клетки тимуса, являются продуцентами внутритимического стероидного гормона, а именно прегненолона, участие которого необходимо в регуляции экспрессии генов в дифференцирующихся тимоцитах, в том числе в индукции апоптоза тимоцитов при позитивной и негативной селекции. (В эксперименте, если мыши ввести фармакологические дозы глюкокортикоидных гормонов, то за несколько часов произойдет «глюкокортикоидная тимэктомия» — более 99% тимоцитов погибнет апоптозом, от органа останется небольшая «плёночка», содержащая немного стероидрезистентных T–лимфоцитов).
В
качестве примера экспериментов, ставших
источником этих знаний, приведём опыты
с мышами — радиационными костномозговыми
химерами. Если летально облученным
реципиентам одной из родительских
линий, например гаплотипа MHCA,
трансплантировать клетки костного
мозга интактных доноров-гибридов MHCАB,
то дифференцированные в тимусе реципиента
(MHCA)
T–лимфоциты будут способны распознавать
Аг только в комплексе с молекулами MHCA,
но не MHCB.
«Профессиональные» АПК периферии — это клетки костномозгового происхождения, а именно дендритные клетки, B–лимфоциты и моноциты/макрофаги. Это поможет понять результаты следующего опыта. Если летально облученным мышам–реципиентам гаплотипа MHCВ трансплантировать костный мозг от доноров гаплотипа MHCA, то дифференцирующиеся в организме (в тимусе) реципиента T–лимфоциты оказываются неспособными развивать иммунный ответ в периферической лимфоидной ткани. В тимусе их «отобрали» на распознавание MHCВ, а представляют Аг им в организме АПК генотипа MHCA, т.е. «своего родного» для T–лимфоцитов, но они его «не приучены» распознавать: иммунорецепторы вообще распознают не «своё» и «чужое». Что будут, а что не будут распознавать антигенраспознающие Рц лимфоцитов, обусловлено не столько генетической программой, сколько конкретными ситуациями, возникающими в процессе онтогенеза.
Описанный выше эксперимент показывает, почему при трансплантации костного мозга у людей с лечебной целью строго необходимо совпадение по MHC: не столько для избежания отторжения трансплантата реципиентом, сколько для обеспечения возможности дифференцировки иммунокомпетентных T–лимфоцитов из стволовых клеток костного мозга донора в тимусе реципиента.
У мышей, трансгенных по перестроенному гену TCR, распознающему пептид в комплексе с MHC–I, все T–лимфоциты будут нести только этот трансгенный Рц и все T–лимфоциты в организме будут только CD8+. Если трансгенный TCR комплементарен Аг в комплексе с MHC–II, то все T–лимфоциты в организме такой мыши будут только CD4+.
Та же закономерная зависимость распознавательной ориентировки TCR либо на MHC–I, либо на MHC–II и экспрессии на зрелом лимфоците соответственно или CD8, или CD4 проявляется у людей с наследственным иммунодефицитным синдромом «голых лимфоцитов». Есть варианты этого синдрома, когда генетический дефект проявляется в отсутствие экспрессии на эпителиальных клетках тимуса и на лейкоцитах молекул MHC–I. У таких пациентов не обнаруживают CD8+ T–лимфоцитов. При вариантах синдрома с отсутствием экспрессии на клетках MHC–II у больных в периферических лимфоидных органах нет T–лимфоцитов CD4+.
Корреляция
экспрессии TCR
с молекулами CD8
и CD4
в описанном варианте сильная, но не
абсолютная. В организме есть и иные
субпопуляции T–лимфоцитов, например
TCR/CD4–/CD8–,
TCR/CD8
(молекула CD8
состоит из двух одинаковых –цепей,
т.е. гомодимер, а не гетеродимер из одной
–
и одной –цепи,
как в «классическом» варианте молекулы
CD8).
Кстати, T–лимфоциты именно с таким
фенотипом мембраны являются преобладающей
субпопуляцией среди внутриэпителиальных
лимфоцитов слизистой оболочки ЖКТ. Не
зависит от CD4
и CD8
и экспрессия TCR.
T–лимфоциты,
экспрессирующие CD4,
и T–лимфоциты, экспрессирующие CD8,
предназначены для выполнения разных
функций в
предстоящих иммунных ответах. Но во
всех случаях независимости TCR
от CD4
или CD8
лимфоциты с такими TCR
распознают Аг независимо от MHC–I/II.
Правда, это не означает (по крайней мере
не всегда очевидно) независимость
распознавания Аг от других молекул,
способных представлять Аг, но не
являющихся ни MHC–I,
ни MHC–II. Примером таких антигенпредставляющих
молекул является CD1.
Если молекулы MHC–I
и II
«работают» (т.е. формируют комплексы)
исключительно с пептидными Аг, то
«неклассические молекулы MHC»
специализируются на комплек-сообразовании
с Аг другой химической природы —
небелковой (углеводными, липидными,
фосфатсодержащими). С молекулами кластера
CD1
взаимодействуют особые субпопуляции
зрелых T–лимфоцитов, а именно «дважды
негативные» TCR+/CD3+/CD4–/CD8–
и особая субпопуляция TCR+/CD3+/CD8+.
Процессы
негативной селекции тимоцитов идут при
взаимодействии их с профессиональными
АПК — дендритными и макрофагами, что
иллюстрируют эксперименты с костномозговыми
радиационными химерами мышей. Если
реципиентов любой из родительских линий
(MHCA
или MHCB)
летально облучить и трансплантировать
им костный мозг от гибридов MHCАB,
то в тимусе таких мышей будут развиваться
T–лимфоциты, не отторгающие кожный
лоскут ни от донора MHCA,
ни от донора MHCB,
т.е. развивается толерантность к Аг как
реципиента, так и донора, которые в
тимусе могут быть представлены только
на тимоцитах, дендритных клетках и
макрофагах. При некоторых комбинациях
линий мышей в таких экспериментах кожный
трансплантат, однако, отторгается. Это
объясняют тем, что для отторжения ткани
существенны и неглавные
Аг гистосовместимости
(англ.
minor
histocompatibility
antigens),
которые в данном случае присутствуют
в ткани донорской кожи, но не присутствуют
на донорских АПК в тимусе и на уровне
дифференцировки лимфоцитов в тимусе
толерантность к ним не возникает.
Неглавные Аг гистосовместимости при
отторжении трансплантатов у людей
иногда имеют большее значение, чем Аг
главного комплекса гистосовместимости,
что будет проиллюстрировано в
соответствующем разделе.
Созревшие в тимусе T–лимфоциты мигрируют в T–зоны периферических лимфоидных органов. Путей выхода тимоцитов из тимуса на основании гистологических наблюдений можно предполагать три: а) свободный — через эфферентный лимфатический сосуд в кортико-медуллярной зоне; б) путём экстравазации через стенку посткапиллярных венул с высоким эндотелием там же в кортико-медуллярной зоне; в) путём экстравазации через стенку капилляров в русле транскапсулярных артерий.
Базовым
свойством лимфоцитов является
самораспознавание
в
смысле распознавания клеток своего
организма. Теперь это можно понять
несколько лучше: дифференцировка и
отбор
антигенраспознающих
Рц T–лимфоцитов в тимусе идут при
взаимодействии (комплементарном
связывании) исключительно с эндогенными,
т.е. со своими
молекулами
MHC в комплексе со своими,
но
разнообразными пептидами. Приведём
совпадающее с нашим мнение авторитетного
экспериментатора и теоретика Ч. Джейнвэя
и его коллег. Опыты на мышах, трансгенных
по гену –цепи
TCR,
а также с нокаутом по определённому
гену MHC (Н–2Ма)
в разных аранжировках привели этих
авторов к заключению (гипотезе, но
обоснованной), что не только в тимусе в
процессе лимфопоэза идёт отбор
T–лимфоцитов на способность правильно
связывать своим TCR
комплексы «свои пептиды — MHC», но и
на периферии жизнеспособность T–лимфоцитов
в течение длительного времени
поддерживается сигналами
на выживание от
тех
же комплексов
«свои пептиды — MHC», экспрессированных
на дендритных клетках в T–зависимых
зонах периферических лимфоидных органов.
В отсутствие такого сигнала T–лимфоцит
быстро погибает. Более того, такой свой
сигнал
поддерживает некий «базальный» уровень
активации и, возможно, пролиферации
жизнеспособных T–лимфоцитов на периферии
в течение всей жизни организма. Но эта
пролиферация отличается от экспансии
клона лимфоцитов в процессе развития
активного продуктивного иммунного
ответа на Аг, подлежащий элиминации из
организма. Пролиферация по сигналу от
своего
в
норме не сопряжена с синтезами и секрецией
активных цитокинов T–лимфоцитов и
индукцией иммунного воспаления. Таким
образом можно объяснить и понять то
реально существующее явление, что после
15-летнего возраста, когда T–лимфопоэз
в тимусе существенно угасает, тем не
менее в течение всей взрослой жизни в
организме есть, причём достаточно
постоянное (не снижающееся прогредиентно
с возрастом) количество периферических
T–лимфоцитов.
Репертуар распознающих Рц периферических T–лимфоцитов зависит от MHC организма. Исходная биологическая комплементарностъ Рц T–лимфоцитов рассчитана именно на молекулы MHC всех клеток собственного организма.
В
функциональном отношении зрелые
неиммунные T–лимфоциты,
выходящие из тимуса, представлены двумя
основными субпопуляциями: одна из них
несет на мембране молекулу CD8,
вторая — CD4.
CD8+
T–лимфоциты дифференцированы для
выполнения функций цитотоксических
T–лимфоцитов
(ЦТЛ).
ЦТЛ сами непосредственно, своим «клеточным
телом» (их называют «перфорин–гранзимовыми
киллерами»), убивают клетки (поэтому
«ц» — от цито-), на мембране которых они
распознали Аг. CD4+
T–лимфоциты дифференцированы в
потенциальных продуцентов
цитокинов — секретируемых
из клетки биологически активных молекул,
предназначенных для взаимодействия и
вовлечения в процесс других клеток–партнёров
по иммунному ответу. CD4+
T–лимфоциты около 30 лет назад назвали
лимфоцитами–хелперами (helper —
помощник), поскольку эксперименты
свидетельствовали, что B–лимфоциты
не способны продуцировать АТ без
помощи T–лимфоцитов,
хотя сами T–лимфоциты не синтезируют
иммуноглобулины, но B–лимфоциты
без участия T–лимфоцитов
их тоже не синтезируют либо совсем, либо
синтезируют иммуноглобулины только
класса М. За CD4+
T–лимфоцитами закрепилась аббревиатура
Th
(от T–helper).
Однако впоследствии среди Т4–лимфоцитов
обнаружены и перфорин–гранзимовые
ЦТЛ.
Определённое разнообразие дифференцировки CD4+ T–лимфоцитов в процессе развития иммунного ответа называют иммунным отклонением — отклонением иммунного ответа в сторону той или иной функциональной субпопуляции. В генетически здоровом организме отклонение иммунного ответа зависит от внешних факторов: в первую очередь химических качеств Аг, его дозы, пути попадания во внутреннюю среду, сопутствующих факторов типа адъювантов или инфекций, кратности иммунизации и т.д.
Хотя опухоли — образования патологические, но они позволяют составить представление о нормальных субпопуляциях клеток той или иной ткани. В клинике известны нозологические единицы опухолей из клеток тимуса (табл. 5.3).
Таблица 5.3. Опухоли тимуса: из T–лимфоцитов и АПК
Болезнь |
Тип клеток |
Маркёры на мембране |
Локализация |
Острый лимфо-бластный лейкоз |
Ранний предшественник лимфоцитов |
CD10; CD19; CD20 |
Тимус, кровь, костный мозг |
Тимома |
Эпителиальные клетки стромы тимуса |
Цитокератины |
Тимус |
Острый лимфо-бластный T–лейкоз |
Тимоциты |
CD1 |
Тимус, кровь |
Синдром Сезари*; T–лейкоз взрослых (HTL V–1); mycosis fungoides; Хронический T–лейкоз |
Та или иная субпопуляция зрелых T–лимфоцитов*** |
CD3+/TCR; CD4 или CD8 |
Периферические лимфоидные органы, кровь |
Болезнь Ходжкина** |
АПК (моноциты) |
CD30 |
Периферические ткани |
* Синдром Сезари называют ещё эксфолиативным дерматитом. Он характеризуется сильным зудом, инфильтрацией кожи атипичными мононуклеарными клетками, алопецией, отёком, изменённой пигментацией кожи, изменениями ногтей.
** Болезнь Ходжкина разнообразна по клиническим формам. В основе патогенеза — опухолевая трансформация АПК, вероятнее всего, моноцитов. Но опухолевые АПК стимулируют пролиферацию T–лимфоцитов, и их количество может существенно превосходить нормальные показатели в крови и в тканях. Поэтому болезнь называют лимфомой Ходжкина. В некоторых случаях лимфо-пролиферация отсутствует. Пролиферируют ретикулярные стромальные клетки, и клинически эту форму идентифицируют как узелковый склероз (nodular sclerosis). Прогноз более благоприятен при лимфоме Ходжкина, чем при узелковом склерозе.
***Клональность лимфомы диагностируют анализом генов TCR в опухолевых клетках. Если планируют аутотрансплантацию костного мозга после радио- или химиотерапии, то методом ПЦР важно показать отсутствие генов TCR опухолевого клона в ткани костного мозга.
5.6. Главный комплекс гистосовместимости
«Главный комплекс гистосовместимости» (Major Histocompatibility Complex — MHC) — одно из трудных понятий для начинающих изучать иммунологию. Главная причина этого — оторванность названия от природного предназначения. Эта оторванность объясняется историей развития наших знаний о MHC. Так сложилось, что сначала MHC был выявлен в сугубо искусственной модели трансплантации тканей и органов одного организма во внутреннюю среду другого как некий значительный по размеру комплекс генов, от которых больше, чем от других, зависит скорость отторжения трансплантата. Но поскольку в естественной природе нет процессов трансплантации тканей отдельных особей во внутреннюю среду других особей, много лет имело место молчаливое недоумение — зачем нужны эти гены и продукты, которые они кодируют, организмам, которым не пересаживают и никогда не будут пересаживать чужие органы? Это недоумение разрешили Р. Цинкернагель и П. Дохерти, открывшие в 1973–1974 гг. природные функции белков MHC — представлять для распознавания пептидные Аг для T–лимфоцитов.
Гены MHC были открыты и был введён этот термин в работах 40-х годов в лаборатории, а затем институте Джорджа Снелла — знаменитого иммуногенетика. Иммуногенетики затратили много труда на выведение инбредных линий мышей и подтвердили основные законы трансплантации. Главный закон трансплантации, состоящий в том, что природа не рассчитана на смешение органов уже рожденных особей и пересаженные органы от другого организма в норме всегда отторгаются, люди знали, судя по всему, всегда, сколько существует человеческая культура. Давно знали, что пересадки тканей своего организма в пределах своего организма возможны: пластические операции с аутотрансплантацией описывали средневековые хирурги.
Применительно к генетическим отношениям доноров и реципиентов используют следующие термины:
аутологичный —
свой собственный;
сингенный
(или изогенный) — полностью генетически
идентичный организм (трансплантат).
Сингенны мыши одного пола одной инбредной
линии. Сингенны однояйцевые близнецы;
аллогенный —
другой организм в пределах одного вида.
Аллогенны мыши разных инбредных линий;
конгенный —
организм, отличающийся от другого одним
(в идеале) геном при одинаковости всех
других;
ксеногенный —
организм другого биологического вида.
«Мышиные» иммуногенетики 60-х годов XX в., изучавшие главный комплекс гистосовместимости, несколько иными словами сформулировали те же законы трансплантации, которые в 1912 г. описал Георг Шёне в своей книге «Гетеропластическая и гомопластическая трансплантация»:
аллогенные
и ксеногенные трансплантаты всегда
отторгаются;
аутологичные
и сингенные трансплантаты приживаются.
Гибриды
1–го поколения — F1
(P1P2)
не отторгают трансплантаты обеих
родительских линий (P1,
P2),
но каждая из родительских линий отторгает
трансплантат от гибрида (это свидетельствует
о кодоминантности в гибридах экспрессии
генов, кодирующих продукты, которые
являются мишенью отторжения).
Кодоминантность означает, что
экспрессируются аллели обеих гомологичных
хромосом (т.е. от каждого из родителей):
ААBB
AB
50%
потомства от обратного скрещивания
(F1P1/2)
быстро отторгают трансплантат от второй
родительской линии (в случае трансплантации
кожного лоскута быстрое отторжение
наступает на 8-е сутки). Отсюда по законам
менделевской генетики следует, что
быстрое отторжение контролирует один
локус. Его-то
Снелл и назвал главным комплексом
гистосовместимости (MHC).
АBAA
AA,
AA,
AA, AB, AB
У мышей локус MHC сегрегируется вместе с геном, кодирующим некий Аг, выявляемый АТ на эритроцитах мышей. Этот Аг в то время называли «Аг–2». Локус, контролирующий гистосовместимость, обозначили Н–2 (Н — от Histocompatibility — гистосовместимость). Верхний буквенный индекс при Н–2 (Н–2а, H–2k, H–2d и т.д.) означает гаплотип данного локуса. У различных инбредных линий гаплотип Н–2 может быть разным или одинаковым.
Локус
MHC весьма значителен по размеру —
порядка 4106
пар
нуклеотидов (это 2–3 сентиморгана), что
соизмеримо с целым геномом бактерии
Escherichia
coli.
Такое количество ДНК у человека содержит
около 100 генов. Далеко не все из этих
генов и их продуктов описаны и
идентифицированы. У мышей выявлены 3
независимых локуса в комплексе MHC —
Н–2К, H–2D
и H–2L.
Позже между ними картировали локусы
I–A
и I–Е
(I
от immune
response
genes —
гены иммунного ответа). В 60-х годах Барух
Бенацерраф
и др. в опытах на морских свинках
установили, что интенсивность продукции
АТ к белковым Аг контролируется
аутосомными генами из комплекса MHC.
Аналогичное явление ясно обнаруживалось
и в опытах на мышах разных инбредных
линий.
Гомологичный комплекс локусов у человека идентифицировали уже другие исследователи (Жан Доссе и др.) и не в экспериментах по трансплантации, а в исследованиях реактивности АТ из крови людей, перенесших трансплантации, или многорожавших женщин с лейкоцитами из крови других людей. Поэтому комплекс обозначили HLA (от Human Leukocyte Antigen — антигены лейкоцитов человека). Первые 3 Аг, выявленные в этих серологических реакциях (и соответствующие гены), обозначили HLA–A, HLA–B, HLA–C. Следующий локус обнаружили не серологически, а по индукции пролиферации в смешанной культуре лимфоцитов донора и реципиента; его обозначили HLA–D. Следующий идентифицированный серологически локус был близко сцеплен с HLA–D, его обозначили HLA–DR (от D–related). Следующие два локуса обозначили соседними с R буквами P и Q — HLA–DP и HLA–DQ.
Позже, когда выяснили, какие именно белковые продукты кодируют разные структурные гены из комплекса MHC, комплекс разбили на два класса — I и II — MHC–I, MHC–II. К классу I у человека отнесли локусы HLA–A, HLA–B и HLA–C, к классу II — соответственно HLA–DR, HLA–DP и HLA–DQ. Схема расположения в геноме локусов комплекса MHC человека показана на рис. 5.5.

Рис. 5.6. Расположение генов MHC человека в хромосоме 6 (схема).
Продукты генов локусов MHC–I — мембранные белки, конститутивно экспрессированные на всех ядросодержащих клетках тела, кроме сперматозоидов, но в разных количествах на клетках различных гистотипов: больше всего этих молекул на лимфоцитах и лейкоцитах. MHC–II — тоже мембранные молекулы, но экспрессированы не на всех, а только на некоторых гистотипах клеток — на дендритных клетках, B–лимфоцитах, моноцитах/макрофагах, эндотелии сосудов. Первые 3 типа клеток относят к так называемым профессиональным АПК — это дендритные клетки, B–лимфоциты и макрофаги, поскольку на этих клетках, кроме молекул MHC–II и I, экспрессируются все необходимые корецепторные молекулы и цитокины, достаточные для активации T–лимфоцита к иммунному ответу (табл. 5.4).
Таблица 5.4. Относительные уровни экспрессии MHC–I и II на разных клетках
Клетки |
MHC–I |
MHC–II |
T–лимфоциты |
+++ |
+ (у человека) |
B–лимфоциты |
+++ |
+++ |
Дендритные клетки |
+++ |
+++ |
Макрофаги |
+++ |
+ |
Эпителий тимуса |
+ |
+++ |
Эндотелий |
+ |
+ |
Нейтрофилы |
+++ |
Нет |
Гепатоциты |
+ |
Нет |
Клетки почки |
+ |
Нет |
Нейроны мозга |
+ |
Нет |
Эритроциты |
Нет |
Нет |
Примечание. Количественная выраженность того или иного свойства представлена в условных знаках: «+» — немного; «++» — больше, чем «+"; «+++» — больше, чем «++».
Эндотелий тоже выполняет функции АПК, но особого предназначения. Вероятно (есть такие экспериментальные данные), экспрессия комплексов Аг–пептидов с MHC на клетках эндотелия является тем специфическим сигналом, который «заманивает» иммунные лимфоциты из циркулирующей крови в больное, поражённое патогеном место в тканях (обеспечивает антигенспецифичный хоминг).
Каждый
локус MHC–I
кодирует полипептидную цепь, обозначаемую
традиционно ,
с мол. массой около 44 тыс., примерно из
325 остатков АК. Цепь
имеет 3 внеклеточных домена (1,
2,
3),
трансмембранный участок и цитоплазматический
участок из 55 АК–остатков. С внеклеточными
–доменами
нековалентно ассоциирована лёгкая
полипептидная цепь с мол. массой 12 тыс.,
называемая 2–микроглобулином.
Микроглобулин 2
кодируется геном, не сцепленным с MHC.
Домены 1
и 2
формируют углубление (щель) размером
около 2,5 нм. Именно в этом углублении
располагается пептид–Аг, предназначенный
для распознавания T–лимфоцитами. Пептид
ни в коем случае не сорбируется на MHC
извне клетки, а конъюгирует с –цепью
нековалентными связями, но с достаточной
аффинностью (Kd
10–6
М)
внутри клетки при фолдинге (сворачивании,
т.е. изменении конформации MHC). Как и все
трансмембранные белки, MHC–I
гликозилированы; места гликозилирования
–цепи —
Asn
86, Asn
176, Asn
256.
MHC–I связывает пептиды длиной 8–10 АК–остатков, фиксируя пептид по обоим концам молекулы — С и N. Молекулы MHC разных аллельных вариантов связывают пептиды с определёнными остатками АК в так называемых якорных позициях: это C–концевой остаток и 2-й или 5-й остаток с N–конца. Важно, что каждый конкретный аллельный вариант молекулы MHC связывает пептиды с данными, а не другими якорными остатками АК. Другой аллельный вариант MHC имеет химическое сродство к иным якорным остаткам АК. Поэтому важно посчитать, сколько же вариантов MHC имеет каждый отдельный человек, так как только на те пептиды, которые способны связать MHC особи, данная особь потенциально способна развить защитный иммунный ответ. Если же некий Аг не связывается ни с одним вариантом MHC из тех, которыми располагает особь, то против этого Аг не будет иммунного ответа, организм беззащитен перед таким Аг. Отсюда понятно, что генетический контроль иммунного ответа сильно зависит не только от генов, специально экспрессирующихся в лимфоцитах и АПК, но и от генов, экспрессирующихся во всех клетках организма, — MHC. Исключение составляют безъядерные зрелые эритроциты и сперматозоиды:на них нет ни MHC–I,ни MHC–II.
Белки
MHC–II (класса II) —
мембранные молекулы — гетеродимеры
из двух трансмембранных гликопротеинов:
–цепь
(мол. масса 34 тыс.) и –цепь
(мол. масса 29 тыс.). Внеклеточная часть
каждой цепи имеет два домена.
Пептидсвязывающее углубление (щель)
формируют совместно 1-
и 1–домены,
в отличие от аналогичного углубления
в составе MHC–I
щель MHC–II открыта
с
обеих сторон (рис. 5.7). Стереохимическая
открытость углубления MHC–II позволяет
связывать более длинные пептиды, чем в
случае MHC–I, —
до 30 остатков АК. Однако чаще всего из
комплексов с MHC–II удаётся диссоциировать
пептиды размером 13–17 остатков АК.
Якорные остатки для большинства изученных
аллельных вариантов MHC–II находятся в
позициях 1; 4; 6 и 9.
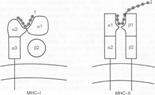
Рис.
5.7.
Структура
молекул
MHC–I
и
MHC–II
(схема). Молекулы MHC–I —
трансмембранные гетеродимеры: –цепь
большая, имеет три внеклеточных домена.
«Щель» для связывания пептидом формируют
два терминальных домена –цепи
(1
и 2).
–Цепь
малого размера, в мембрану не внедряется,
с –цепью
ассоциирована нековалентно и её называют
2–миκроиммуноглобулином.
Молекулы MHC–II также трансмембранные
гетеродимеры. Полипептидные цепи
и
равновелики, обе пенетрируют мембрану,
у обеих по два внеклеточных домена и
«щель» для связывания пептидов формируют
внешние домены обеих цепей. 1 —
пептид–Аг в комплексе с MHC–I;
2 — пептид–Аг в комплексе с MHC–II.
5.7. Механизмы образования комплексов «пептид–антиген» с молекулами главного комплекса гистосовместимости
В
любой эукариотической клетке есть две
«зоны», или, как их принято называть от
английского, компартменты. Одна зона
связана с внешней внеклеточной средой
и это зона мембранных структур и везикул,
включающая в себя аппарат Гольджи,
эндоплазматический ретикулум, лизосомы,
эндосомы и фагосомы. Пептиды, образующиеся
в данной зоне, обслуживают
синтезируемые
клеткой молекулы MHC–II. Происхождение
пептидов везикул внеклеточное: они
образуются в результате протеолиза
белков, захваченных клеткой посредством
эндоцитоза или фагоцитоза. Эндосомы
или фаголизосомы, сливаются с мембранными
структурами, на которых фиксируются
вновь синтезированные на полирибосомах
молекулы -
и –цепей
MHC–II и ещё одна так называемая инвариантная
полипептидная цепь — Ii.
Эта цепь «прикрывает» MHC–II от связывания
с пептидами внутри эндоплазматического
ретикулума и в дальнейшем обеспечивает
экспозицию молекул MHC–II внутрь везикул —
эндосом или фаголизосом. Комплекс из 3
тримеров Ii
в эндоплазматическом ретикулуме
удерживается связью с кальнексином. В
мембранных внутриклеточных структурах
есть специальный компартмент М–II–С,
в который физически упираются эндосомы
и лизосомы с поглощённым внеклеточным
содержимым. И только с участием пептида
молекула
MHC–II принимает правильную
конформацию, продвигается
к мембране и экспрессируется на ней.
«Чистые» молекулы MHC классов I
и II
на мембране клетки не экспрессируются.
Если клетка не располагает достаточным
количеством чужого пептидного материала,
то молекулы MHC–II связывают короткий
фрагмент, образующийся при протеолитическом
расщеплении инвариантной цепи —
CLIP.
В наслоении пептида на MHC–II участвует
ещё одна молекула — HLA–DM.
HLA–DM
на какое-то время стабилизирует пустые
молекулы MHC–II (без пептида). Отсюда
понятно, почему представление
Аг именно молекулами MHC–II происходит
при развитии защитных иммунных реакций
на внеклеточные
и везикулярные инфекции. Поскольку
комплексы антигенов–пептидов с
молекулами MHC–II распознают исключительно
CD4+
T–лимфоциты, то и в защите от внеклеточных
и везикулярных инфекций главную роль
играют реакции, обеспечиваемые именно
CD4
T–лимфоцитами (рис.
5.8).
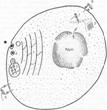
Рис. 5.8. Строение клетки и «зоны обслуживания» молекулами MHC–I и MHC–II (схема). 1 — зона (или компартмент) мембранных структур клетки (везикулы, эндоплазматический ретикулум, аппарат Гольджи). Эта зона непосредственно сообщается с внеклеточной средой; 2 — зона (или компартмент) цитозоля непосредственно сообщается с внутриядерным содержимым; 3 — протеасомы в цитозоле; 4 — фагосомы; 5 — фаголизосомы сливаются с везикулами, содержащими несконформированные молекулы MHC–II; 6 — комплекс MHC–II — пептид «внеклеточного» происхождения экспрессирован на мембране клетки; 7 — несконформированные молекулы MHC–I в зоне досягаемости пептидов с протеасом; 8 — комплекс MHC–I — пептид «внутриклеточного происхождения» экспрессирован на мембране клетки.
Вторая «зона» в клетке — зона цитозоля — неструктурированного мембранами внутриклеточного содержимого. Цитозоль непосредственно сообщается через крупные ядерные поры с содержимым ядра. В ядре идут процессы транскрипции РНК с ДНК (как нормальные клеточные, так и вирусные при вирусных инфекциях клеток). РНК из ядра транспортируется для трансляции белка в цитозоль на полирибосомы, и для фолдинга (принятия правильной конформации) белков под контролем шаперонов («катализаторов» принятия полипептидной цепью биологически значимой конформации) полипептидные цепи направляются в специальные участки эндоплазматического ретикулума. Лишние, испорченные, неправильно конформированные белки постоянно расщепляются в цитозоле так называемыми протеасомами. Протеасомы — это мультипротеазные комплексы из 28 СЕ, каждая из которых имеет молекулярную массу 20 тыс. или 30 тыс. Два из 3 вариантов СЕ протеасом — LMP2 и LMP7 — кодируются генами, расположенными внутри комплекса MHC.
Протеасомы осуществляют зависимую от убиквитина деградацию белков цитозоля. И именно пептиды, образующиеся в результате работы протеасом, поступают в «поджидающие» их в нужном месте эндоплазматического ретикулума ещё несконформированные молекулы MHC–I: вступая в связь с пептидом, молекулы MHC–I принимают биологически правильную конформацию и направляются для экспрессии на клеточную мембрану. Исследование мутаций и генетических дефектов, приводящих к иммунодефицитным состояниям, выявило зависимость представления Аг молекулами MHC–I от двух АТФ–связывающих транспортёров TAP–1 и TAP–2. В мембране эндоплазматического ретикулума эти два полипептида формируют гетеродимер, ориентированный гидрофобными участками в полость ретикулума, а АТФ–связывающими доменами — в сторону цитозоля. Именно они доставляют пептиды для связывания с молекулами MHC–I. TAP имеют сродство к пептидам с гидрофобными или основными остатками АК на C–конце. Гены TAP–1 и TAP–2 расположены внутри комплекса MHC.
Вновь
синтезированная –цепь
MHC–I
вступает в связь с мембранным протеином
эндоплазматического ретикулума
кальнексином (мол. масса 88 тыс.), который
обеспечивает частичный фолдинг –цепи.
Кстати, тот же кальнексин образует
комплексы с вновь синтезированными и
частично сконформированными полипептидами
MHC–II, TCR,
иммуноглобулины (т.е. всеми иммунологически
значимыми молекулами). При присоединении
к –цепи
2–микроглобулина
связь с кальнексином диссоциирует, и
комплекс 2
присоединяется для дальнейшего
прохождения процесса приобретения
конформации к кальретикулину
эндоплазматического ретикулума и
TAP–1–ассоциированному протеину тапасину.
Таким образом создаются условия для
соединения пептида–Аг с принимающим
конформацию комплексом MHC–I.
При генетических дефектах в TAP молекулы
MHC деградируют внутри клетки, не попадая
на клеточную мембрану. В норме в клетке
молекулы MHC–I
присутствуют в избытке по отношению к
пептидам. Поэтому в клетке при вирусных
инфекциях довольно быстро пептиды
вирусного происхождения оказываются
представленными на поверхности заражённых
клеток в составе комплексов с MHC–I.
Молекулы MHC–I представляют для распознавания T–лимфоцитам внутриклеточно синтезированные пептидные Аг. В плане защиты от инфекции этот механизм работает применительно в первую очередь к вирусным, а также цитозольным бактериальным внутриклеточным инфекциям. Поэтому CD8+ T–лимфоциты «рассчитаны» в первую очередь на обеспечение противовирусной защиты, так как в комплексе с MHC–I именно и только CD8 T–лимфоциты распознают пептидные Аг.
В отсутствие инфекций молекулы MHC–I и MHC–II формируют комплексы с эндогенными (собственными) пептидами. Обратим внимание на то, что дифференцировка T–лимфоцитов в тимусе в норме в стерильном изнутри организме идёт при взаимодействии отбираемых TCR со своими пептидами, а не на отборе «своего и чужого». Поэтому естественно, что среди случайно формируемого разнообразия вариантов антигенсвязывающих структур даже после позитивной и негативной селекции тимоцитов среди выходящих на периферию T–лимфоцитов обязательно найдутся TCR, способные специфично связываться, наверное, со всеми собственными «Аг». Опыт показывает, что так оно и есть. Но деструктивный иммунный ответ на собственные Аг в норме не развивается, и в дальнейшем мы обсудим то, что известно о механизмах периферической толерантности.
Стабильное связывание Аг молекулами MHC внутри клетки при формировании собственной конформации, а не простая сорбция из раствора Аг снаружи уже экспрессированными на мембране молекулами MHC, обеспечивает направление T–лимфоцитарного иммунитета на реально инфицированные клетки тела.
Иммунное воспаление, управляемое активными T–лимфоцитами, — это наиболее «энергичное» воспаление по сравнению с другими вариантами, и такое воспаление нельзя «натравливать» на ложные мишени, иначе организм будет не направленно избавляться от инфекции, а страдать от неоправданно разлитой альтерации тканей.
Взаимодействие TCR с комплексом «пептид–MHC–I/II» изображено на рис. 5.9.

Рис.
5.9.
Взаимодействие
TCR
с
комплексом
«MHC–пептид»
на
антигенпредставляющей
клетке
(АПК) 1 — АПК (например, дендритная);
2 — CD4+
T–лимфоцит; 3 — MHC–II; 4 — пептид
(собственно Аг); 5 — -
и –цепи
TCR;
6 — молекула CD4.
5.8. Суперантигены
В
борьбе за своё существование инфекционные
микроорганизмы «научились» синтезировать
некие вещества, которые поступают с
«нашими» T–лимфоцитами «не по правилам».
Эти вещества называют суперантигенами.
Когда
они попадают в организм, то последний
не может встретить их попыткой
распознавания специфическим TCR
потому, что суперантигены благодаря
своим особым химическим свойствам
способны присоединяться снаружи
клетки (т.е.
без процессинга в АПК) с одной стороны
к молекулам MHC–II, но не в области «клефта
для пептида», а «сбоку», как правило, к
–цепи,
и одновременно к V–области
–цепи
TCR
на T–лимфоците.
Это связывание вызывает активацию T–лимфоцитов, но не антигенспецифичного клона, а поликлональную. Обычно суперантигены активируют 2–20% периферических CD4+ T–лимфоцитов. В результате многие T–лимфоциты продуцируют и секретируют активационные цитокины, что вызывает синдром общей интоксикации в организме. А затем активированные T–лимфоциты погибают путём апоптоза. Таков закон лимфоцитарного иммунитета: на свой ли Аг или неспецифически, но единожды активированный лимфоцит обречен на апоптоз (феномен индуцированной активацией клеточной смерти). (Феномен иммунологической памяти — особое явление, и хотя оно исключительно характерно именно для лимфоцитарного иммунитета, механизмы его непонятны до настоящего времени). Но фактом является то, что после поликлональной активации лимфоцитов наступает физический дефицит лимфоцитов, следовательно, иммунодефицит.
Известны суперантигены бактериального и вирусного происхождения, такие как энтеротоксины стафилококков, токсин синдрома токсического шока, мембранный белок вируса опухолей молочных желёз мышей, мало охарактеризованные суперантигены вирусов Эпштейна–Барр, вируса бешенства, вирусов иммунодефицита человека (ВИЧ) и животных и многие другие. Клиника пищевых отравлений, например, обязана главным образом действию энтеротоксинов стафилококков на T–лимфоциты. Иммунодефицит в ранние сроки (и в поздние тоже) ВИЧ–инфекции в значительной мере объясняется лимфотоксическим действием суперантигенов ВИЧ.
5.9. Генетический полиморфизм главного комплекса гистосовместимости
Итак, в случае T–лимфоцитов комплекс «пептид–Аг» связывается не только с Рц T–лимфоцита для Аг, но и (причём по времени «до» T–лимфоцита) с молекулами MHC Аг–представляющих клеток. Разнообразие TCR природа создаёт комбинаторикой сегментов ДНК — уникальным процессом рекомбинации ДНК в соматических клетках. А как молекулы MHC приспособлены к открытому множеству заранее неизвестных Аг? Иначе, чем TCR и иммуноглобулины. Рекомбинации ДНК в генах MHC нет. Каждый человек наследует определённый набор генов MHC, один и тот же на всю жизнь. Гены MHC кодоминантны. Это значит, что на равных экспрессируются гены обеих гомологичных хромосом — от матери и от отца.
Гены MHC полигенны, т.е. существует не один, а несколько локусов классов I и II внутри комплекса MHC. Ещё есть и так называемые неклассические гены, правильнее их было бы назвать не принадлежащими к ранее охарактеризованным классам MHC I и II. Сколько же генов MHC? Этот участок генома картирован не полностью, но то, что известно о нем, показано на рис. 5.5.
Таким образом, генов MHC–I по 3 на каждой из гомологичных хромосом (А, В, С), следовательно, в сумме их 6. Генов MHC–II также по 3 на каждой из гомологичных хромосом (DP, DQ, DR), следовательно, в сумме их тоже 6. Если у матери и отца нет одинаковых аллелей, то каждый человек имеет 12 генов MHC классов I и II, вместе взятых. Неклассических генов MHC в области расположения генов класса I описано 6 (Е, F, G, Н, J, X). Возможно, будут открыты и новые гены. Неклассические гены MHC, видимо, неполиморфны или не столь полиморфны, как гены классов I и II.
Известны гены за пределами MHC, кодирующие молекулы, которые обеспечивают представление Аг T–лимфоцитам. Примером такой молекулы (и гена соответственно) является CD1, способная связывать и представлять T–лимфоцитам небелковые Аг (например, миколевую кислоту и липо-арабиноманнан оболочки микобактерий).
Описаны неполиморфные молекулы и из области MHC–II — DM и DQ. Функции HLA–DM в какой-то мере известны: стабилизация молекул MHC–II внутри клетки во время «ожидания» смыслового пептида и «катализ» присоединения к MHC–II смыслового пептида, а также генерация «протезного» CLIP–пептида. Гены полипептидных цепей, формирующих молекулу DQ, экспрессируются, по-видимому, только в тимусе и B–лимфоцитах, но функции этой молекулы неизвестны.
Полиморфизм классических генов MHC (классов I и II) означает наличие в популяции множества аллелей — вариантов одноимённого гена у разных особей.
Поэтому разные люди, неродственники, имеют различные аллели одноимённых генов и, следовательно, разные белки MHC на мембранах своих клеток. Вероятность существования одинаковых аллелей у неродственников, тем более совпадения по всем или многим локусам тем меньше, чем больше полиморфизм в популяции. Полиморфизм генов MHC признан наибольшим из всех известных генов человека.
Полиморфизм этих генов в популяции выгоден для выживания вида: не у одного, так у другого человека в популяции организм может быть сумеет представить T–лимфоцитам своим вариантом молекул MHC Аг того или иного (в том числе и из вновь возникающих) инфекционного микроорганизма. Но вот каждый конкретный человек либо сумеет, либо нет воспринять конкретный микробный Аг и если не сумеет, то не сможет защититься от данного микроба иммунным ответом и инфекция может убить его.
Конкретные варианты MHC закрепляются в эволюции естественным отбором (в отличие от TCR и иммуноглобулинов), и каждая отдельная особь оказывается приспособленной к регионарным видам и штаммам инфекционных микроорганизмов, на защиту от которых шел отбор MHC у предков.
Для отдельных локусов MHC известно более сотни аллельных вариантов, и поскольку далеко не каждый человек на Земле типирован по MHC, привести точное число аллелей нельзя. Международные банки данных располагают сведениями не менее чем о 349 аллелях HLA–A, 647 аллелях HLA–B, 182 аллелях HLA–C, 108 аллелях HLA–DPB1, 28 аллелях HLA–DQA1, 61 аллеле HLA–DQB1, 394 аллелях HLA–DRB1 и 81 аллеле HLA–DRB2.
Каждый отдельный аллельный вариант молекулы MHC преимущественно связывает пептиды с определёнными якорными АК–остатками.
От 1 до 10% T–лимфоцитов любого здорового организма реагируют активацией при контакте с аллогенными по MHC клетками. На любой случайный Аг, однако, реагирует гораздо меньшее число T–лимфоцитов антигенспецифичных клонов. Столь высокий уровень аллореактивности T–лимфоцитов оставался непонятным (учитывая отсутствие в природе пересадок органов и тканей) до открытия двойного распознавания Р. Цинкернагелем и П. Дохерти. Тогда стало возможным предполагать, что аллореактивность — результат перекрестной реактивности с не своими MHC TCR, отобранных при позитивной селекции в тимусе на связывание со своими MHC.
Поэтому приходится признать, что отторжение аллогенного трансплантата происходит в результате того, что 1–10% T–лимфоцитов реципиента «ошибаются», принимая донорские MHC за свои (перекрестно реагируют), тогда как 99–90% T–лимфоцитов реципиента «не видят» чужой трансплантат, поскольку на нем не те MHC, на связывание с которыми прошла позитивная селекция тимоцитов.
Почему же число генов MHC I + II у индивидуума 12 и не больше? Ведь чем больше было бы генов MHC, тем большее разнообразие Аг могли бы представлять АПК для распознавания T–лимфоцитам. Ограничение числа генов MHC можно объяснить механизмами позитивной и негативной селекции тимоцитов на связывание с MHC, представленными в тимусе во время и на месте лимфопоэза T–лимфоцитов.
Исследования
показывают, что из каждого подмножества
тимоцитов, оставленных живыми при
позитивной селекции на связывание с
конкретным вариантом молекулы MHC, 5%
будет элиминировано при негативной
селекции как слишком аутореактивные,
т.е. каждый вариант молекул MHC «стоит
жизни» 5% тимоцитов. На 12 вариантов
молекул MHC (если считать только классы
I
и II)
в тимусе должно быть ликвидировано 125
= 60% тимоцитов. Реально в тимусе погибает
более 95% тимоцитов и лишь менее 5% выходят
в периферические лимфоидные органы.
Видимо, в эволюции увеличивать полигенность
MHC больше было нельзя.
Есть ещё такой термин, как «гены MHC–III». Это область генома внутри комплекса MHC между I и II, в которой картированы гены, кодирующие синтез следующих белков:
1) компонентов системы комплемента C4a и C4b, C2, фактора В;
2)
цитокинов — фактора некроза опухолей
(TNF–)
и лимфотоксина;
3) гены 21–гидроксилазы — CYP21A, CYP21B (фермента, участвующего в биосинтезе стероидных гормонов).
До настоящего времени неизвестно, что кодирует (и кодирует ли) значительная часть ДНК этой области.
5.10. Антигенпредставляющие молекулы «не–MHC» — CD1
В
организме у человека есть семейство,
состоящее из 5 близкородственных генов,
которые неполиморфны и кодируют
соответственно 5 изоформ мембранных
белков, по структуре похожих на MHC–I.
Это кластер CD1:
CD1a,
CD1b,
CD1c,
CD1d,
CD1e;
a,
b
и
с
обладают
значительной гомологией и составляют
одно подсемейство, d
и
е —
второе.
Молекулы CD1 —
гетеродимеры, состоящие из –цепи
с молекулярной массой 45 тыс. и
2–микроглобулина.
Антигенсвязывающая «впадина» на –цепи
уже и глубже, чем у молекул MHC–I,
но главное, что место связывания Аг
имеет большое химическое сродство к
гидрофобным лигандам. Так, Аг, которые
связывают молекулы кластера CD1a,
b
и
с, имеют гидрофобную область (цепи жирных
кислот) и гидрофильную область из
полярных или заряженных групп
(гетерополисахариды). Например, CD1
связывают липогликаны микобактерий,
состоящие из гидрофобных липидсодержащих
фосфатидилинозитольных групп, связанных
с крупными комплексами гидрофильных
гетерополисахаридов. Какие T–лимфоциты
распознают такие Аг в комплексе с CD1?
Экспериментально показано, что из T
эти Аг распознают лимфоциты, TCR
которых кодируется сегментом Va24.
Эти T–лимфоциты либо CD4–/CD8–,
либо CD8+,
по функции и те, и другие, если
взаимодействуют с CD1a,
b,
с, ЦТЛ. CD4–/CD8–
T–лимфоциты, которые взаимодействуют
с CD1d,
продуцируют большие количества ИЛ–4.
Разные изоформы молекулы CD1
экспрессированы на различных клетках
(табл. 5.5).
Таблица 5.5. Экспрессия различных изоформ молекулы CD1 на разных клетках
Изоформа |
На каких клетках экспрессирована |
Человек |
|
1. CD1a |
Дендритные клетки; клетки Лангерганса; кортикальные тимоциты |
2. CD1b |
Дендритные клетки; кортикальные тимоциты |
3. CD1c |
Дендритные клетки; клетки Лангерганса; кортикальные тимоциты; B–лимфоциты |
4. CD1d |
B–лимфоциты; эпителиальные клетки кишки; другие нелимфоидные клетки (?) |
5. CD1e |
Неизвестно |
Мышь |
|
6. CD1.1 |
Тимоциты; B–лимфоциты; T–лимфоциты; макрофаги; дендритные клетки; энтероциты; клетки печени |
7. CD1.2 |
Неизвестно |
5.11.
T–лимфоциты
с
рецептором
для
антигена
(T)
В
экспериментах с кольцевыми ДНК
перестроенных генов TCR
в T–лимфоцитах обнаружены гомологичные
гены, не являющиеся, однако, ни -,
ни –генами
цепей TCR.
Таким образом были открыты T–лимфоциты,
экспрессирующие молекулу CD3,
но не экспрессирующие ни -,
ни –цепи
TCR.
Такие TCR,
состоящие из двух других полипептидных
цепей обозначили следующими по алфавиту
буквами —
и .
О
T
известно следующее. В эмбриогенезе T
появляются раньше, чем T.
У мышей первая «волна» T
на 14-е сутки эмбрионального развития
(у мыши период беременности 21 сут)
заселяет эпителий кожи. Эти T–лимфоциты
называют отростчатыми эпидермалъными
T–клетками. У человека таких клеток не
находят. В эмбриогенезе T
второй «волны» заселяют эпителий
слизистых оболочек репродуктивного
тракта. Эпидермальные T
как первой, так и второй «волны» имеют
гомогенный
по
V–области
TCR.
В
постнатальной жизни из дифференцирующихся
в тимусе лимфоцитов T
составляют меньше 1%. Также меньше 1%
таких T–лимфоцитов на территории
периферических лимфоидных органов и в
периферической крови — это территории
T.
Но T
в постнатальном периоде вовсе не
исчезают, они постоянно дифференцируются,
причём из общей клетки–предшественницы
с T,
только экстратимически, вероятно, в
слизистых оболочках преимущественно
ЖКТ. T
нормально дифференцируются у бестимусных
мышей nude.
Молекулярные
механизмы «выбора» дифференцировки
клетки–предшественницы в T
или в T
точно неизвестны. Молекулярные генетики
подозревают о существовании специальных
последовательностей в ДНК — «silencers»
—"выключающих» возможность перестройки
и экспрессии генов TCR
либо
либо .
Гены –цепи
локализованы внутри генов –цепи —
между V
и J.
Поэтому –цепи
надо «успеть» перестроить свои сегменты
до того, как произойдёт перестройка
генов –цепи,
поскольку при перестройке генов V–J
–цепи
гены –цепи
необратимо выбрасываются. Гены –цепи
содержат не менее 4 V–сегментов,
диссеминированных среди V–сегментов
–цепи,
3 D–сегмента,
3 J–сегмента
и один C–ген. Особенностью перестройки
генов –цепи
является использование двух D–сегментов
(VDDJ),
при этом с каждого края блока VDDJ
добавляются некодируемые нуклеотиды
и это существенно повышает разнообразие
антигенсвязывающих возможностей –цепи.
Гены
–цепи
TCR
имеют два C–сегмента, 3 J–сегмента
перед первым C–сегментом и 2 J–сегмента
перед вторым C–сегментом, 12 V–сегментов.
В
зрелых T
часто обнаруживают продуктивно
перестроенные гены –цепи,
а в зрелых T —
перестроенные, но непродуктивно
(out-of-frame)
гены
и –цепей.
На
мембране T
не выявили экспрессию молекулы CD4.
Молекула CD8
на части T
экспрессирована, но не в виде
–гетеродимера,
как на CD8+
T,
а в виде гомодимера из двух –цепей.
T
распознают Аг иначе, чем T.
По своим антигенраспознающим способностям
Рц T–лимфоцитов
напоминает иммуноглобулины
в
большей степени, чем другой Рц T–лимфоцитов
.
CDR3
(Complementarity–Determining
Region–3)
–цепи
длинная и вариабельная, как у L–цепи
иммуноглобулинов, a
CDR3
–цепи
короткая и не слишком вариабельная, как
у L–цепи
иммуноглобулинов. Как и иммуноглобулины,
TCR
способны связывать нативные
Аг
и независимо от классических молекул
MHC, т.е. для T
не обязателен или вовсе не нужен
предварительный процессинг Аг в АПК. В
некоторых экспериментах Аг для T
представляют неклассические молекулы
MHC (например, CD1).
Разнообразие АК–состава CDR3
TCR
больше, чем у TCR,
и больше, чем у иммуноглобулинов, т.е. в
целом T
способны распознавать немалое множество
различных Аг.
Антигены
какого рода распознают T?
Они «замечены» в распознавании
фосфолипидных Аг микобактерий, углеводов,
белков теплового шока.
По
функциям T,
как и T,
могут быть продуцентами цитокинов и/или
цитотоксическими T–лимфоцитами.
Предполагают,
что T
локализованные в барьерных тканях и
имеющие гомогенный по V–области
Рц, распознают белки теплового шока
(стресc–протеины), выделяемые
травмированными кератиноцитами, и
начинают продуцировать цитокины, которые
«организуют» иммунный ответ на микробы,
проникающие в организм при травме
покровных тканей.
У
мышей с «knock–out»
по генам TCR,
но с сохранными генами TCR,
возможен санирующий иммунный ответ
против, например, вируса простого
герпеса, Listeria
monocytogenes,
возбудителя малярии.
5.12. Субпопуляции нормальных киллеров
Нормальные киллеры (NK — Normal Killers, или Natural Killers — естественные киллеры) были описаны впервые как большие зернистые лимфоциты, способные in vitro спонтанно (т.е. без предварительной иммунизации) убивать некоторые опухолевые клетки, а также инфицированные вирусами клетки. Позже выяснили, что морфологически NK могут выглядеть и как малые лимфоциты.
NK дифференцируются из общей лимфоидной клетки–предшественницы. NK чем-то отличаются от T–лимфоцитов (в NK не перестраиваются гены TCR, и они распознают свои мишени иначе), но и чём-то похожи (в NK возникает тот же самый цитотоксический аппарат убийства клетки–мишени, что и в ЦТЛ — перфорин–гранзимы). Кстати, спонтанную цитотоксичность (без предварительной иммунизации) могут развивать и некоторые ЦТЛ.
NK в циркулирующей крови составляют около 15% от всех мононуклеарных клеток. NK в тканях локализованы в иных местах, чем T–лимфоциты: в печени (это основное место локализации NK у человека), красной пульпе селезёнки, слизистых оболочках (особенно репродуктивных органов). NK не рециркулируют между кровью и лимфой, они циркулируют только в крови.
Эффекторные
функции NK —
цитотоксичность (в отношении клеток–мишеней)
и продукция цитокинов (ИФН–,
TNF,
GM–CSF,
ИЛ–5, ИЛ–8). Таким образом, будучи сами
активированы, NK
вносят вклад в иммунное отклонение в
пользу Th1
(ИФН–),
стимулируют гемопоэз (GM–CSF),
дифференцировку и мобилизацию эозинофилов
(ИЛ–5), усиливают воспалительную реакцию
в очаге (ИЛ–8).
Иммунное отклонение (immune deviation) — изменение терминальной дифференцировки иммунных CD4+ T–лимфоцитов в сторону преимущественного образования Th1 или Th2.
Какие
стимулы активируют NK?
На что они реагируют? Как и всякая клетка,
NK
реагируют на то, для чего у них есть Рц
на мембране. У них есть Рц для цитокинов
(по крайней мере для ИЛ–2 и ИФН–)
для молекул MHC–I,
особый Рц для Fc–концов
IgG —
FcRIIIA
(CD16).
Последний Рц ассоциирован в цитоплазме
клетки с –цепью
(другие цепи комплекса CD3
в NK
не экспрессируются), которая проводит
внутрь сигнал, активирующий цитотоксический
аппарат NK.
Через этот Рц NK
«распознают» то, что распознаёт IgG
(CD16
свяжет иммунный комплекс за Fc–конец
молекулы иммуноглобулина), т.е. самые
разнообразные Аг. Таким образом NK
осуществляют антигенспецифичную
эффекторную
иммунную реакцию антителозависимой
клеточной цитотоксичности (АЗКЦТ).
Феномен АЗКЦТ воспроизводим, его
достоверно наблюдают в экспериментах
in
vitro.
Его наличие и значение in
vivo,
однако, подтвердить не просто из-за
отсутствия адекватных методов.
Эксклюзивным мембранным маркёром NK является мембранная молекула CD56 — изоформа адгезивной молекулы из семейства молекул адгезии клеток нервной системы (NCAM — neural cell adhesion molecule) с молекулярной массой 135–220 тыс. из надсемейства иммуноглобулинов.
У человека чётко различают по крайней мере две функционально разные субпопуляции NK: CD56много/CD16– и CD56мaло/ CD16+. Субпопуляция CD56мaло/CD16+ в АЗКЦТ является эффекторной. Субпопуляция CD56много/CD16 преобладает в печени, локализуется в синусоидах (так называемые Pit–клетки), слизистой оболочке матки и в децидуальной оболочке. Полагают, что именно NK слизистой оболочки матки «не пускают» трофобласт плода «слишком далеко» в тело матери.
Процесс инвазии трофобласта контролируется генами HLA–G (неполиморфная, неклассическая молекула класса I). NK в децидуальной оболочке имеют мембранный фенотип активированных клеток. На них экспрессированы, кроме CD56много/CD16–, ещё и такие мембранные молекулы, как CD69, MHC–II, CD45RO, CD49a (VLA–1), CD54 (ICAM–1).
В
крови содержание NK
с фенотипом CD56много/CD16–
минимальное.
Эта субпопуляция NK,
кроме того, конститутивно экспрессирует
высокоаффинный Рц для ИЛ–2 и способна
пролиферировать в ответ на низкие
концентрации ИЛ–2. NK,
преобладающие в крови и селёзенке, имеют
фенотип CD56мaло/CD16+.
в функциональном отношении они являются
эффекторами АЗКЦТ, пролиферируют в
ответ на комбинации цитокинов (ИЛ–15 +
ИЛ–10) или (ИЛ–15 + ИЛ–12), желательно на
близком расстоянии от активированных
T–лимфоцитов. Если NK
стимулируют комбинацией (ИЛ–15 + ИЛ–12),
то они начинают активно продуцировать
ИФН–.
Если NK
стимулируют комбинацией (ИЛ–15 + ИЛ–10),
то они ИФН–
не продуцируют. NK
начинают продуцировать ИЛ–5 только при
условии их стимуляции ИЛ–2, который,
как известно, продуцируют исключительно
активированные T–лимфоциты, т.е. продукция
ИЛ–5 нормальными киллерами возможна
только после
антигенспецифичного
иммунного ответа со стороны T–лимфоцитов.
На NK есть Рц, способные связывать молекулы MHC–I собственных клеток. Но эти Рц не активирующие, а ингибирующие киллерную функцию NK. Ингибирующие Рц NK принадлежат ко множеству клеточных Рц KIR (Killer–cell Immunoglobulin–like Receptors). Известны две разновидности KIR, различающиеся по молекулярной массе: лёгкий KIR состоит из двух внеклеточных доменов и имеет мол. массу 58 тыс. (обозначен как р58). Он «узнаёт» Аг локуса HLA–C. Более крупный KIR имеет 3 внеклеточных домена и молекулярную массу 70 тыс. (р70), «узнаёт» HLA–B и HLA–A.
Гены KIR NK человека локализованы в хромосоме 19. На уровне ДНК они не перестраиваются, но на уровне транскрипта РНК с этих генов имеет место альтернативный сплайсинг, что обеспечивает определённую степень разнообразия вариантов этих Рц у каждого отдельного NK. На каждом единичном NK экспрессировано более одного варианта KIR–Рц. Кроме того, на NK экспрессирована молекула CD8, имеющая сродство к MHC–I.
Если при контакте с какой-то клеткой эти Рц «не находят» достаточного количества своих лигандов (MHC–I), то ингибирующий сигнал с KIR–Рц также оказывается недостаточным, и NK развивает в отношении этой клетки цитотоксическую атаку и убивает клетку. Поскольку субнормальная экспрессия MHC–I возникает при патологических процессах в клетках (при вирусных инфекциях, опухолевом перерождении), постольку и NK могут убивать инфицированные вирусами или перерожденные клетки собственного организма (в экспериментах in vitro).
Ингибирующим киллерную активность Рц NK является и мембранная молекула CD94 в комплексе с NKG2A (CD159A). Этот Рц принадлежит семейству лектинов C–типа. Ещё одним ингибирующим Рц с неизвестным лигандом служит молекула gp49B.
Контакты с клетками NK осуществляют посредством молекул адгезии [например, CD2, лиганд CD58 (LFA–3) и CD31 (PECAM1 — молекула межклеточной адгезии тромбоцитов и эндотелия 1)]. Молекула CD31 обеспечивает гомотипную адгезию NK к эндотелию и экстравазацию NK из сосудов в ткани.
Кроме того, на NK экспрессировано множество интегринов. На NK конститутивно экспрессированы такие интегрины, как CD18, LFA–1 (CD11a/CD18), Mac–1 (CD11b/CD18), VLA–4 (CD49d/CD29), VLA–5 (CD49e/CD29). LFA–1 обеспечивает связь с клетками эндотелия [лиганды — ICAM–1 (CD54) и ICAM–2 (CD102)]. Mac–1 также имеет сродство к лиганду CD54. VLA–4 вступает в связывание с сосудистой молекулой клеточной адгезии VCAM. VLA–5 обеспечивает прилипание NK к фибронектину межклеточного матрикса.
NK
отвечают на (т.е. имеют Рц для) хемокины
семейства «CC»: MIP–1
(macrophage
inflammatory
protein–1
, IP–10
(interferon–inducible
protein–10),
RANTES,
MCP–1,
2, 3 (monocyte
chemotactic
protein–1,
2, 3), а также ИЛ–12.
Вероятно, NK, локализованные в синусоидах печени, через которые проходит в первую очередь кровь vena porta от слизистой оболочки всего ЖКТ, активно участвуют в убийстве лимфоцитов, активированных пищевыми Аг, и таким образом обеспечивают иммунологическую толерантность организма в целом к пище (так же, как NK слизистой оболочки матки принимают участие — может быть, решающее — в поддержании состояния толерантности организма матери к тканям эмбриона).
Глава 6. ВОЗБУЖДЕНИЕ И ТОРМОЖЕНИЕ ИММУННОЙ СИСТЕМЫ. МЕХАНИЗМЫ ПРОВЕДЕНИЯ СИГНАЛОВ ВНУТРЬ КЛЕТКИ
6.1. Общие молекулярные механизмы проведения сигналов внутрь клетки
В многоклеточном организме ни одна нормальная клетка на стадиях развития «после зиготы» не живет исключительно по своей внутренней программе. Клетки находятся в непрерывном взаимодействии друг с другом. Всякое изменение жизненных процессов в отдельной клетке наступает только по сигналу из внешней для клетки среды. Для восприятия сигналов на внешней мембране клетки (и для некоторых сигналов на внутриклеточных органелах) есть множество специальных молекул, называемых Рц. Сигнальные молекулы химически комплементарны связывающим структурам Рц, и в общем виде их называют лигандами. Лигандами являются все биологически активные вещества — гормоны, цитокины, нейромедиаторы, патогены и продукты взаимодействия патогенов с тканями организма, ЛС. Большинство лигандов сами не проникают в клетку (некоторые, для которых есть внутриклеточные Рц, проникают), они только связывают наружный Рц. И это их единственнеое собственное биологическое свойство. Дальнейшие биологические последствия зависят от характера дифференцировки клетки, на которой экспрессирован Рц для данного лиганда. Связывание Рц изменяет его конфигурацию. Это изменение передается «влево, вправо» по мембране и «вниз» внутрь клетки, что служит началом цепи взаимодействий определённых внутриклеточных молекул — проведения сигнала (рис. 6.1). Проведение сигнала в клетку приводит к тому или иному биологическому эффекту — клеточному проявлению активации/подавления, например:

Рис. 6.1. Межклеточный «интерфейс» между T–лимфоцитом и АПК. А. Адгезия T–лимфоцита и АПК до распознавания Аг. Эти взаимодействия слабые, и если не произойдет связывания TCR с Аг, то клетки легко диссоциируют. Б. После связывания TCR с комплексом MHC — пептид изменяется конформация молекулы LFA–1 и связь между клетками становится более сильной и продолжительной.
1) изменяются адгезивные свойства клеточной мембраны — клетка становится более «липкой» по отношению к своему окружению или, наоборот, менее «липкой», что позволяет ей начать двигаться (лимфоциты и все лейкоциты);
2) клетка (лимфоциты и все лейкоциты) начинает перемещаться в тканях под действием сигналов (хемотаксис) — сквозь стенку кровеносного сосуда (экстравазация), к очагу повреждения;
3) клетка дегранулирует, выбрасывая в межклеточное пространство депонированные биологически активные вещества (тучные клетки, эозинофилы, базофилы, активированные макрофаги и нейтрофилы, цитотоксические T–лимфоциты и NK);
4) клетка вступает в пролиферацию или наоборот — перестает делиться (в периферических тканях — только лимфоциты);
5) клетка начинает (или прекращает) транскрипцию определённых генов, последующую трансляцию (синтез белка) и секрецию продукта;
6) в клетке включается «программа смерти», развивается апоптоз, и клетка прекращает своё существование.
Экспрессию тех или иных жизненных функций называют активацией клетки, подавление жизненных функций называют подавлением, или супрессией, клетки, а с ней и иммунного ответа. Соответственно существуют активирующие взаимодействия Рц—лиганд и ингибирующие взаимодействия Рц—лиганд. В некоторых случаях можно говорить об активирующих и ингибирующих Рц. Но последняя альтернатива не является строгой. Например, один и тот же TCR в случае, если он свяжет пептид–агонист и произойдут все необходимые корецепторные взаимодействия, создаст сигнал для активации лимфоцита. Но если тот же самый TCR свяжет пептид–антагонист, то активации клетки не будет. Если тот же TCR свяжет пептид-частичный агонист, то в лимфоците будет поддерживаться состояние частичной активации, которое на уровне клетки и организма выглядит как иммунологическая толерантность (см. рис. 6.1).
Исследования закономерностей взаимодействия TCR со своими лигандами показали, что не всякое связывание приводит к активации лимфоцита. Некоторые комплексы пептидов с MHC связываются с TCR, не вызывают активацию лимфоцитов и препятствуют собой связыванию с тем же TCR другого комплекса пептид—MHC, который в отсутствие первого вызывает активацию лимфоцита. Такие ингибирующие пептиды называют пептидами–антагонистами. Пептиды, вызывающие активацию с TCR, называют пептидами–агонистами. Химические исследования показывают, что пептиды–антагонисты получаются при замене в молекулах пептидов–агонистов АК, участвующих в связывании с TCR, при сохранении АК, участвующих в связывании с молекулами MHC. Вероятно, подавление активации лимфоцитов пептидами–антагонистами играет свою роль в патогенезе персистирующих вирусных инфекций. Это показано, например, для ВИЧ–инфекции: мутантные вирусные пептиды–антагонисты способны заблокировать активацию вирусспецифических CD8+ ЦТЛ, будучи в количестве в 100 раз меньшем, по сравнению с «нормальными» вирусными пептидами–агонистами, т.е. в каких-то случаях по крайней мере аффинность связи с TCR у пептида–антагониста может превосходить аффинность связи пептида–агониста.
Недавно
открыт ещё один вариант взаимодействия
пептидов (в комплексе с MHC) с TCR —
особым, «третьим» способом: в клетке
при этом наступает частичная активация.
Такие пептиды назвали частичными
агонистами (partial
agonists
or
altered
peptide
ligands).
Частичная активация заключается в
неполном фосфорилировании
и –цепей
TCR
и подсоединении к Рц неактивной формы
киназы ZAP–70.
По-видимому, аффинность связи с TCR
пептидов–частичных агонистов обычно
меньше аффинности связи пептидов–агонистов.
Но этот «третий» вариант взаимодействия
TCR
с Аг представляет особый интерес для
фундаментальной иммунологии, так как,
вероятно, именно по такому варианту
«частичных агонистов» происходит
непрерывное распознавание «своего»
всеми периферическими лимфоцитами (T
и В). Без распознавания «своего» наши
лимфоциты в нашем теле не живут (об этом
свидетельствуют эксперименты на моделях
мышей с трансгенами и нокаутом генов
одновременно). Это распознавание защищает
их от апоптоза. Но такое распознавание,
не приводящее к полноразмерной активации
лимфоцита, не приводит и к аутоиммунному
повреждению своих тканей в норме.
Биохимические пути проведения сигналов различны для разных категорий Рц и их семейств. Ниже будут рассмотрены следующие категории Рц лимфоцитов и их клеток–партнёров по иммунному ответу (лейкоцитов):
иммунорецепторы
(так называют Рц, обеспечивающие
непосредственные реакции на Аг, —
TCR,
BCR,
FcR,
в последнем случае есть один посредник —
растворимые АТ);
TOLL–подобные
Рц для микробных продуктов;
Рц
семейства 7–членной «гармошки» для
медиаторов базовой воспалительной
реакции;
Рц
для цитокинов.
В настоящее время известно несколько конкретных внутриклеточных реакций, обеспечивающих проведение сигналов. Эти реакции во многом одинаковые для разных пар Рц–лиганд. Внутриклеточные молекулы — участники проведения сигналов — раньше называли вторичными мессенджерами (вторичными посредниками). Чтo определяет специфичность биологических последствий при разных сигналах, в большинстве случаев почти неизвестно — лишь немного, и лишь отчасти. Известны разные вторичные мессенджеры «при» TCR в T–лимфоцитах и BCR в B–лимфоцитах. Известны также разные вторичные мессенджеры при разных Рц — «для Аг», «для цитокинов», «для медиаторов воспаления».
6.1.1. Проведение сигналов с рецепторов лимфоцитов для антигенов — TCR и BCR
Для Рц лимфоцитов для Аг — TCR и BCR — описан ряд общих закономерностей восприятия и проведения активационных сигналов в клетку (рис. 6.2).
Рис.
6.2.
Взаимодействия
внутриклеточных
молекул,
участвующих
в
проведении
сигналов
с
рецепторов
для
антигена
(на примере TCR)
на ядро (гены) T–лимфоцита (схема). TCR
кластеризован — это непременное
условие продуктивной активации лимфоцита.
CD45 —
трансмембранная тирозинфосфатаза,
отщепляет ингибирующие фосфаты от ITAM
цитоплазматических участков цепей
комплекса TCR,
чем способствует активации внутриклеточных
тирозинкиназ семейства Src
(Fyn
и Lck).
Киназы Src
конститутивно ассоциированы с одной
стороны с клеточной мембраной, с другой —
с проводящими сигнал участками цепей
TCR.
ZAP–70 —
–associated
protein–70 —
тирозинкиназа с молекулярной массой
70 кД, ассоциированная с –цепью
комплекса TCR.
LAT —
один из адапторных белков, связывающих
активированную киназу ZAP–70
с киназами Tec, активирующими дальше
фосфолипазу C–г
(PLCr).
PLCr
расщепляет фосфатидилинозитолдифосфат
клеточной мембраны (PIP2)
на диацилглицерол (ДАГ),
который остаётся в мембране, и
фосфатидилинозитол трифосфат (PIP3),
который уходит внутрь клетки и участвует
в высвобождении Ca2+
из депо, участвующих в дальнейших
реакциях активации. PKC — протеинкиназа
С, которую активирует ДАГ.
NFB —
ядерный фактор транскрипции каппа В.
NFAT —
nuclear
factor
of
activated
T–cells —
ядерный фактор транскрипции активированных
T–лимфоцитов. АP–1–фактор транскрипции —
димер генрегулирующих белков Fos
и Jun.
Лиганд(ы)
связывают несколько одноимённых Рц в
кластеры (кластеризация Рц в мембране).
Без кластеризации изменение конформации
от «одновалентного» взаимодействия
Рц–лиганд количественно недостаточно
для наступления последствий на уровне
всей клетки*.
Большинство препаратов Аг, используемых в экспериментах, являются мономерными и растворимыми. Однако на практике на них легко удаётся получить гуморальный иммунный ответ — выработку АТ в организме животного. Сами по себе такие Аг, очевидно, не могут вызвать кластеризацию BCR. Поэтому предполагают, что происходит следующее. BCR связывает Аг и наступает опосредованный через Рц эндоцитоз Аг. Внутри клетки Аг расщепляется, и пептидные фрагменты образуют комплексы с молекулами MHC, в таком виде экспрессируются на мембрану. B–лимфоцит начинает выступать в роли АПК для T–лимфоцита. T–лимфоцит связывает кассеты этих комплексов на поверхности B–лимфоцита, между ними формируется иммунологический синапс, и T–лимфоцит посылает B–лимфоциту необходимый для запуска продукции АТ «второй сигнал». Такое представление объясняет механизм давно известной тимусзависимости гуморального иммунного ответа на большинство белковых антигенов.
Значительная
часть биохимических реакций проведения
сигнала — фосфорилирование молекул
белков по остатку тирозина под действием
протеин–тирозинкиназ
или
дефосфорилирования белков под действием
фосфатаз.
Изменение
статуса остатков тирозина по
фосфорилированности приводит к активации
или инактивации белка. Процессы
фосфорилирования–дефосфорилирования
белков легко обратимы, осуществляются
без дополнительных синтезов белков и
поэтому «удобны» для быстрых и гибких
адаптивных реакций клетки на внешние
сигналы.
В
цитоплазматических участках
сигналпроводящих цепей Рц выявлены
определённые последовательности АК,
содержащие остатки тирозина. Эти
последовательности назвали ITAM
(immunoreceptor
tyrosine–based
activation
motifs —
тирозинсодержащие активационные
последовательности АК в иммунорецепторах)
для активирующих сигналов и ITIM
для подавляющих активность клетки
сигналов. ITAM
содержат 2 остатка тирозина, разделённых
9–12 АК: ...YXX[L/V]X6–9
YXX[L/V]...,
где Y —
остаток тирозина, X —
остатки разных АК, L —
остаток лейцина, V —
остаток валина.
В
одном BCR
содержится
всего две
последовательности
ITAM —
по одной в цитоплазматических концах
молекул Ig
и Ig.
Именно в этих цепях — Ig
и Ig —
ITAM
впервые и идентифицировали. В одном TCR
содержится
10
последовательностей
ITAM
(по 1 в -,
-
и 2 –цепях,
по 3 в каждой из 2 –цепей).
Первыми,
«обслуживают» TCR/BCR
внутри клетки протеин–тирозин киназы
семейства
Src
(читают
«сарк»). Эти киназы связаны с внутренней
стороной клеточной мембраны через
липидные мостики, а также они «заранее»
связаны низкоаффинно с ITAMs
в цитоплазматических участках цепей
Рц. Тирозинкиназы этого семейства
характерны для разных сигналов,
инициирующих деление и дифференцировку
клеток. Название произошло от «вируса
саркомы Рауса»,
потому что изначально эти киназы открыли
как продукты онкогена этого вируса
(v–src).
Затем был открыт клеточный ген–прототип
(c–src).
Киназы Src
фосфорилируют ITAM
в цитоплазматических концах цепей Рц.
Фосфорилирование по тирозину так меняет
молекулу белка, что в ней возникают
места, способные связывать другие белки.
Запускаются «белок–белковые
взаимодействия». Охарактеризованы два
варианта мест связывания белков с
белками: SÍ2–домен
(Src
homology
2) и SÍ3–домен
(Src
homology
3); SÍ2–домен
связывает другие белки по фосфотирозину,
SÍ3–домен
связывает другие белки по участкам,
богатым пролином.
В
B–лимфоцитах работают Src–киназы
Fyn,
Blk
и
Lyn,
а
в T–лимфоцитах — Src
–киназы Fyn
и
Lck.
В T–лимфоцитах киназа Lck
конститутивно ассоциирована с
цитоплазматическими доменами корецепторов
CD4
и CD8,
а киназа Fyn
после кластеризации TCR
ассоциируется с
и –цепями.
Ферментативная
активность самих киназ семейства Src
зависит от фосфорилированности киназного
домена и C–концевого участка молекулы:
фосфорилирование остатка тирозина в
киназном домене приводит фермент в
активное состояние, фосфорилирование
остатка тирозина в C–концевом участке
инактивирует фермент. Фосфорилирование
в C–конце осуществляет специальный
фермент — киназа Csk.
Этa
киназа конститутивно активна в неделящихся
клетках. Противодействует киназе Csk
трансмембранная тирозин–фосфатаза
CD45,
которая удаляет фосфат с остатка тирозина
в C–конце молекул киназ семейства Src.
Молекула CD45
была открыта как «общий Аг всех
лейкоцитов». Таким образом, от баланса
активностей киназы Csk
и фосфатазы CD45
зависит, наступит или нет активация
лимфоцита после агрегации его Рц для
Аг. Через экспрессию разных изоформ
фосфатазы CD45
регулируется порог силы сигнала,
активирующего T–лимфоцит. В иммунных
T–лимфоцитах и T–лимфоцитах памяти
экспрессирована изоформа CD45,
уже ассоциированная с цепями TCR,
и порог активации иммунных T–лимфоцитов
существенно ниже, чем у неиммунных
T–лимфоцитов, в которых экспрессируется
иная изоформа CD45 —
не предассоциированная с TCR.
Второй
известный молекулярный механизм
регуляции активности киназ семейства
Src
в клетке — это их ковалентное
связывание с убиквитином
через адапторный
белок Cb1.
Связывание
с убиквитином «направляет» всякий белок
на деградацию в протеасомах.
Совместная
агрегация Рц лимфоцитов для Аг с
корецепторами (TCR
с CD4
или CD8
и BCR
с «CD19,
CD21,
CD81»)
значительно снижает порог чувствительности
лимфоцита к активации: при наличии
корецепторов для активации T–лимфоцита
достаточно связать 100 одинаковых
комплексов пептид–MHC, в отсутствие
корецепторов необходимо не менее 10 тыс.
таких комплексов, что в естественных
условиях, по-видимому, не встречается.
Агрегация BCR
с корецепторами «CD19,
CD21,
CD81»
снижает порог чувствительности
B–лимфоцита по показателю концентрации
Аг в 1000–10 000 раз.
С
фосфорилированными ITAM
в цитоплазматических участках цепей
Рц начинают взаимодействовать
тирозинкиназы следующего этапа проведения
сигнала — Syk
в B–лимфоцитах
и ZAP–70
в T–лимфоцитах. Киназа Syk
встречается только в кроветворных
клетках, киназа ZAP–70 —
только в T–лимфоцитах. Обе эти киназы
имеют по два домена SH2
в N–конце
молекулы. Киназная активность локализована
в C–конце.
ZAP–70
активируется фосфорилированием
ассоциированной с корецепторами
T–лимфоцита Src–киназой
Lck.
Будучи активированной, ZAP–70
фосфорилирует свои субстраты — два
адапторных белка LAT
и SLP–76
(аналоги в B–лимфоцитах
соответственно BLNK
и SLP–65).
Эти адапторные белки связаны с богатыми
холестеролом участками внутренней
стороны клеточной мембраны через
липидные мостики (пальмитоилированные
остатки цистеина). Физическая ассоциация
проводящих сигнал компонентов с клеточной
мембраной обеспечивает распространение
сигнала не только внутрь клетки, но и
вдоль мембраны.
На
этом этапе происходит активация киназ
ещё одного семейства, встречающегося
только
в лимфоцитах — это
киназы
Tec. В
B–лимфоцитах
экспрессируется киназа Брутона —
Btk*,
в T–лимфоцитах — киназа Itk.
В молекулах этих киназ есть участки,
так называемые домены PH
(pleckstrin–homology),
позволяющие этим белкам связываться с
фосфорилированными липидами внутренней
стороны клеточной мембраны. Через свои
SH2-
и SÍ3–домены
они связывают адапторные белки LAT,
SLP–76,
BLNK.
Киназы Tec являются важными активаторами
следующего участника проведения
сигнала — фосфолипазы C–.
Киназа Брутона Btk (Bruton's tyrosine kinase) — «знаменита» тем, что именно дефект в гене этого фермента обнаружен у пациентов с первичным иммунодефицитом — агаммаглобулинемией Брутона. Это заболевание — первое, открытое врачами (О.С. Брутоном в 1952 г.) — из категории врождённых генетических иммунодефицитов.
Молекула
фосфолипазы C–
(PLC–)
содержит два домена SH2,
через которые она связывается с
фосфотирозинами на активированных
тирозинкиназах, фосфорилирующих
активационные остатки тирозина в
молекуле PLC–.
Будучи активированной, PLC–
начинает расщеплять фосфолипиды
клеточной мембраны, а именно
фосфатидилинозитолдифосфат
(PIP2)
на фосфатидилинозитолтрифосфат (PIP3)
и диацилглицерол (ДАГ).
Для
PIP3
есть Рц в эндоплазматическом ретикулуме,
он связывается с PIP3
и тем самым высвобождает ионы
кальция из
депо в цитозоль. В процесс активации
клетки включаются и кальциевые насосы
клеточной мембраны, «подкачивающие»
Ca2+
из внеклеточной среды. Свободный кальций,
будучи в достаточной концентрации,
активирует кальцийсвязывающие белки,
в том числе кальмодулин,
который
регулирует активность ряда других
белков. В высоких концентрациях Ca2+
активирует и серин/треониновую фосфатазу —
кальцийнейрин,
который дефосфорилирует и тем самым
активирует фактор
транскрипции NFAT
(nuclear
factor
of
activated
T
cells;
несмотря на такое название, этот фактор
транскрипции не является специфичным
только для T–лимфоцитов).
ДАГ
остаётся в мембране и активирует
протеинкиназу С (PKC) — серинтреониновую
киназу, которая активирует эволюционно
«древний» фактор транскрипции NFB.
Следующие
участники проведения сигнала — малые
G–белки.
Это небольшие одноцепочные белки,
обладающие свойством связываться с
гуанозинтрифосфатом (ГТФ). Первый из
открытых малых G–белков —
Ras
(мол. масса 21 кДа). Он был открыт как
непременный участник клеточного деления,
консервативный у всех исследованных
эукариотических клеток.
Существенные
участники процессов передачи сигнала —
так называемые адапторные белки. Это
белки, содержащие от 1 до 3 SH2-
и SH3–доменов,
по которым они связывают другие белки,
чем обеспечивают нужные белок–белковые
взаимодействия. Одним из лигандов
адапторных белков являются факторы
замещения гуаниннуклеотидов — GEFs
(guanine–nucleotide
exchange
factors).
Ras
в неактивном состоянии содержит ГДФ.
GEF
из адапторного белка заменяет в Ras
ГДФ
на ГТФ, чем переводит Ras
в активное состояние. Ras,
однако, обладает собственной ГТФ–азной
активностью и быстро отщепляет третий
фосфат, чем возвращает себя в неактивное
состояние (самоинактивируется). Описаны
мутации в гене Ras,
приводящие
к замене всего одной АК, но с потерей
способности самоинактивироваться.
Клетки с таким мутантным геном становятся
злокачественно опухолевыми.
В
состоянии кратковременной активации
Ras
успевает активировать очередной каскад
киназ, называемый MAP
(Mitogen–Activated
Protein
Kinase).
Именно эти киназы MAP
уже непосредственно фосфорилируют
факторы
транскрипции
в
адре клетки. В настоящее время
охарактеризован фактор транскрипции
АP–1 —
гетеродимер
белков Fos
и Jun.
Изучение
внутриклеточных молекулярных механизмов
действия таких иммунодепрессивных ЛС,
как циклоспорин
А,
такролимус (FR506)
и
сиролимус,
привело
к обнаружению в клетке так называемых
иммунофилинов. Иммунофилинами назвали
те молекулы в клетке, с которыми указанные
иммунодепрессанты вступают в
непосредственное химическое взаимодействие:
циклоспорин А образует комплекс с
иммунофилином, названным циклофилином,
такролимус — с иммунофилином FKBP
(FK–Binding
Protein).
Иммунофилины являются ферментами —
пептидил–пролил–cis–trans–изомеразами.
Биологические эффекты циклоспорина А
и такролимуса одинаковы: образующиеся
в клетке комплексы «иммунофилин–препарат»
связывают и инактивируют кальцийнейрин.
В результате не активируется фактор
транскрипции NFAT
и не наступает транскрипция с генов
ИЛ–2, CD40–лиганд, Fas–лиганд
и T–лимфоцит не выходит в активацию, не
наступает экспансия клона. Кальцийневрин
функционирует не только в T–лимфоцитах,
но и в других клетках, однако его
концентрация в других клетках существенно
выше, чем в T–лимфоцитах. Это и позволяет
подавить активацию T–лимфоцитов дозами
препаратов, к которым устойчивы другие
клетки. У сиролимуса иной внутриклеточный
механизм действия, чем у циклоспорина
и такролимуса. Сиролимус связывается
с тем же иммунофилином, что и такролимус, —
FKBP,
но этот комплекс не затрагивает
кальцийнейрин. Комплекс сиролимус—иммунофилин
связывается в клетке с некой протеинкиназой,
названной mTOR
(Mammalian
Target
Of
Rapamycin)
и блокирует проведение сигналов с Рц
для ИЛ–2, ИЛ–4 и ИЛ–6 — соответственно
блокируются пролиферация и иные
проявления активации, зависящие от этих
Рц.
То,
что у циклоспорина А и такролимуса, с
одной стороны, и у сиролимуса — с
другой разные внутриклеточные механизмы
действия, позволяет использовать их
комбинации в клинике с существенным
снижением дозы с обеих сторон.
Кратко суммируем «ключевые слова», обозначающие процессы и молекулы, осуществляющие внутриклеточное проведение сигналов в лимфоцитах с Рц для Аг:
кластеризация
Рц и корецепторов;
ITAM's —
2 в BCR,
10 в TCR;
киназы
семейства Src—Fyn,
Blk,
Lyn —
в B–лимфоцитах,
Lck
и Fyn
в T–лимфоцитах;
киназы
Syk
и ZAP–70;
киназы
семейства Tec—Btk,
Itk;
фосфолипаза
C–
(PLC–);
фосфатидилинозитол
дифосфат (PIP2),
фосфатидилилинозитол трифосфат (PIP3),
диацилглицерол (ДАГ);
ионы
кальция (Ca2+),
кальмодулин, кальцийнейрин, фактор
транскрипции NFAT;
протеинкиназа
С (PKC), фактор транскрипции NFB;
малые
G–белки
(Ras);
каскад
киназ MAP;
факторы
транскрипции АP–1;
иммунофилины.
6.1.2. Проведение сигналов с TOLL–подобных рецепторов, распознающих продукты микробных патогенов
У
млекопитающих охарактеризованы по
крайней мере два (из 10, предсказанных
«геномом» человека) TOLL–подобных
Рц, распознающие непосредственно
микробные продукты: TLR–2,
связывающий продукты грамположительных
бактерий, и TLR–4,
ассоциированный в клеточной мембране
с CD14,
лигандом для которого является ЛПС
грамотрицательных бактерий. Внутриклеточный
механизм проведения сигналов с этих Рц
изучен (рис. 6.3). Оказалось, что таков же
внутриклеточный механизм проведения
сигнала с Рц для такого цитокина, как
ИЛ–1
(т.е. ИЛ–1
и Рц для него — «отголосок» древней
сигнальной системы многоклеточных). На
выходе сигналов с этих Рц активируется
фактор транскрипции NFB.
Рис.
6.3.
Проведение
сигналов
с
TOLL–подобных
рецепторов
для
патогенов
и
рецепторов
для
ИЛ–1
(схема). В проведении сигналов участвуют
адапторный белок MyD88,
киназы IRAK,
затем киназы I
и I,
которые отщепляют от фактора транскрипции
NFB
ингибиторный белок I.
«Древний» фактор транскрипции NFB
мигрирует в ядро, где инициирует
транскрипцию с тех или иных генов.
Цитоплазматические
участки молекул TOLL–подобных
Рц и ИЛ–IR
содержат характерные последовательности
АК–остатков, названные TIR–доменом.
Если Рц связывает лиганд, то внутри
клетки его TIR–домен
связывает особый адапторный белок
MyD88.
По другому сайту («домену смерти») MyD88
связывает особую серин/треониновую
киназу IRAK.
Эта киназа активируется и активирует
две другие киназы — I
и I.
Они формируют димер, который фосфорилирует
ингибиторный белок I,
блокирующий фактор транскрипции NFB.
После диссоциации Ik
фактор транскрипции NFB
мигрирует в ядро, где связывается с
рядом промотеров, что обеспечивает
запуск транскрипции с их генов. NFB
запускает транскрипцию генов
провоспалительных цитокинов и
костимуляторных молекул B7.1 и B7.2 в
дендритных клетках. Кроме того, в
дендритных клетках инициируются
процессы, обеспечивающие их мобилизацию
и миграцию из очага внедрения патогена
в регионарные лимфатические узлы. Таким
образом, сигналы с TOLL–подобных
Рц создают необходимые условия для
начала лимфоцитарного иммунного ответа.
Заодно NFB
иницирует транскрипцию гена своего
белка–ингибитора I,
что обеспечивает самозатухание сигнала
с TOLL–подобных
Рц.
6.1.3. Проведение сигналов с рецепторов семейства 7–членных трансмембранных «гармошек»
Рц этого семейства приводят сигналы, обеспечивающие общую физиологическую функцию — базисную воспалительную реакцию в тканях. Лигандами для таких Рц являются бактериальные пептиды, содержащие N–формилметионин (fMet, с этой АК начинается трансляция всех белков у прокариот), анафилатоксины комплемента (C5a, C3a, C4a), хемокины. Такую же структуру 7–членной «гармошки» имеют фоторецепторы — родопсин и бактериородопсин.
Внутри
клетки Рц семейства 7–членной «гармошки»
передают сигнал на так называемые
большие G–белки
(ГТФ/ГДФ–связывающие белки) (рис. 6.4). К
настоящему времени охарактеризовано
20 таких больших G–белков,
все они тримеры, их молекулы состоят из
трёх цепей — G,
G,
G.
Разные G–белки
проводят сигналы на различные гены в
ядре клетки. В неактивном состоянии эти
белки физически не ассоциированы с
цитоплазматическими участками молекулы
Рц, и G–цепь
образует комплекс с ГДФ (гуанозиндифосфатом).
При связывании Рц с лигандом
цитоплазматический участок Рц захватывает
свой G–белок,
ГДФ замещается на ГТФ (гуанозинтрифосфат)
и G–цепь
диссоциирует от димера (G
+ G).
Таким образом, активированный G–белок
взаимодействует с аденилатциклазой и
фосфолипазой C–,
которые
катализируют образование таких активных
продуктов, как циклический аденозинмонофосфат
(цАМФ), фосфатидилинозитол трифосфат
(РIР3)
и диацилглицерол (ДАГ).
Эти вторичные посредники в свою очередь
активируют различные процессы в клетке —
метаболизм, подвижность, пролиферацию,
экспрессию генов.
Рис. 6.4. Проведение сигналов с рецепторов семейства 7–членной «гармошки» [Рц для хемокинов, анафилотоксинов комплемента (C5a, CЗa, C4a) и бактериальных пептидов, содержащих формилметионин (fMet)]. PLC–г — фосфолипаза C–г. PLC–г расщепляет фосфатидилинозитолдифосфат клеточной мембраны (PIP2) на диацилглицерол (ДАГ), который остаётся в мембране, и инозитолтрифосфат, который уходит внутрь клетки и высвобождает Ca2+ из депо, участвующих в дальнейших реакциях активации. цАМФ — циклический аденозинмонофосфат.
6.1.4. Проведение сигналов от рецепторов к цитокинам
Проведение сигналов с Рц к цитокинам отличается быстротой, что ожидаемо в соответствии с физиологическими функциями, зависящими от цитокинов (очень быстро, но не надолго). Путь проведения сигналов с Рц для цитокинов в общем виде следующий (рис. 6.5).
Рис. 6.5. Проведение сигналов с рецепторов для цитокинов (схема). Путь проведения сигналов с Рц для цитокинов — самый короткий из известных. Цитоплазматические участки молекул Рц опираются на киназы семейства Janus, которые фосфорилируют белки семейства STAT, последние сами и являются факторами транскрипции. Димеры (гомо- и гетеро-) STAT мигрируют в ядро, где и инициируют транскрипцию с генов.
1) цитоплазматические участки молекул Рц внутри клетки «опираются» на киназы семейства Janus;
2) киназы Janus фосфорилируют цитозольные белки семейства STAT;
3) фосфорилированные молекулы STAT димеризуются, образуя либо гомо-, либо гетеродимеры;
4) димеры STAT перемещаются в ядро и сами инициируют транскрипцию с тех или иных генов.
Разные киназы Janus и различные факторы транскрипции STAT «работают» при разных Рц для цитокинов.
Цитокины сами по себе неспецифичны по Аг, но их эффекты тем не менее реализуются в норме антигеннаправляемо. Так происходит потому, что в норме цитокины секретируются направленно в межклеточный синапс, формируемый между двумя взаимодействующими клетками. Формирование наиболее прочных синапсов происходит именно вокруг Рц лимфоцитов для Аг, связавших свои лиганды на АПК.
6.2. Ингибирующие рецепторы
Иммунологи
давно знали, что если экспериментальному
животному незадолго до Аг или одновременно
с Аг ввести готовые АТ к данному Аг, то
индукция новой продукции АТ к данному
Аг не происходит, т.е. иммунный ответ
при некоторых условиях не развивается
при наличии Аг в организме. Относительно
недавно начали разбираться в механизмах
этого феномена. Обнаружили, что на
лимфоцитах В, T
и NK
и некоторых лейкоцитах есть особые Рц,
связывание которых с лигандом приводит
к подавлению тех или иных процессов в
клетке. В цитоплазматических участках
молекул этих Рц выявили характерный
рисунок последовательности АК, который
назвали ITIM
(immunoreceptor
tyrosine–based
inhibition
motif —
тирозинсодержащие ингибирующие
последовательности АК в иммунорецепторах).
ITIM —
остатки одной из гидрофобных АК —
изолейцина (I)
или валина (V),
некой АК (X),
тирозина (Y),
двух каких–либо АК (X,
X),
лейцина (L),
т.е. ... [I/V]
XYXXL
... . Эти последовательности ITIM
в клетке ассоциированы с особыми
ферментами — ингибиторными фосфатазами
SHP–1
и SHP–2.
Эти фосфатазы имеют 1 или больее
SH2–доменов
для белок–белкового взаимодействия
по фосфорилированному остатку тирозина
и связываются с фосфорилированным
остатком тирозина в ITIM
(например, SHIP —
инозитолфосфатаза, которая удаляет
5'–фосфат с фосфатидилинозитол трифосфата
(PIP3).
Каким-то образом активность этих фосфатаз
блокирует вовлечение в активацию киназ
семейства Tec и фосфолипазы PLC–.
Соответственно в клетке снижается
содержание фосфатидилинозитол трифосфата
(РIР3)
и диацилглицерола (ДАГ)
и активация клетки блокируется.
Известны следующие конкретные ингибирующие Рц.
На
B–лимфоцитах:
особый
Fc–Рц
для тяжёлых цепей молекул иммуноглобулинов
класса G —
FcRIIB–1
(в цитоплазматическом участке содержится
один ITIM);
Рц
PIR–B
(paired
immunoglobulin–like
receptor)
(содержит один ITIM,
связан с ингибирующей фосфатазой SHP–1);
Рц
CD22
(содержит три ITIM).
На
T–лимфоцитах:
Рц CTLA–4
(содержит один ITIM,
связан с ингибирующей фосфатазой SHP–2).
На
цитотоксических T–лимфоцитах (ЦТЛ) и
нормальных киллерах (NK)
Рц из семейства KIR:
KIR
2DL (содержит один ITIM);
KIR
3DL (содержит один ITIM).
Среди
иммуноглобулиноподобных Рц цитотоксических
лимфоцитов (KIR)
есть активирующие и ингибирующие.
Ингибирующие KIR
экспрессированы на NK
и части ЦТЛ. Два названных выше Рц
связывают различные молекулы MHC–I.
Вариант KIR–p58
состоит из двух внеклеточных доменов
и связывает Аг локуса HLA–C.
Вариант KIR–p70
состоит из трёх внеклеточных доменов
и связывает Аг локуса HLA–B.
Описаны и другие ингибирующие Рц на NK
и части (5%)
CD8+
ЦТЛ, например димер CD94–NKG2C.
Этот Рц распознаёт большинство
исследованных вариантов молекул MHC–I,
а также неклассическую молекулу MHC–I
HLA–E.
В
зависимости от того, с каким активирующим
Рц и на каких клетках происходит
коагрегация ингибирующих Рц, выключается
тот или иной тип клеточной цитотоксичности:
с киллингактивирующим Рц на NK —
NK–цитотоксичность;
с FcRIIIA
на тех же NK–антителозависимая
клеточная цитотоксичность (АЗКЦТ); с
TCR —
ЦТЛ-цитотоксичность.
Вероятно, именно экспрессия ингибирующих рецепторов на некоторой части иммунных лимфоцитов превращает их в пул лимфоцитов памяти.
CTLA–4 экспрессируется по мере активации и дифференцировки иммунных T–лимфоцитов. Лигандами для CTLA–4 являются мембранные молекулы CD80 и CD86, т.е. те же самые, что служат лигандами корецептора CD28 неиммунных T–лимфоцитов, привлечённых АПК к иммунному ответу. CD80 экспрессирован на B–лимфоцитах, на активированных T–лимфоцитах, моноцитах/макрофагах и дендритных клетках. CD86 экспрессирован только на активированных B–лимфоцитах и моноцитах/макрофагах. Таким образом, по мере развития процессов активации в T–лимфоцитах в них возрастает и экспрессия собственного ингибирующего Рц.
Механизм
подавления продукции АТ в
B–лимфоцитах
на Аг, АТ к которому пассивно введены в
достаточном количестве в организм,
представляют следующим образом.
Ингибирующие Рц FcRIIB–1
на B–лимфоцитах
ко агрегируются с BCR
Аг в присутствии АТ класса G
(т.е. фактически иммунными комплексами).
При этом активационный сигнал с BCR
прерывается ингибирующими воздействиями
со стороны ферментативного аппарата
при FcRIIB–1.
Подобная коагрегация Рц для Аг и
ингибирующих Рц FcRIIB–1
возможна под влиянием не только Аг, но
и антиаллотипических, антиидиотипических
и антиизотипических АТ (рис. 6.6). Таким
образом, АТ (как конечный продукт) при
достижении определённой концентрации
ингибируют продукцию себе подобных в
своём клоне B–лимфоцитов.
Ингибирующие
Рц есть не только на лимфоцитах, но и на
лейкоцитах.
FcRIIB —
самый широко распространённый из всех
известных Рц для Fc–фрагментов
иммуноглобулинов. Он экспрессирован
на всех лейкоцитах. Причём если на
лимфоцитах преобладает изоформа
FcRIIB–1,
то на лейкоцитах миелоидного ряда —
FcRIIB–2.
Лигандами для FcRIIB–1/2
являются растворимые
комплексы
IgG
с Аг в действующих концентрациях порядка
миллиграмм на миллилитр. FcRIIB
способен модулировать (ингибировать)
активацию разных лейкоцитов (тучных
клеток, базофилов, эозинофилов,
нейтрофилов, моноцитов, дендритных
клеток), опосредованную АТ разных классов
(IgE,
IgA,
IgG).
To
что лигандом этого Рц являются
иммуноглобулины только класса G,
придает этому классу особые
иммунорегуляторные функции в разных
иммунологических реакциях и процессах.
Этот Рц — единственный из ингибиторных,
работающий с растворимыми лигандами,
остальные имеют в качестве лигандов
молекулы клеточных мембран. На тучных
клетках выявлен ещё один ингибирующий
Рц, названный MAFA —
Аг (Рц), ассоциированный с функциями
тучных клеток. MAFA
экспрессирован на тучных клетках и на
NK
(второе название — KLRG1),
причём на тучных клетках он конститутивно
ассоциирован с высокоаффинным Рц для
IgE —
FcRI.
Лиганд неизвестен, предположительно
молекула лиганда содержит углеводы.
При коагрегации с FcRI
MAFA
подавляет активацию тучных клеток. В
цитоплазматическом участке молекула
MAFA
содержит одну последовательность ITIM.
На
тучных клетках и NK
обнаружена мембранная молекула gp49B1,
которая коагрегирует с активирующим
Рц FcRI
и предположительно является ингибирующим
Рц. Однако лиганд для gp49B1
неизвестен. Предположение может не
подтвердиться.
6.3. Апоптоз — программируемая гибель клетки
Несмотря на то, что окружающая среда, как правило, нестерильна, внутренняя среда организма в норме сохраняет стерильность. Следовательно, борьба с инфекциями — постоянная составляющая жизненного процесса. Факты показывают, что при массированных вирусных инфекциях до 50% всех периферических CD8+ T–лимфоцитов составляют вирусспецифические клоны (таковы масштабы экспансии клонов при иммунных ответах). В острый период инфекционных заболеваний можно прощупать и даже увидеть увеличенные лимфатические узлы. Однако когда организм выздоравливает, количество лимфоцитов возвращается к норме. В отсутствие острых инфекционных воспалительных процессов поддерживается достаточно строгий гомеостаз числа лимфоцитов и в периферической крови, и в тканях. Поэтому насколько для лимфоцитов обязательна пролиферация в начале развития любого иммунного ответа, настолько же для лимфоцитов обязательна гибель по завершении иммунного ответа. Закономерная гибель отработавших лимфоцитов происходит по механизму апоптоз а. Второе название того же явления — программируемая смерть клетки.
Запрограммированность апоптоза означает, что в клетке доступны для активации внешними сигналами определённые гены («программа смерти»), кодирующие определённые продукты — ферменты, предназначенные для закономерной и необратимой дезинтеграции всей ДНК клетки и остального содержимого клетки. Но в нормальных клетках апоптоз не запускается по сугубо внутриклеточной программе развития отдельно взятой клетки. Нужен внешний сигнал. Для его восприятия на клетках, в жизненном цикле которых апоптоз является физиологическим, есть специальные Рц, т.е. существуют сигналы и Рц клеточной смерти.
Но, кроме того, отсутствие сигналов с других Рц, характеризующих жизненную активность клетки (эти сигналы называют сигналами на выживание), также при определённых условиях позволяет клетке выйти в апоптоз. Примером сигнала на выживание (и, следовательно, предотвращения апоптоза) является удовлетворительное связывание TCR с MHC–I или MHC–II при позитивной селекции тимоцитов в тимусе. Для периферических T–лимфоцитов сигналом на выживание вне режима развития иммунного ответа служит связывание с комплексами MHC с эндогенными пептидами — частичными агонистами (т.е. непрерывное узнавание своего).
Известно два способа смерти живой клетки — некроз и апоптоз.
Некроз — травматическая гибель по самым разным причинам (механическое или осмотическое нарушение целостности мембраны, ожог термический или химический, повреждение микробными или иными токсинами и т.д.). Некроз приводит к попаданию содержимого клетки в окружающую среду и в норме вызывает воспалительную реакцию.
Апоптоз — фрагментация содержимого клетки изнутри, осуществляемая специальными внутриклеточными ферментами, индукция и активация которых происходит при получении клеткой внешнего сигнала или при принудительной «инъекции» в клетку ферментов–активаторов апоптозной «машины» (последнее имеет место при осуществлении эффекторной функции ЦТЛ при убийстве ими клеток–мишеней). Апоптоз развивается и при повреждении клетки внешними факторами, не приводящими к некрозу, но способными инициировать апоптоз (ионизирующая радиация, обратимый перегрев и др.).
Явление одновременной гибели определённых клеток в многоклеточном организме наблюдали ещё в конце прошлого века — начале нашего и именно на лимфоцитах. Физиологи регистрировали, что при голодании в первую очередь организм теряет значительную часть лимфоцитов. Поскольку функции лимфоцитов в те времена были неизвестны, их даже называли трофоцитами как раз за то, что организм «съедает» их в первую очередь при голодании. Наблюдали также безвоспалительную гибель тимоцитов при введении в организм экспериментальных мышей глюкокортикоидных гормонов. Термин «апоптоз» тогда ещё не применяли.
Апоптозом более 20 лет назад назвали биологическое явление, описанное при гистологическом исследовании развития личинок круглых червей — почвенной нематоды Caenorhabditis elegans. У червей наблюдали одновременную гибель одного и того же числа клеток в строго определённый момент развития: тело личинки содержит 1076 клеток, а тело взрослой нематоды — 945, и ровно 131 клетка в нужный момент исчезает. Эта «ровность» навела на правильную мысль о запрограммированности такой клеточной смерти.
Термин «апоптоз» происходит от греческого apoptosis — листопад. У нематод идентифицировали два гена — ced–3 и ced–4, необходимые для осуществления апоптоза, и один ген ced–9, подавляющий апоптоз. В 1976 г. были опубликованы результаты биохимических экспериментов, в которых при электрофорезе ДНК обнаружили факт фрагментации ДНК на регулярные отрезки размером примерно 180 пар нуклеотидов. Как всякая регулярность и правильность, а не хаос это также навело на верную мысль о том, что в данном случае учёные столкнулись с закономерным явлением природы, имеющим отлаженный биохимический и клеточный механизм развития. Но с феноменом запрограммированной гибели клеток этот факт был «увязан» позже. У млекопитающих клетки всякой ткани, которой свойственна пожизненная физиологическая регенерация, в дифференцировке устанавливают программу на апоптоз.
Примеры морфогенетических событий, при которых происходит апоптоз, как минимум следующие:
удаление
стадиоспецифичных тканей и органов в
эмбриогенезе;
удаление
короткоживущих (несколько часов) клеток
крови (например, нейтрофилов);
позитивная
и негативная селекция тимоцитов;
элиминация
пролиферирующих клеток в отсутствие
их специфических факторов роста;
индуцированная
активацией смерть лимфоцитов.
Но вообще говоря, во всякой живой ткани есть какое-то количество клеток, претерпевающих апоптоз, ибо все ткани с той или иной скоростью обновляются, пока организм жив. Кроме того, апоптоз запускается в клетках–мишенях при работе таких эффекторов иммунитета, как ЦТЛ и NK, в том числе как эффекторы антителозависимой клеточной цитотоксичности.
У периферических лимфоцитов есть три Рц и три сигнала на апоптоз — Fas–FasL, TNFR1–TNF, Рц для глюкокортикоидов–глюкокортикоиды. Экспрессия этих Рц инициируется вместе с началом иммунного ответа и нарастает по мере активации и дифференцировки иммунных лимфоцитов. Всего же в иммунной системе не только в периферических тканях, но и при лимфопоэзе известны следующие пары Рц—лиганд, связывание которых индуцирует апоптоз в клетке — носителе Рц:
Рц
Fas
(CD95)
на клетке–мишени — Fas–лиганд
(FasL)
на мембране клетки–"убийцы», Рц Fas
относится к семейству Рц для TNF;
Рц
для глюкокортикоидных гормонов в
лимфоците — глюкокортикоидные
гормоны. Образование этого комплекса
как механизма индукции апоптоза
«работает» на территории тимуса при
позитивной селекции, причём глюкокортикоиды
синтезируются эпителиальными клетками
тимуса. На территории тимуса при
негативной селекции тимоцитов апоптоз
индуцирует Fas–лиганд,
экспрессированный на дендритных клетках
тимуса. Вероятно, глюкокортикоиды
индуцируют апоптоз и активированных
лимфоцитов в периферических тканях;
при
определённых сопутствующих условиях
Рц для фактора некроза опухоли — TNF
типа 1 (TNFR–1, p55) и его многочисленные
лиганды (например, TNF).
В настоящее время выделяют до 6 так
называемых Рц TRAIL
(TNF–receptor–related
apoptosis
inducing
ligand),
родственных Рц для TNF,
лиганды которых могут вызывать апоптоз;
CD30
(на тимоцитах или T–лимфоцитах) —
CD30L
(на эпителии и дендритные клетки мозговой
зоны тимуса и других клетках).
После связывания с лигандом Рц Fas тримеризуются. В цитоплазматических участках Рц Fas и TNFR–1 есть особые «домены смерти», обеспечивающие белок–белковое взаимодействие с адапторными белками FADD (связывается с Fas–Рц изнутри клетки) и TRADD (связывается с TNFR–1). Эти адапторные белки связывают особый фермент — цистеиновую протеазу каспазу–8. C–концевой участок этой молекулы является прокаспазой. Каким-то образом в начало апоптозного процесса вовлекаются митохондрии: повышается проницаемость их мембраны и из митохондрий в цитозоль высвобождается цитохром С. В цитозоле цитохром С образует комплекс с белком Apaf–1. Этот комплекс активирует каспазы, в первую очередь каспазу–8. Каспаза–8 запускает каскад активации других каспаз, последняя из которых (возможно, каспаза–3) активирует особую ДНКазу CAD. Эта ДНКаза разрезает ДНК клетки между нуклеосомами на куски размером примерно по 200 (50–300) пар нуклеотидов.
Каспазы — (относящиеся к апоптозу цистеиновые протеазы CASP) аспартатспецифические протеазы, ключевые ферменты воспаления и апоптоза, осуществляют деградацию множества клеточных белков, функционируют во внутриклеточных сигнальных путях на промежуточных и завершающих стадиях реализации апоптоза. В апоптозе участвуют два класса каспаз — инициаторы и эффекторы. Проапоптозным сигналом активируются инициаторные каспазы ‑2, –8, –9). Инициаторные каспазы процессируют эффекторные каспазы ‑3, –6, –7), действие которых и приводит к гибели клетки вследствие расщепления специфических субстратов, в первую очередь ферментов метаболизма нуклеиновых кислот (например, поли[АДФ-рибоза] полимераза, КФ 2.4.2.30).
Номенклатура
каспаз.
У человека известно 11 каспаз семейства
ICE/CED–3 (ICE — от Interleukin 1
Converting Enzyme [каспаза 1], КФ 3.4.22.36; CED–3 —
от CEll Death gene ced–3 почвенной нематоды
Caenorhabditis
elegans).
Для членов этого семейства предложено
тривиальное имя «каспаза» — «caspase» («c»
от «cysteine»), «aspase» от «asp» («aspartic acid» —
расщепление полипептида после остатка
аспарагиновой кислоты). Для обозначения
отдельных каспаз добавляется номер
фермента (каспаза 1, каспаза 2, ..., каспаза
13).
Параллельно и, по-видимому, независимо от фрагментации ДНК наступает фрагментация остального содержимого клетки (рушится цитоскелет), и клетка сначала сморщивается и уменьшается в размерах, затем распадается на апоптозные пузырьки, или тельца. При этом внутриклеточное содержимое почти не вытекает во внеклеточную среду и в окружающей ткани не развивается воспаление. Поэтому тимус, в котором больше 95% тимоцитов, непрерывно погибает апоптозом, не болит, не отекает, не краснеет, не повышается его температура.
Каспазы
связаны с кислыми и нейтральными
сфингомиелиназами, которые, будучи
активированными, генерируют церамиды
и ганглиозиды, меняющие мембраны клетки.
В результате ядро постепенно сморщивается
и фрагментируется. Клеточная мембрана
теряет упругость, местами происходит
инверсия фосфолипидов и наружу
«выворачивается» фосфатидилсерин. Его
способны распознавать макрофаги и
дендритные клетки (ДК). Затем клетка
распадается на окружённые мембраной
фрагменты — апоптозные
тельца.
Внутриклеточное содержимое при этом
не «вытекает» во внеклеточную среду.
Воспалительная реакция в ткани не
развивается. Апоптозные
тельца — мембранные пузырьки —
фагоцитируют макрофаги либо поглощают
ДК макроэндоцитозом. Макрофаги сорбируют
апоптозные тельца следующими молекулами
своей мембраны: интегрином v3
молекулой CD36
(молекула адгезии, GPIIIb),
Рц для «мусора» (scavenger
receptor).
ДК сорбируют апоптозные тельца интегрином
v3
и молекулой CD36.
Макрофаги разрушают вещество апоптозных телец до мелких метаболитов. При этом не активируется продукция провоспалительных цитокинов в макрофагах. А вот дендритные клетки перерабатывают вещества апоптозных телец, как и любых других Аг, и в результате экспрессируют на мембране комплексы пептидов с молекулами MHC–I и II. Среди пептидов находятся как экзогенные, например, вирусные (если апоптозу подверглась инфицированная вирусом клетка), так и пептиды — фрагменты собственных белков организма. Дендритные клетки способны индуцировать иммунный ответ на компоненты апоптозных телец. Именно такие процессы лежат в основе развития иммунного ответа на собственные повреждённые ткани, а также на тканевые Аг чужеродных трансплантатов.
Известны гены (по крайней мере два), продукты которых предотвращают апоптоз. Это гены Bcl–2 (соответственно белок bcl–2) и Bcl–x. Ген Bcl–2 млекопитающих гомологичен гену ced–9 у нематод. С гена Bcl–x в результате альтернативного сплайсинга первичного РНК–транскрипта получаются два белка — малый (small) bcl-xS и большой (large) bclL. Белок bcl–xS индуцирует апоптоз, а белок bclL апоптоз предотвращает. Механизм антиапоптозного действия белка bcl–2 предположительно известен: этот белок связывается с мембраной митохондрий и препятствует высвобождению из этих органелл цитохрома С, без чего апоптоз не начинается. Излишняя экспрессия этих антиапоптозных белков происходит при лимфопролиферативных заболеваниях и хронических воспалительных процессах, например при ревматоидном артрите в T–лимфоцитах синовиальных полостей. В последнем случае полагают, что антиапоптозные сигналы лимфоциты синовиальных полостей получают от разросшихся фибробластов стромы, что в патогенезе заболевания является первичным процессом по отношению к патогенетическим эффектам активированных T–лимфоцитов.
Сигналы
для экспрессии Bcl–2
и
Bcl–xL,
вероятно,
приходят с –цепи
Рц для цитокинов, общей у Рц для
интерлейкинов 2, 15, 4, 7 и 13. Кроме того,
при анализе механизмов хронического
воспаления суставов при ревматоидном
артрите установили, что индукция
антиапоптозных генов в зрелых T–лимфоцитах
(которым в норме положено было бы умереть
апоптозом), вероятно, происходит при
взаимодействии молекул интегринов на
фибробластах (активный пептид
Arg–Gly–Asp–Ser)
с молекулой LFA–1
(CD11a/CD18)
на T–лимфоцитах.
Кстати, в экспериментах с B–лимфоцитами показано, что активация B–лимфоцита через специфический Рц для Аг (BCR) сопряжена с защитой от апоптоза на несколько дней, необходимых для развития иммунного ответа, тогда как стимуляция B–лимфоцита, помимо BCR, например митогенами, приводит к их быстрому, опосредованному через Fas–Рц апоптозу.
Индукция так называемой высокодозовой толерантности (когда в организм парентерально вводят большую дозу специфического Аг) по механизму — это элиминация Аг–специфичного клона лимфоцитов апоптозом как следствие «ударной» активации клона специфическим Аг. Превышение меры — всегда патология.
В
норме факторы транскрипции, образующиеся
при нормальном ходе активации
T–лимфоцита, — АP–1, NFAT,
NFB —
активируют и энхансерные последовательности
для Fas–лиганда,
что создаёт перспективу для апоптоза
лимфоцитам, «отработавшим» в иммунном
ответе.
Суперантигены индуцируют апоптоз сразу после пролиферации поликлонально «охваченных» T–лимфоцитов, они также индуцируют апоптоз дендритных клеток. Все перечисленное объясняет продолжительную иммунодепрессию после воздействия на организм суперантигенов.
Описаны наследственные дефекты в Fas или/и FasL: такие люди с самого рождения страдают тяжёлыми формами лимфо-пролиферативных или/и аутоиммунных болезней, быстро приводящих к смерти.
У млекопитающих выявлены и другие гены, кодирующие продукты подавления апоптоза: Bcl–w, Mcl–1, ALG–3 и др. Гены, ингибирующие апоптоз «наших» клеток, найдены у вирусов Эпштейна–Барр, аденовирусов, вируса африканской лихорадки свиней. Наличие таких генов у вирусов положительно коррелирует с их онкогенностью. Поэтому не напрасно клиницисты рассматривают эти вирусы как потенциально онкогенные. Есть и гены, ускоряющие апоптоз. У млекопитающих выявлены такие гены —Bax и Bad. Белки, кодируемые этими генами, функционируют в виде димеров. Возможно образование димеров из проапоптозного белка bах с антиапоптозным белком bcl–2 (bax—bcl–2). От баланса про- и антиапоптозных белков в клетке зависит, будет лимфоцит жить или погибнет.
Таким образом, физиологический апоптоз сопряжен с активацией и пролиферацией лимфоцитов. Это сопряжение настолько обязательно, что феномен гибели лимфоцитов после активации получил отдельное название — «индуцированная активацией смерть клеток».
Однако апоптоз может быть инициирован в клетке и факторами физического проникающего патогенного внешнего воздействия. Например, апоптоз запускается в клетках, в которых произошло радиационное повреждение ДНК в большем объёме, чем могут «исправить» ферменты репарации ДНК. Некроза клеток при этом нет, есть именно апоптоз. Внутриклеточным фактором, инициирующим программу на апоптоз в данном случае, вероятно, является некий белок с молекулярной массой 53 кДа, поэтому он обозначен p53. Физиологические функции этого белка неизвестны, неизвестно даже, функционирует ли он в норме. Но вот при дефектах в гене p53 развиваются опухоли. У нокаутированных мышей по гену p53 онтогенез примерно до 10–месячного возраста проходит без видимых отклонений, но после 10 мес практически все такие животные умирают от рака или саркомы. Так или иначе к настоящему времени сложилось представление, что белок p53 необходим для инициации апоптоза в клетках, в которых повреждена ДНК. Причины повреждений ДНК могут быть самые разные: вирусные инфекции, ионизирующая радиация, химический мутагенез и др. Если клетка не справляется с репарацией наступивших повреждений ДНК, то p53 запускает в этой клетке апоптоз. Эта рабочая гипотеза достаточно эффективно оправдывает себя в прикладных исследованиях по поиску фармакологических средств, предназначенных для защиты клеток от апоптоза. Такая проблема существует у онкологических больных во время курсов интенсивной противоопухолевой химиотерапии. Современные химиотерапевтические препараты — это цитостатики, большинство из них — антиметаболиты ДНК. Они токсичны не только для клеток опухоли, но и других делящихся клеток — эпителия слизистых оболочек и кожи, всех ростков кроветворения и др. Поэтому у больных в качестве побочных эффектов лечения развиваются анемия, лейкопения, тромбоцитопения, выпадают волосы, возникают проблемы с работой кишечника. Появилась и успешно разрабатывается идея временного фармакологического подавления в организме p53 только на период курса противоопухолевой химиотерапии. Временное отсутствие p53 спасет разные клетки от апоптоза, потенциально вызываемого химиопрепаратами, кроме клеток самой опухоли, поскольку в ней p53 и так не функционирует. Или, например, если тимоциты in vitro поместить в среду с температурой 43 °C, то они через некоторое время погибнут по механизму некроза. Но если те же тимоциты прогреть до той же температуры 43 °C в течение 3 мин, после чего «вернуть» к физиологической температуре 36,7 °C, то тимоциты будут все равно погибать, но по механизму апоптоза. Кроме того, постнатальный апоптоз возможен и не в лимфоидной ткани, например апоптоз гепатоцитов при алкогольных циррозах печени, при которых обнаружили экспрессию Fas и FasL именно на гепатоцитах.
Глава 7. ИММУННЫЙ ОТВЕТ
7.1. Определение иммунного ответа. Этапы иммунного ответа
определили иммунитет как особое биологическое свойство и показали его место среди других биологических механизмов защиты многоклеточных организмов от инфекций. Иммунный ответ — это иммунитет в действии, т.е. процесс иммунного воспаления, инициированный патогеном. Кратко определить иммунный ответ можно ещё и так:
Распознавание повреждённых патогеном клеток и тканей организма лимфоцитами с целью деструкции и выведения из организма.
Элиминация из организма тканей, повреждённых патогеном, в ходе воспалительного процесса с участием лимфоцитов.
Доиммунное воспаление + распознавание повреждённых клеток лимфоцитами + деструкция повреждённых тканей в ходе иммунного воспалительного процесса + выведение продуктов деструкции из организма.
Дадим ещё раз в конспективном виде характеристики иммунного ответа, по которым его можно отличить от других защитных процессов, с одной стороны, и увидеть его сопряженность с другими защитными механизмами — с другой. Это и будет длинное, но конкретное определение иммунного ответа: иммунный ответ — это такой процесс, в котором можно найти совокупность перечисленных ниже характеристик:
1) иммунный ответ — воспалительный процесс с обязательным участием лимфоцитов;
2) лимфоциты — единственный тип клеток в организме, в дифференцировке которых происходит обязательная соматическая рекомбинация ДНК и именно сегментов генов Рц для Аг. В результате в течение всего онтогенеза в организме непрерывно генерируется беспрецедентное разнообразие клонов лимфоцитов по Рц для Аг — 1018 вариантов у T–лимфоцитов и 1016 вариантов у B–лимфоцитов;
3) кроме Рц для Аг, на мембране лимфоцитов есть инвариантные, но строго необходимые для развития иммунного ответа корецепторы;
4) связывание Рц лимфоцита для Аг своего лиганда необходимо, но недостаточно для инициации иммунного ответа;
5) Рц T–лимфоцита для Аг распознаёт (связывает) повреждённые (изменённые) патогеном структуры собственных тканей, а не патоген сам по себе как таковой;
6) для инициации иммунного ответа лимфоциту необходимо получить сигналы по «двум каналам» — с Рц для Аг и с корецепторов;
7) сигналы с корецепторов поступают к лимфоцитам от клеток доиммунного воспаления (дендритных клеток, макрофагов, покровных эпителиев) и их биологически активных продуктов;
8) клетки доиммунного воспаления не имеют большого разнообразия Рц, их Рц инвариантны, консервативны, кодируются зародышевыми генами, но именно эти Рц первыми избирательно связывают продукты микроорганизмов, не характерные для макроорганизмов. Следовательно, именно Рц клеток доиммунного воспаления — «носители эволюционной памяти», которые первыми отличают «чужое» от «своего» и биохимически информируют лимфоциты о факте проникновения чужого во внутреннюю среду;
9) Рц лимфоцита для Аг направляет иммунные лимфоциты (как вектор) к своим тканям, повреждённым патогеном;
10) лимфоцит при инициации иммунного ответа связывает свой лиганд в лимфоидных органах, активируется, обязательно пролиферирует, додифференцируется и мигрирует в кровь. В очаге поражения уже иммунный лимфоцит выходит из крови в ткань, там вновь связывает Рц для Аг свой лиганд и либо сам подвергает повреждённые клетки деструкции (ЦТЛ), либо выделяет цитокины, «нанимающие» на деструкцию макрофаги, эозинофилы, нормальные киллеры и другие лейкоциты (рис. 7.1).
Рис. 7.1. Иммунологический синапс между T–лимфоцитом и АПК. Минимальный набор взаимодействий, необходимых для начала развития иммунного ответа: 1 — связь агрегированных TCR с комплексами пептид—MHC; 2 — связь корецептора CD4 (или CD8) с MHC; 3 — связь CD40 с CD40L; 4 — связь B7 с CD28; 5 — связи молекул адгезии (ICAM, LFA); 6 — взаимодействия цитокинов с Рц для цитокинов.
Иммунное воспаление — воспаление с участием лимфоцитов. Иммунное воспаление — наиболее активное и агрессивное по сравнению с доиммунным воспалением, т.е. вариантами воспалительных процессов, развивающихся без вовлечения в них лимфоцитов.
Этапы развития иммунного ответа во времени таковы:
доиммунное
воспаление в очаге внедрения патогена;
распознавание и поглощение патогенов
и их продуктов дендритными клетками
(АПК);
представление
Аг лимфоцитам в лимфоидных органах;
пролиферация
лимфоцитов;
эффекторная
дифференцировка лимфоцитов;
иммунное
воспаление с деструкцией тканей,
повреждённых патогеном;
регенерация
тканей в очаге повреждения.
Более подробно можно описать следующие события и процессы.
Всё
начинается с проникновения Аг во
внутреннюю среду организма. В природе
это происходит при травмировании
покровных тканей. При этом в покровных
тканях выделяются определённые вещества
(стресc–протеины, белки теплового шока,
цитокины кератиноцитов и клеток
соединительной ткани) — медиаторы
доиммунного воспаления, которые готовят
почву для развития, если понадобится,
лимфоцитарного имммунного воспаления.
Попадание Аг без значимой травмы покровов
сразу во внутреннюю среду в природе —
событие редкое. Это, как правило,
искусственное антропогенное явление
парентерального введения веществ или
трансплантации тканей и органов.
Доиммунные
защитные реакции в отношении Аг направлены
на то, чтобы не пустить Аг глубже покровов.
В первую очередь это сосудистые реакции:
расширение сосудов микроциркуляторного
русла, повышенный выпот из сосудов в
ткани плазмы или сыворотки (соответственно
всех сывороточных факторов доиммунной
резистентности к инфекциям) и экстравазация
лейкоцитов, в первую очередь фагоцитов —
нейтрофилов. Локальный отёк препятствует
всасыванию Аг в системную циркуляцию.
Проникший
в покровы патоген сорбируют и поглощают
эндоцитозом дендритные клетки,
фагоцитируют макрофаги. И те и другие —
профессиональные АПК, но только дендритные
клетки обладают особыми способностями —
мигрируют из покровов с Аг в регионарные
лимфоидные органы. «По дороге» дендритные
клетки процессируют Аг, экспрессируют
на мембрану комплексы пептидов с MHC–I
и MHC–II и необходимые корецепторные
молекулы, с помощью которых они смогут
вступить в эффективное воздействие с
T–лимфоцитами в T–зависимых зонах
периферических лимфоидных органов.
Кроме АПК, в покровных тканях Аг встречают
внутриэпителиальные лимфоциты, среди
которых много T,
распознающих непептидные Аг без
предварительного процессинга и
презентации АПК. Под покровами, в
плевральной и брюшной полостях, для
перехвата широко распространённых
микробных Аг существуют АТ с широкой
перекрестной реактивностью — продукты
B1–лимфоцитов.
«Неперехваченный»
в барьерных тканях Аг, всосавшийся в
системную циркуляцию, если он опасен
для организма, сразу начнет приносить
вред. Шанс на развитие иммунного ответа
на него обусловлен тем, что есть такой
лимфоидный орган, как селезёнка, через
которую проходит весь объём крови за
цикл циркуляции, и АПК в синусоидах
селезёнки (дендритные клетки и макрофаги)
будут пытаться сорбировать Аг.
Пришедшие
в лимфатические узлы дендритные клетки
с Аг (их называют «интердигитирующие
дендритные клетки» в
отличие от иных, фолликулярных, дендритных
клеток) располагаются в T–зависимых
зонах и представляют
Аг
для «рассмотрения» интенсивно мигрирующим
T–лимфоцитам. Среди T–лимфоцитов рано
или поздно найдется такая клетка, у
которой Рц для Аг окажется комплементарным
данному Аг (т.е. свяжет Аг/MHC с константной
диссоциации по абсолютной величине
показателя степени не ниже чем 10–6–10–9
М). Если при этом состоятся все необходимые
и достаточные корецепторные взаимодействия
с АПК (см. рис. 7.1), то T–лимфоцит получит
активационный сигнал, и с этого момента
начнется собственно иммунный ответ —
лимфоцитарный.
T–лимфоцит
начнет пролиферироватъ
и
дифференцироваться.
В
результате образуется клон антигенспецифичных
дифференцированных T–лимфоцитов. Такие
T–лимфоциты уже называют иммунными
лимфоцитами, лимфоцитами-эффекторами.
В
процессе дифференцировки T–лимфоцит
экспрессирует в надлежащем количестве
мембранные молекулы и цитокины,
необходимые для взаимодействия с
B–лимфоцитами,
лейкоцитами или для атаки на клетки–мишени.
В
T–зависимых зонах периферических
лимфоидных органов происходит
взаимодействие активированных Аг
T–лимфоцитов с активированными Аг
B–лимфоцитами.
Провзаимодействовавший
с Аг и с T–лимфоцитами B–лимфоцит
мигрирует в зону фолликула, где
пролиферирует
и
дифференцируется
в
антителопродуцента — плазматическую
клетку. Сюда же, на территорию фолликула,
мигрируют и Тh2–лимфоциты, на которых
в результате взаимодействия с
активированными Аг B–лимфоцитами
экспрессируется особый Рц к хемокину —
blr–1,
обеспечивающий избирательное движение
на территорию фолликула. Первые
плазматические клетки остаются в
лимфатическом узле, и секретируемые
ими АТ в значительном количестве остаются
здесь же — на Fc–Рц
фолликулярных дендритных клеток (ФДК).
V–области
этих АТ связывают свой
Аг.
В таком виде в комплексе с АТ, фиксированными
на ФДК, Аг может оставаться на территории
лимфоидного фолликула в течение
продолжительного времени (может быть
месяцы и годы). Здесь, в фолликулах, при
взаимодействии с этим Аг пойдет процесс
созревания
аффинности АТ, т.е.
соматического гипермутагенеза генов
V–бласти
иммуноглобулинов и отбора (положительный
сигнал на выживание) B–лимфоцитов с
наиболее высокоаффинными вариантами
АТ — только они и будут выживать и
пролиферировать при вторичном иммунном
ответе.
Иммунные
B–лимфоциты,
дифференцировавшиеся в плазмоциты,
уходят из фолликулов лимфоидных органов
и мигрируют преимущественно в костный
мозг или слизистые оболочки, где и
«отрабатывают» массовую продукцию
секретируемых в кровь или в слизистые
секреты АТ. Плазмоциты из B–лимфоцитов
лимфоидной ткани слизистых оболочек,
продуцирующие АТ класса А (а также,
вероятно, в определённой мере и Е),
предназначенные для экскреции в слизистые
экзосекреты, остаются для массовой
продукции иммуноглобулинов в слизистой
оболочке.
Иммунные
T–лимфоциты-эффекторы (ЦТЛ, Тh1, Th2) выходят
из регионарных лимфатических узлов
через эфферентные лимфатические сосуды,
попадают в грудной лимфатический проток
и оттуда в системную циркуляцию. Дальше
они мигрируют через кровь в очаг
воспаления в месте проникновения или
диссеминации патогена: молекулы адгезии
на иммунном лимфоците иные, чем на
неиммунном. Иммунный лимфоцит «узнает»
эндотелий сосудов микроциркуляции
именно в очагах повреждения тканей и
воспаления. Там TCR,
если находит, то связывает свой Аг, что
активирует лимфоцит. Состояние активации
в данном случае заключается в усиленном
биосинтезе и секреции эффекторных
молекул. В случае ЦТЛ это молекулы,
обеспечивающие убийство клеток–мишеней,
в случае CD4+
Th —
это цитокины, «нанимающие» для деструкции
Аг те или иные лейкоциты (макрофаги,
эозинофилы, тучные клетки, базофилы,
нейтрофилы).
Связанный
Аг подвергается фагоцитозу и разрушению
гидролитическими ферментами, кислородными
радикалами, радикалами окиси азота до
мелких метаболитов, которые экскретируются
из организма через системы выделения
(почки, ЖКТ).
Организм
санирован — первый результат
достигнут.
Супрессия
иммунного ответа — остановка
продуктивного иммунного ответа после
санации организма от патогена/Аг.
Второй
результат лимфоцитарной иммунной
реакции — иммунологическая память.
По современным представлениям, лимфоцитами
иммунологической памяти становится
некая часть иммунных лимфоцитов
(вероятно, порядка единиц процентов),
на которых экспрессировались особые
ингибирующие активацию Рц.
7.2. Иммунологическая память
Доиммунные механизмы резистентности «не запоминают» свою реакцию на Аг (патоген): он попадает в организм первый раз или десятый — реакция будет одинаковой (при одинаковом общем состоянии здоровья организма). Лимфоцитарный иммунитет «запоминает». Феномен иммунологической памяти проявляется в том, что в случае успешного иммунного ответа при первом попадании патогена в организм, при его повторных попаданиях санация наступает существенно быстрее и эффективнее, и патоген не успевает вызвать патологический инфекционный процесс. Это и называют протективным, т.е. защищающим от болезни иммунитетом.
В основе феномена иммунологической памяти лежат два явления:
При
первом иммунном ответе произошло
размножение лимфоцитов антигенспецифичного
клона, и не все из них израсходованы в
текущем иммунном ответе, не все
претерпевают апоптоз. Часть лимфоцитов
клона «замораживается» и персистирует
в организме в течение неопределённого
времени (для различных Аг время очень
разное — от нуля до пожизненного).
Оценка количества лимфоцитов, например
иммунных CD8+
T–лимфоцитов, на которых произошла
экспрессия ингибирующих Рц, показывает,
что это единицы процентов в сумме по
всем клонам.
Лимфоциты
памяти существенно меньше, чем неиммунные
лимфоциты, нуждаются в медиаторах
доиммунного воспаления и в костимуляторных
сигналах, чтобы начать иммунный ответ
на свой Аг, и могут начать его вне
воспаления или при минимальных симптомах
воспаления.
Несмотря на то что как клинический феномен «иммунологическая память» был известен с древних времён (практика иммунизации у античных греков и китайцев), клеточные и молекулярно–генетические механизмы иммунологической памяти до настоящего времени неизвестны. Неизвестно, почему на какие-то Аг иммунологическая память остаётся, на какие-то нет, на какие-то надолго, на какие-то быстро исчезает, а у различных особей — по-разному. Поэтому в настоящее время прогнозы результатов вакцинации — только эмпирические и статистические, но персонально их нельзя составить разумно при нынешнем уровне знаний. Одно из сомнений заключается в том, что, возможно, продолжительная иммунологическая память сохраняется лишь в тех случаях и на тот период времени, когда и пока в организме остаётся персистирующий Аг в виде латентной инфекции или каком-то ином виде.
Соотношение первичного иммунного ответа, вторичного ответа и ответа иммунологической памяти схематически показано на рис. 7.2.
Рис. 7.2. Первичный иммунный ответ, вторичный иммунный ответ и ответ иммунологической памяти. Такого рода соотношение величин первичного иммунного ответа, вторичного иммунного ответа и ответа иммунологической памяти бывает при введении в организм неразмножающихся Аг. Ответ иммунологической памяти бывает не всегда, и интенсивность его весьма различна в разных случаях. 1 — первичный иммунный ответ; 2 — вторичный иммунный ответ; 3 — ответ иммунологической памяти.
Параметры вторичного ответа по B–лимфоцитам в сравнении с первичным иммунным ответом приведены в табл. 7.1.
Таблица 7.1. Параметры B–лимфоцитов при первичном и вторичном иммунном ответе
Параметр |
При первичном ответе |
При вторичном ответе |
Частота встречаемости Аг–специфичных B–лимфоцитов в лимфоидных тканях |
10–4–10–5 |
10–3 |
Изотип продуцируемых АТ |
IgM >IgG |
IgG, IgA, IgE |
Аффинность АТ |
Низкая |
Высокая |
T–лимфоциты памяти отличаются от зрелых неиммунных T–лимфоцитов и по частоте встречаемости антигенспецифичного клона в лимфоидной ткани (больше в 10–100 раз), и по экспрессии ряда мембранных молекул. Главное, что T–лимфоциты памяти существенно меньше, чем впервые активируемые к иммунному ответу лимфоциты, нуждаются в костимулирующих воздействиях и поэтому быстрее и легче выходят в продуктивную эффекторную фазу иммунного ответа. Сравнительная экспрессия мембранных молекул на неиммунных зрелых T–лимфоцитах и на T–лимфоцитах памяти приведена в табл. 7.2.
Таблица 7.2. Относительная экспрессия мембранных молекул на зрелых неиммунных T–лимфоцитах и T–лимфоцитах памяти
Мембранная молекула, основные функции |
Относительный уровень экспрессии |
|
|
неиммунные T–клетки |
T–клетки памяти |
LFA–3 (CD58), лиганд для CD2; участвует в адгезии и подаче сигнала |
1 |
|
CD2, участвует в адгезии и активации |
1 |
|
LFA–1 (CD11a/CD18), участвует в адгезии и активации |
1 |
|
VLA–4, обеспечивает хоминг в ткани |
1 |
|
CD44, обеспечивает хоминг в ткани |
1 |
|
CD45RO, изоформа трансмембранной тирозинфосфатазы CD45 с наименьшей молекулярной массой |
1 |
|
CD45RA, изоформа трансмембранной тирозинфосфатазы CD45 с наибольшей молекулярной массой |
10 |
|
L–селектин, хоминг в лимфатические узлы |
Много |
На некоторых много, на некоторых мало |
CD3, инвариантный компонент TCR |
1 |
1 |
Молекула CD45 — трансмембранная тирозинфосфатаза, состоящая из одной полипептидной цепи. Ген CD45 имеет не менее 7 экзонов, 3 из которых, А, В и С, кодируют часть внеклеточного участка молекулы и могут подвергаться альтернативному сплайсингу на уровне первичного транскрипта РНК. Изоформа CD45RA содержит пептидные участки всех 3 экзонов А, В и С, поэтому она имеет наибольшую молекулярную массу. CD45RA экспрессируется на неиммунных зрелых T–лимфоцитах, и на них этот фермент не ассоциирован в мембране ни с TCR, ни с корецепторами. В иммунных T–лимфоцитах экзоны А, В и С удаляются альтернативным сплайсингом РНК, и в белок транслируется лёгкая изоформа CD45RO. Но главное, что в иммунных T–лимфоцитах эта тирозинфосфатаза уже не независимо присутствует где-то на мембране клетки, а ассоциирована с TCR и корецепторами и способствует существенному снижению (на два порядка и более) порога активации лимфоцита Аг (рис. 7.3).
Рис. 7.3. Структура изоформ молекулы CD45 на неиммунных T–лимфоцитах и T–лимфоцитах памяти. А. В зрелом неиммунном T–лимфоците все 7 экзонов CD45 в ДНК транскрибируются в РНК и транслируются в большой белок (тяжёлая изоформа молекулы CD45A на неиммунных лимфоцитах). Молекулы TCR, CD45, CD4 разобщены в мембране клетки. Б. В иммунных T–лимфоцитах в результате альтернативного сплайсинга РНК CD45 выщепляются три экзона и в белок транслируются только 4 оставшихся (лёгкая изоформа CD45RO у иммунных лимфоцитов). Молекулы TCR, CD45, CD4 приближены друг к другу в мембране клетки.
В описанной выше последовательности событий иммунного ответа не учтен целый ряд параметров: химическая природа Аг (патогена), доза Аг и его способность к размножению внутри организма, входные ворота, влияние Аг на другие системы организма (нервную, эндокринную и др.), наличие адъювантов и т.д. В реальной ситуации все это имеет значение и, более того, определяет как саму возможность развития иммунного ответа, так и его качество, и преобладание тех или иных эффекторных механизмов иммунитета (антителозависимые процессы, ЦТЛ, макрофагзависимые процессы, эозинофилозависимые процессы и т.д.). Разнообразие конкретных форм иммунного ответа описано в главе 8. Здесь же подчеркнём два специфичных именно для иммунного ответа процесса — признака, позволяющего отличить иммунный ответ от других защитных биологических механизмов, несмотря на тесное переплетение и взаимосвязи одного с другим в едином организме: это пролиферация лимфоцитов и иммунологическая память.
7.3. Взаимодействия клеток в иммунном ответе
В процессе развития иммунного ответа происходят взаимодействия разных клеток друг с другом: клеток покровных тканей с лимфоцитами, лимфоцитов с эндотелием стенки сосуда, T–лимфоцитов с АПК, T–лимфоцита с B–лимфоцитом, T–лимфоцитов с лейкоцитами, лимфоцитов и лейкоцитов с межклеточным матриксом и т.д.
Каковы механизмы взаимодействия клеток друг с другом внутри многоклеточного организма? Известны по крайней мере два и их варианты.
Межклеточные
контакты мембранами — адгезия клеток:
мембранные молекулы одной клетки
комплементарно
связываются
с мембранными молекулами другой клетки.
Одна
клетка синтезирует и секретирует
растворимое вещество, на мембране
другой(их) клетки(ок) есть молекула,
способная комплементарно
связать
именно это вещество (Рц — по
определению). Цитоплазматические связи
Рц обеспечивают проведение сигнала
внутрь клетки, вызывающее определённые
изменения внутриклеточного метаболизма,
которые называют реакцией клетки (или
биологическим эффектом).
Во втором варианте есть два существенно разных подварианта — дистантные и локальные взаимодействия.
Дистантно
осуществляются взаимодействия нервной
системы с другими клетками организма
и взаимодействия эндокринных гормонов
с клетками–мишенями.
Локально
осуществляется множество межклеточных
взаимодействий, в том числе в процессе
развития иммунного ответа. В последнем
случае растворимые вещества или медиаторы
называют цитокинами
(от
греческих корней цито — клетка и
кинос — движение, изменение, т.е.
вещества, предназначенные вызывать
изменения в клетках–мишенях). В отличие
от контактных взаимодействий мембранными
молекулами, которые достаточно инертны
во времени, взаимодействия с помощью
цитокинов гораздо более быстрые,
оперативные, динамичные.
Уточним понятие комплементарного взаимодействия. Это строгое химическое и количественное понятие. Между двумя молекулами устанавливаются химические связи 4 типов: ионные, водородные, ван–дер–ваальсовы и гидрофобные. Сила связи характеризуется константой диссоциации (Kd). Для взаимодействия иммунорецепторов с Аг Kd должна иметь показатель степени по абсолютной величине не ниже 7, т.е. 10–7–10–11 М. Для связи пептидов–Аг с молекулами MHC–I/II характерна Kd порядка 10–6. Для связей цитокинов с Рц для цитокинов Kd составляет 10–10–10–12 М, приводится и 10–15 М. Чем больше по абсолютной величине показатель степени в значении константы диссоциации, тем при меньших концентрациях действующего вещества достигается значимый биологический эффект. Из всех известных биологически активных веществ (по крайней мере из имеющих значение для иммунологии) Kd для цитокинов наибольшие, что свидетельствует о высокой биологической активности низких концентраций цитокинов.
7.3.1. Молекулы межклеточной адгезии
Номенклатура молекул межклеточной адгезии, используемая в настоящее время, не рациональная: для одной и той же молекулы существует более чем одно обозначение. Названия, как правило, отражают экспериментальную систему, в которой молекула была впервые идентифицирована. Тем не менее по структурному принципу выделяют 4 семейства молекул межклеточной адгезии (табл. 7.3):
1) селектины;
2) муциноподобные сосудистые адрессины;
3) интегрины;
4) молекулы из надсемейства иммуноглобулинов (IgSF — immunoglobuline superfamily).
Таблица 7.3. Молекулы адгезии клеток
Наименование |
Экспрессия |
Лиганды |
СЕЛЕКТИНЫ Начинают взаимодействие между лейкоцитом и эндотелием |
||
L–селектин (CD62L) |
Неиммунные лимфоциты; некоторые лимфоциты памяти; нейтрофилы; моноциты; эозинофилы |
Углеводы: сульфатированный сиалил Lewisx; GlyCAM–1; CD34; MAdCAM–1 |
P–селектин (CD62P) |
Активированный эндотелий; тромбоциты |
Cиалил–Lewisx; PSGL–1 |
Е–селектин (CD62E) |
Активированный эндотелий |
Cиaлил–Lewisx |
МУЦИНОПОДОБНЫЕ СОСУДИСТЫЕ АДРЕССИНЫ Связывают L–ceлектин при инициации взаимодействия лейкоцита с эндотелием |
||
CD34 |
Эндотелий; стволовые кроветворные клетки |
L–селектин |
GlyCAM–1 |
Высокий эндотелий венул |
То же |
MadCAM–1 |
Эндотелий венул в слизистых оболочках |
L–селектин;
|
ИНТЕГРИНЫ Связывают разные молекулы адгезии на клетках и молекулы внеклеточного матрикса. Обеспечивают сильное связывание |
||
|
Моноциты, макрофаги, T–лимфоциты, дендритные клетки, нейтрофилы |
ICAM–1; ICAM–2; ICAM–3 |
(Mac–1; CR3; CD11b/CD18) |
Нейтрофилы, моноциты, макрофаги |
ICAM–1; iC3b; фибронектин |
|
Дендритные клетки, макрофаги, нейтрофилы |
iC3b |
|
Лимфоциты, моноциты, макрофаги |
VCAM–1 |
|
Моноциты, макрофаги |
Фибронектин |
|
Лимфоциты |
MAdCAM–1 |
|
Внутриэпителиальные лимфоциты |
Е–кадгерин |
Надсемейство иммуноглобулинов Лиганды для интегринов |
||
CD2 (LFA–2) |
T–лимфоциты |
LFA–3 |
ICAM–1 (CD54) |
Лимфоциты, дендритные клетки, активированный эндотелий |
LFA–1, Mac–1 |
ICAM–2 (CD102) |
"Спокойный» эндотелий, дендритные клетки |
LFA–1 |
ICAM–3 (CD50) |
Лимфоциты |
LFA–1 |
LFA–3 (CD58) |
Лимфоциты, АПК |
CD2 |
VCAM–1 (CD106) |
Активированный эндотелий |
VLA–4 |
Селектины — молекулы на поверхности лимфоцитов и лейкоцитов, а также эндотелия, которые обеспечивают избирательный (селективный) хоминг определённой клетки через стенку сосуда в определённой ткани. Общим в молекулярной структуре селектинов, которые содержат лишь одну трансмембранную полипептидную цепь, является наличие во внеклеточной части лектиноподобного домена. Лектины — белки, способные комплементарно связывать сахара.
Лигандами для селектинов являются так называемые адрессины — муциноподобные молекулы на поверхности эндотелия. Адрессины CD34 и GlyCAM–1 экспрессированы на клетках высокого эндотелия посткапиллярных венул в лимфатических узлах. САМ — Cell Adhesion Molecules (молекулы клеточной адгезии). Адрессин MAdCAM–1 (Mucosal Adressin Cell Adhesion Molecule–1) экспрессирован на эндотелии сосудов в слизистых оболочках и «ловит» лимфоциты, предназначенные для функционирования в слизистых оболочках. Селектины и адрессины обеспечивают относительно слабую адгезию клеток, достаточную для селективной остановки клетки в нужном органе, но недостаточную для проникновения сквозь стенку сосуда и миграции по межклеточному матриксу (рис. 7.4). Для более сильных взаимодействий нужны интегрины и молекулы адгезии надсемейства иммуноглобулинов. Молекулы этих же семейств обеспечивают взаимосвязи лимфоцитов с АПК и в дальнейшем лимфоцитов–эффекторов с их клетками–мишенями или клетками–партнёрами.
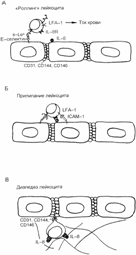
Рис. 7.4. Этапы процесса экстравазации лимфоцитов и лейкоцитов из крови в ткани. A. Стадия «роллинга». Лейкоцит «причаливает» к эндотелию в результате взаимодействий молекул Е–селектина на эндотелии с молекулами S-LeX на лейкоците и «катится» вдоль стенки сосуда (rolling). Б. Стадия прилипания. Между лейкоцитом и клетками эндотелия устанавливаются дополнительные, более сильные взаимосвязи через молекулы ИЛ–8R—ИЛ–8 и LFA–1—ICAM–1. B. Стадия диапедеза. На лейкоците экспрессируются молекулы CD31 (те же, что обеспечивают контакт между клетками эндотелия), и лейкоцит с их помощью внедряется в межэндотелиальную связь и проникает сквозь стенку сосуда в ткань (диапедез).
Все
интегрины —
гетеродимеры,
состоящие из более крупной –цепи
и меньшей по размеру –цепи.
Интегрины группируются в подсемейства
на основании общей –цепи.
Их два варианта — 1
и 2.
К интегринам принадлежат молекулы
LFA–1,2,3.
LFA–1 —
наиболее важный интегрин для активации
любого T–лимфоцита, так как АТ к LFA–1
способны блокировать активацию как
неиммунных, так и иммунных T–лимфоцитов.
Однако анализ врождённых генетических
дефектов молекул адгезии у человека
показывает, что другие интегрины,
например CD2
из подсемейства 1,
способны компенсировать отсутствие
LFA–1.
VLA
(very
late
activation
antigens) —
поздние Аг активации. Эти интегрины
экспрессируются на T–лимфоцитах на
2–4-е сутки от начала активации и имеют
наибольшее функциональное значение
для проникновения уже иммунного
T–лимфоцита в очаг воспаления, где ему
надлежит организовать санацию от Аг.
Надсемейство иммуноглобулинов включает в себя собственно иммуноглобулины, Рц T–лимфоцитов для Аг (TCR), корецепторные молекулы T–лимфоцитов CD4, CD8 и B–лимфоцитов CD19, инвариантные домены молекул MHC, а также ряд молекул межклеточной адгезии — ICAM (Intercellular Adhesion Molecules — ICAM–1, 2 и 3). ICAM–1 и ICAM–2 экспрессированы на эндотелии и АПК. ICAM–3 экспрессирована только на лейкоцитах и играет существенную роль при взаимодействии T–лимфоцитов с АПК.
Неиммунные T–лимфоциты, попав в T–зависимую зону лимфатического узла (и любого другого периферического лимфоидного органа), активно, но обратимо «прилипают» ко всем доступным АПК благодаря взаимодействиям LFA–1, CD2 и ICAM–3 на T–лимфоците с ICAM–1, ICAM–2, LFA–1 и LFA–3 на АПК. Во время этого «прилипания» TCR пытается узнать свой комплекс «пептид–MHC». Если узнавание произошло, то сигнал с агрегированных TCR и корецепторов (CD4 или CD8) идёт в клетку, и среди прочих последствий этого сигнала ранним является изменение конформации молекулы LFA–1, усиливающее её связь с ICAM–1 и ICAM–2. Связь между T–лимфоцитом, узнавшим свой Аг, и АПК поддерживается несколько дней, во время которых происходит пролиферация клона T–лимфоцитов. Дочерние клетки клона также прилипают к АПК на все время, пока идёт их дифференцировка в лимфоциты–эффекторы.
Существенная закономерность развития иммунного ответа состоит в том, что одного только факта связывания Рц для Аг с Аг недостаточно для того, чтобы лимфоцит активировался к иммунному ответу (т.е. начал пролиферировать и дифференцироваться). Недостаточно для активации и описанных выше адгезивных взаимодействий, недостаточно и корецепторных связей CD4 или CD8 с MHC. Все перечисленное необходимо. Но для того чтобы начался процесс пролиферации лимфоцита, необходимо ещё одно взаимодействие T–лимфоцита с той же АПК: это взаимодействие молекулы B–7 на АПК с молекулой CD28 на T–лимфоците. Известно две разновидности молекулы B–7: B–7.1 (CD80) и B–7.2 (CD86). Структурно они подобны — это гликопротеины гомодимеры, принадлежат к надсемуйству иммуноглобулинов (IgSF). CD28 тоже гомодимер и принадлежит к IgSF. Таким образом, экспрессия молекул B–7 — важнейший признак профессиональных АПК.
Активация уже иммунных лимфоцитов не зависит от CD28. Предположительно корецептором активации иммунных T–лимфоцитов является индуцибельная мембранная молекула, названная ICOS. Молекула ICOS имеет 19% гомологии с молекулой CD28. Возможно, что ICOS работает и при реактивации иммунных лимфоцитов памяти, и на эффекторном этапе работы иммунного лимфоцита в очаге деструкции повреждённой ткани.
Активация T–лимфоцита Аг происходит при сочетанном взаимодействии некоторых молекул на поверхности T–лимфоцита с рядом комплементарных молекул на поверхности АПК. Это взаимодействие принимает форму, получившую название иммунологического синапса (см. рис. 7.1). В экспериментах на лимфоцитах от трансгенных по генам TCR мышей (у которых все T–лимфоциты имеют одинаковый TCR, Аг для которого точно известен) можно прямо наблюдать эти структуры под флюоресцентным микроскопом высокого разрешения.
Иммунологический синапс имеет нечто материально общее с нервными синапсами, а именно в синаптической щели и нервного и иммунологического синапса присутствует протеогликан — агрин. В нейромышечном синапсе агрин обеспечивает кластеризацию Рц со стороны мышечной клетки. В иммунологическом синапсе T–лимфоцит синтезирует агрин, секретирует его в синаптическую щель, и там этот протеогликан обеспечивает кластеризацию TCR и корецепторов. Взаимодействующие молекулы мембран между двумя клетками иногда называют ещё межклеточным интерфейсом. Интерфейс между T–лимфоцитом и АПК состоит из молекул: со стороны T–лимфоцита — TCR/CD3/CD45, CD4 или CD8, CD28, CD40L; со стороны АПК комплементарные молекулы–лиганды соответственно пептид— MHC–I или II, MHC–II или MHC–I, B–7, CD40.
Известные пары «Рц–лиганд», вовлекаемые в процессы костимуляции лимфоцитов со стороны АПК, представлены в табл. 7.4.
Таблица 7.4. Пары «рецептор–лиганд», участвующие в костимуляции при взаимодействии T–лимфоцитов с АПК
Рецепторы на T–лимфоците |
Лиганды на АПК |
CD28 |
B7.1 (CD80); B7.2 (CD86) |
CTLA–4 (CD152) |
B7.1 (CD80); B7.2 (CD86) |
CD40L (CD154) |
CD40 |
OX40 |
OX40L |
HSA |
HSA |
LFA–1 |
ICAM–1 (CD54); ICAM–2 (CD102); ICAM–3 (CD50) |
CD2 |
LFA–3 (CD58) |
VLA–4 |
VCAM–1 (CD106) |
CD99 |
? |
CD95 (Fas) |
FasL |
Примечания.
CD99
находится в процессе изучения.
Поликлональная стимуляция T–лимфоцитов
in
vitro
АТ к CD3
плюс АТ к CD99
индуцирует повышение внутри клеток
уровня свободного Ca2+,
а также биосинтез TNF–
и ИФН–
что характерно для Тh1. Воздействия на
Th2 при этом не выявлено. Результаты
стимуляции T–лимфоцитов через молекулу
Fas
зависят от стадии развития T–лимфоцита:
если АТ к CD3
плюс АТ к молекуле Fas
воздействовать на неиммунный T–лимфоцит,
то произойдет индукция апоптоза. Если
той же парой АТ воздействовать на
иммунный T–лимфоцит памяти, то сначала
будет индуцирована пролиферация
лимфоцита, затем лимфоцит претерпит
индуцированную активацией клеточную
смерть (AICD).
Если на неиммунные Т4–лимфоциты
воздействовать указанной парой АТ, но
в присутствии ИЛ–4, то эти лимфоциты
также сначала пролиферируют наподобие
лимфоцитов памяти.
7.3.2. Антигенпредставляющие клетки. Дендритные клетки
Существенное
различие между антигенраспознающими
молекулами-иммуноглобулинами и
антигенраспознающими молекулами–Рц
T–лимфоцитов состоит в том, что
иммуноглобулины (АТ) связывают нативные
молекулы
Аг, тогда как TCR
не связывают нативные Аг, но способны
«увидеть» и связать только определённые
структуры на поверхности клеток своего
организма,
а именно комплексы молекул MHC с пептидами,
т.е. до
T–лимфоцита
и для
T–лимфоцита
Аг поглощают, перерабатывают и
экспрессируют на своей поверхности
другие
клетки.
Это и объясняет облигатную зависимость
развития иммунного ответа от доиммунного
воспаления. Доиммунное воспаление
заключается в непосредственном связывании
патогена (распознавании патогена) и
поглощения его некими клетками в месте
внедрения патогена — в естественных
условиях это покровные ткани. Существует
понятие профессиональных АПК. Таких
клеток у человека и млекопитающих 3
типа:
дендритные
клетки костномозгового происхождения;
B–лимфоциты;
макрофаги.
Если лимфоцит свяжет Рц специфический Аг, но не получит одновременно и от той же АПК костимуляторный сигнал «B–7–CD28», то не просто не начнется активация лимфоцита, а произойдет такое изменение состояния лимфоцита, которое называют анергией. Лимфоцит в состоянии анергии рефрактерен к возможной стимуляции. Эта закономерность лежит в основе так называемой периферической толератности T–лимфоцитов к тканям собственного организма.
Характеристика АПК представлена в табл. 7.5.
Таблица 7.5. Свойства профессиональных АПК
|
Тип АПК |
||
Свойство |
дендритные клетки |
B–лимфоциты |
макрофаги |
Рц для патогенов (или их первичных акцепторов) |
TOLL–подобные Рц |
Рц для компонентов активированного комплемента |
Рц для маннозы; Рц для ЛПС; TOLL–подобные Рц |
Способ поглощения Аг |
Эндоцитоз; макропиноцитоз; инфекция вирусов |
Опосредованный Рц (Ig) эндоцитоз |
Фагоцитоз; эндоцитоз |
Экспрессия MHC |
Конститутивная ++++ |
Конститутивная, возрастает при активации, от +++ до ++++ |
Индуцируемая бактериями или цитокинами от — до +++ |
Костимуляторная активность |
Конститутивная |
Индуцируемая, от — до +++ |
Индуцируемая от — до +++ |
Какие Аг представляют |
Белки, аллергены (?), вирусные Аг |
Растворимые Аг, токсины, вирусные Аг |
Фагоцитируемые Аг (частицы, бактериальные) |
Локализация в организме |
Барьерные ткани, лимфоидные органы |
Лимфоидные органы, периферическая кровь |
Соединительная ткань, паренхиматозные органы и полостей |
Если у B–лимфоцитов и макрофагов есть и иные, причём главные для этих клеток, функции — продукция иммуноглобулинов у B–лимфоцитов, фагоцитоз и экспансивное «переваривание» у макрофагов, — то у дендритных клеток, насколько это известно в настоящее время, нет иных функций в организме, кроме как представлять Аг и костимулирующие сигналы лимфоцитам.
Известно, что первичный иммунный ответ возможен только с участием дендритных клеток — ДК (не макрофагов и не B–лимфоцитов). Какой именно конкретный характер примет иммунное воспаление или разовьется иммунологическая толерантность, вероятно, тоже определяется на уровне именно дендритных клеток (ДК).
Термин «дендритные» отражает внешний облик клеток под микроскопом — клетки с отростками. В развитии иммунных процессов участвуют 3 разных типа клеток, в названии которых присутствует определение «дендритные». 2 типа — костномозгового происхождения: лимфоидные дендритные клетки — ДК2 и миелоидные дендритные клетки — ДК1. Именно эти клетки — профессиональные АПК. Третий тип — фолликулярные дендритные клетки (ФДК) — уникальные клетки стромы лимфоидных фолликулов. Они, скорее всего, не костномозгового происхождения, и функции у них особые (обеспечение возрастания аффинности иммуноглобулинов со временем по мере развития иммунного ответа), они не профессиональные АПК.
Значительная
часть фактической информации о дендритных
клетках получена в экспериментах с их
культивированием и изучением in
vitro.
Эта методология не позволяет надежно
отличать природные закономерности от
культуральных артефактов. Поэтому
приводимая характеристика ДК не является
«прописной истиной». Но есть и данные
исследований in
vivo.
У человека эти клетки происходят из
общей лимфоидной клетки–предшественницы,
из которой развиваются T– и B–лимфоциты,
NK.
На ДК есть маркёры лимфоцитов (CD2,
CD5,
CD7
и мРНК –цепи
пре-T–Рц для Аг) и не определяются
маркёры, характерные для миелоидных
ростков клеток (CD11c,
CD13,
CD33,
Рц для маннозы). Маркёрами предшественников
лимфоидных ДК человека являются вариант
молекулы Рц для ИЛ–3 — ИЛ–3R
и экспрессия одного из двух
иммуноглобулиноподобных Рц (ILT3+
или ILN1–).
Большинство иммунологов полагают, однако, что есть две разновидности дендритных АПК: лимфоидные (их обозначали ДК2) и миелоидные, происходящие из моноцитов (их обозначали ДК1). Если принять такую дуалистическую точку зрения, то ДК1, вероятно, можно рассматривать как разновидность макрофагов, специализирующихся на представлении Аг T–лимфоцитам.
Дендритные клетки широко распространены в организме. Их много в покровных тканях (клетки Лангерганса в коже), лимфоидных органах.
Первая особенность ДК состоит в том, что в покое они активно и непрерывно поглощают вещества из окружающей среды эндоцитозом и макропиноцитозом. Если в организм не проникают патогены, ДК поглощают вещества собственных тканей и представляют этот материал T–лимфоцитам, но без корецепторного стимула. В результате иммунное воспаление в отношении собственных тканей не развивается и поддерживается активное состояние иммунологической толерантности.
Вторая особенность ДК заключается в том, что на них есть Рц «эволюционной памяти» для продуктов микроорганизмов (патогенов), так называемые «Рц, распознающие рисунок» — PRR. На макрофагах и/или ДК1 это Рц для маннозы, Рц для ЛПС, TOLL–подобные Рц TLR2 и TLR4, способные обеспечивать реакцию активации этих клеток на продукты грамотрицательных и грамположительных бактерий. На лимфоидных ДК (ДК2) есть PRR для вирусов и бактериальной ДНК, содержащей неметилированные последовательности нуклеозидов CpG — TLR7 и TLR9. Кроме того, на лимфоидных дендритных клетках есть свой особый лектиновый Рц (идентифицируется АТ BДКA2), связывающий, например, вирус гриппа.
Третья особенность ДК состоит в том, что в отличие от макрофагов эти клетки не оседлые. Если в покровных тканях они распознают патоген, то они активируются и начинают мигрировать по путям лимфодренажа в регионарные лимфоидные органы. Если это лимфатический узел, то ДК войдут в него по афферентным лимфатическим сосудам и пройдут к периваскулярному пространству венул с высоким эндотелием в паракортикальной зоне. Именно здесь они встретят T– и B–лимфоциты и представят Аг T–лимфоцитам. В лимфатическом узле названное место — исключительное: там может произойти инициация (начало развития) иммунного ответа. Активированные патогеном ДК, кроме комплексов пептидов–Аг с молекулами MHC, экспрессируют корецепторные молекулы для взаимодействия с T–лимфоцитом: B7.1, B7.2 и CD40. Выстраивание такого межклеточного синапса — обязательное условие начала развития иммунного ответа.
Контакт
между ДК и T–лимфоцитом не однонаправлен,
а взаимоактивирующий. Через сигнал от
CD40L
от T–лимфоцита дендритная клетка
получает команду к продукции своих
особенных цитокинов. Миелоидные ДК
продуцируют ИЛ–12 (быстро, в большом
количестве, но непродолжительное время —
сутки) и TNF.
Такие ДК1
стимулируют T–лимфоцит к продукции
ИФН–
Лимфоидные ДК2
ещё до попадания в лимфатический узел
сразу после распознавания патогена
начинают активно продуцировать ИФН
типа I —
ИФН–
и .
Как считают в настоящее время, именно
лимфоидные
дендритные клетки являются главным,
если не единственным типом клеток,
продуцирующих интерфероны типа I.
ИФН–
и
аутокринно стимулируют созревание
вирусактивированных ДК. Вступив во
взаимодействие с T–лимфоцитом, такие
ДК2
индуцируют T–лимфоцит к продукции ИФН–
и одновременно ИЛ–10 (такая сумма отличает
эту индукцию от индукции синтеза
T–лимфоцитом одного только ИФН–
под влиянием ИЛ–12 из ДК1).
Лимфоидные ДК2
тоже продуцируют ИЛ–12, но в 100–1000 раз
в меньших количествах, чем миелоидные
ДК1
(или макрофаги), зато более продолжительное
время (несколько суток).
Таким образом, дендритные клетки в качестве АПК не только обеспечивают саму возможность начала развития лимфоцитарного иммунного ответа (или толерантность), но и программируют направление эффекторной дифференцировки будущих иммунных T–лимфоцитов.
После того как T–лимфоцит пройдет несколько циклов пролиферации, на его мембране происходит экспрессия ещё одного лиганда для тех же молекул B–7. Это молекула CTLA–4. CTLA–4 связывает B–7 с существенно большей (примерно в 20 раз) аффинностью, чем молекула CD28, но CTLA–4 посылает в клетку негативный сигнал и тем самым останавливает пролиферацию антигенспецифичного клона. Мыши с нокаутом (knock–out) по гену CTLA–4 погибают от лимфопролиферативных процессов.
7.3.3. Цитокины
Цитокины — это разнообразные биологически активные молекулы, секретируемые клетками «с целью» воздействия через специфические Рц для каждого из цитокинов на рядом расположенную клетку (или на себя же).
Цитокины отличаются и множественностью, и разнообразием структуры, и ещё многими свойствами и от нейромедиаторов, и от гормонов внутренней секреции. В отличие от контактных взаимодействий клеток мембранными молекулами взаимодействия посредством цитокинов более динамичные и оперативные благодаря определённым особенностям синтеза, секреции и рецепции цитокинов. В отличие от гормонов внутренней секреции в норме цитокины практически не попадают в системную циркуляцию и действуют локально в тканях в месте их выработки (известно два «исключения»: в крови здоровых людей в определимых количествах циркулируют цитокины ТФР и M–CSF).
Для цитокинов характерны следующие общие свойства.
Цитокины —
это как бы «эсперанто» в межклеточном
общении. Одноимённые цитокины продуцируются
клетками разной тканевой дифференцировки.
И Рц для одноимённых цитокинов
экспрессированы на клетках различной
тканевой дифференцировки. Таким образом,
клетки разных тканей «говорят» друг с
другом и «могут быть услышаны» друг
другом. Именно посредством цитокинов
в первую очередь система лимфоцитарного
иммунитета сращена с другими биологическими
системами резистентности к инфекциям
и со всем организмом в целом. Хотя в
целостной интеграции участвуют, очевидно,
и нервная и эндокринная системы.
Цитокины
в подавляющем большинстве случаев —
это близкодействующие медиаторы
локальных взаимодействий клеток в
очагах тех или иных процессов в тканях,
даже пары клеток, т.е. типичное место
работы цитокина — межклеточный
синапс. В зависимости от известных
параметров иррадиации эффектов цитокинов
выделяют аутокринные
эффекты (на
саму клетку, секретировавшую цитокин)
и паракринные
эффекты (на
рядом расположенные клетки). Есть и
эндокринные
эффекты, т.е.
дистантные, их ещё называют системными,
так как при этом цитокин достигает
клетки–мишени, циркулируя с кровью. Но
эндокринные эффекты выявлены только
для 4 цитокинов (TNF–,
ИЛ–1, ИЛ–6, M–CSF)
и не у здоровых организмов, а при тяжёлой
системной патологии типа септического
шока. У здоровых людей в крови удаётся
обнаружить только два цитокина —
ТФР
и M–CSF.
Имеет ли это нормальное физиологическое
значение и если да, то какое, неизвестно.
Цитокины
не депонируются в клетках, а синтезируются
импульсно, «по запросу», начиная с
транскрипции мРНК цитокина с
соответствующего гена. Единственное
известное исключение — депонирование
небольших количеств TNF–
в гранулах тучных клеток. Но TNF–
«претендует» быть исключением и в других
отношениях. Возможно ещё ИЛ–1
депонируется в некоторых количествах
в кератиноцитах.
Матричная
РНК цитокинов короткоживущая, что
объясняет транзиторный характер их
продукции клеткой: они вырабатываются
вскоре после получения «запроса» на их
продукцию и недолго.
Для
цитокинов характерна каскадность
действия или «сеть» (network):
воздействие одного цитокина на клетку
вызывает выработку этой клеткой других
или того же цитокина(ов). При этом в
клетке–продуценте работают, очевидно,
биологические часы: в начальный период
процесса клетка самостимулируется на
продукцию активационных цитокинов,
через несколько часов или суток та же
клетка переключается на синтез
супрессорных цитокинов и/или экспрессирует
тормозные Рц либо Рц для апоптозных
сигналов.
Наиболее
изученной в настоящее время системой
действия
конкретного цитокина является система
ИЛ–1. Природный ИЛ–1 имеет два варианта —
агониста —
ИЛ–1
и ИЛ–1.
Существует специальный фермент —
конвертаза интерлейкина–1 — ICE
(этот фермент оказался каспазой–1).
Кроме этого, есть молекулярный антагонист —
ингибитор
ИЛ–1 (ИЛ–1Ra) —
конкурент за Рц, причём в трёх изоформах
(значение каждой неясно). Существуют и
три
варианта Рц для
ИЛ–1 — типы I,
II
и III.
Причём если Рц типов I
и III
проводят активационные сигналы в клетку,
то Рц типа II —
«тупиковая ловушка», не проводящая
активационный сигнал, т.е. это ещё один
внутрисистемный механизм негативной
регуляции. Данный Рц типа II
экспрессируется на клеточной мембране
и секретируется в тканевую жидкость.
Для
действия цитокинов характерно свойство
избыточности, «многословия», «чрезмерности».
Данное понятие объединяет плейотропность
влияния каждого единичного цитокина и
взаимозаменяемость действия разных
цитокинов. Это означает, что внешне
одинаковые биологические эффекты могут
вызывать разные цитокины, а каждый один
цитокин индуцирует и в одной клетке, и
тем более в разных различные биологические
эффекты. Такая природная закономерность
ещё более усложняет фармакологическое
использование препаратов цитокинов.
Прежде
чем описывать биологические свойства
конкретных цитокинов, следует уточнить
понятие биологического
эффекта цитокина. Один
и тот же цитокин может вызывать самые
разные, вплоть до противоположных,
эффекты в разных клетках. Вот в этом
случае и надо понимать, что понятие
биологического эффекта относится не к
цитокину. Цитокин для клетки–мишени —
это только и всего лишь внешний лиганд
для
её Рц. Что произойдет с клеткой после
связывания этого лиганда с Рц (а это и
есть биологический эффект), зависит от
внутренней
программы дифференцировки клетки–мишени.
В дальнейшем мы тоже будем употреблять
выражения типа «интерферон–
активирует макрофаги», чтобы говорить
короче, но это надо понимать правильно:
для конкретной системы отношений
«макрофаг, имеющий Рц для интерферона–
и внеклеточного интерферона–»,
известно, что наступающее биологическое
последствие связи ИФН–
с Рц для ИФН–
заключается в существенной активизации
внутриклеточной биохимической машины
макрофага, индукции определённых
ферментов и т.д.
Учитывая сказанное, рассмотрим основные функциональные группы цитокинов. По функциональному предназначению с известной долей относительности выделяют 5 групп цитокинов: (1) гематопоэтические; (2) цитокины доиммунного воспаления; (3) цитокины–организаторы лимфоцитарного иммунного ответа; (4) цитокины–медиаторы иммунного воспаления; (5) противовоспалительные (иммуносупрессорные) цитокины.
1. Гематопоэтические цитокины — регуляторы пролиферации и дифференцировки всех клеток кроветворной системы. К ним относят колониестимулирующие факторы — CSF (colony–stimulation factors) для гранулоцитарно/моноцитарной клетки–предшественницы (GM–CSF), для предшественника моноцитов (M–CSF), для предшественника гранулоцитов (G–CSF); эритропоэтин, тромбопоэтин, ИЛ–3 (мульти–CSF), ИЛ–5 (CSF для эозинофилов), ИЛ–7 (CSF для лимфоцитов), стволовоклеточный фактор — SCF (его второе название «c–kit–лиганд» — фактор роста предшественников тучных клеток). К гемопоэтинам относят и ИЛ–1 под вторым названием — гемопоэтин–1, так как он поддерживает рост самых ранних клеток — предшественников кроветворения.
Негативные
регуляторы гемопоэза — фактор некроза
опухоли TNF
и трансформирующий фактор роста ТФР.
Хемокин MIP–
ингибирует ранние клетки–предшественницы
гемопоэза.
2. Цитокины доиммунного воспаления делят на две подгруппы.
Первичные
провоспалительные
цитокины —
«трио» ИЛ–1,
TNF,
ИЛ–6.
Они чрезвычайно плейотропны и активируют
ткани вокруг себя. Их продуцируют главным
образом макрофаги и лимфоидные дендритные
клетки покровных структур в очаге
внедрения патогена. ИЛ–1 и TNF
действуют преимущественно локально
(если нет септического заражения крови),
ИЛ–6 индуцирует биосинтез белков острой
фазы в печени;
Вторичные
воспалительные
цитокины —
хемокины —
большая группа (более 50) малых по размерам
белков, вызывающих и обеспечивающих
передвижение лейкоцитов и лимфоцитов
в тканях (табл. 7.6). Кроме того, большинство
хемокинов поддерживает ангиогенез и
продукцию коллагенов клетками
соединительной ткани (регенерацию).
Считают, что при соответствующих условиях
любая клетка организма продуцирует те
или иные хемокины.
Таблица 7.6. Номенклатура хемокинов человека (Конференция по хемокинам, Кистоун, Колорадо, 18–23 января 1999 г.)
Систематическое имя код OMIM |
Другие имена |
Рецептор код OMIM |
CC‑семейство |
||
CCL1 (182281) |
I–309 |
CCR8 (601834) |
CCL2 (158105) |
MCP–1, MCAF, SCYA2 |
CCR2 (601267) |
CCL3 (182283) |
MIP–1 |
CCR1 (601159), CCR5 (601373) |
CCL4 (182284) |
MIP–1 |
CCR5 |
CCL5 (187011) |
RANTES |
CCR1, CCR3 (601268), CCR5 |
CCL6 |
– |
Не установлен |
CCL7 (158106) |
MCP‑3 |
CCR1, CCR2, CCR3 |
CCL8 (602283) |
MCP‑2, HC14 |
CCR2, CCR3 |
CCL9, CCL10 |
– |
Не установлен |
CCL11 (601156) |
Эотаксин |
CCR3 |
CCL12 |
– |
CCR2 |
CCL13 (601391) |
MCP‑4,
NCC‑1, CK |
CCR2, CCR3 |
CCL14 (601392) |
HCC‑1, HCC‑3, NCC‑2 |
CCR1 |
CCL15 (601393) |
HCC‑2,
MIP–1 |
CCR1, CCR3 |
CCL16 (601394) |
HCC‑4, NCC‑4, LEC, LMC |
CCR1 |
CCL17 (601520) |
TARC, дендрокин |
CCR4 |
CCL18 (603757) |
DCCK1, PARC, MIP–4, AMAC‑1 |
Не установлен |
CCL19 (602227) |
MIP–3 |
CCR7 (600242) |
CCL20 (601960) |
MIP–3 |
CCR6 (601835) |
CCL21 (602737) |
6Ckine, SLC, exodus‑2, TCA‑4 |
CCR7 |
CCL22 (602957) |
MDC,
STCP‑1, DCtactin‑ |
CCR4 (604836) |
CCL23 (602494) |
MPIF‑1,
MIP–3, CK8 |
CCR1 |
CCL24 (602495) |
Эотаксин‑2,
MPIF‑2, CK |
CCR3 |
CCL25 (602565) |
TECK |
CCR9 (GPR9‑6), 602648 |
CCL26 (604697) |
Эотаксин‑3 |
CCR3 |
CCL27 (604833) |
CTACK/ALP |
Не установлен |
CCL28 (605240) |
– |
– |
СXC–семейство |
||
CXCL1 (155730) |
GRO1,
GRO |
CXCR2 (146928) > CXCR1 (146929) |
CXCL2 (139110) |
GRO2,
GRO |
CXCR2 |
CXCL3 (139111) |
GRO3,
GRO |
CXCR2 |
CXCL4 (173460) |
PF4, SCYB4 |
Не установлен |
CXCL5 (600324) |
ENA‑78 |
CXCR2 |
CXCL6 (138965) |
GCP‑2 |
CXCR1, CXCR2 |
CXCL7 (121010) |
NAP‑2 |
CXCR2 |
CXCL8 (146930) |
ИЛ–8, MDNCF, NAP‑1, NCF |
CXCR1, CXCR2 |
CXCL9 (601704) |
Mig, Humig, SCYB9 |
CXCR3 (600894) |
CXCL10 (147310) |
IP-10 |
CXCR3 |
CXCL11 (604852) |
I–TAC, H174, b‑R1 |
CXCR3 |
CXCL12 (600835) |
SDF‑1 |
CXCR4 (162643) |
CXCL13 (605149) |
BLC, BCA‑1 |
CXCR5 (601613) |
CXCL14 (604186) |
BRAK/болекин |
Не установлен |
CXCL15 |
– |
Не установлен |
CXCL16 (605398) |
SRPSOX |
Не установлен |
C–семейство |
||
XCL1 (600250) |
Лимфотактин,
SCM‑1 |
XCR1 (600552) |
XCL2 (604828) |
SCM‑1 |
XCR1 |
CX3C‑семейство |
||
CX3CL1 (601880) |
Фракталкин, нейротактин |
CX3CR1 (601470) |
Примечания.
SCY — small inducible cytokine (A#,B#)
(малый индуцибельный цитокин); MIP —
macrophage
inflammatory protein (провоспалительный белок
макрофагов); MCAF — monocyte chemotactic and
activating factor (фактор хемотаксиса и активации
моноцитов); MCP —
monocyte chemotactic protein (белок хемотаксиса
моноцитов); NCC —
new CC chemokine; Lkn —
leukotactin; TARC —
thymus and activation–regulated chemokine; PARC —
pulmonary and activation–regulated chemokine (лёгочный,
регулируемый активацией хемокин); AMAC —
alternative macrophage activation–associated CC chemokine (другой
CC–хемокин
активированных макрофагов); DCCK —
dendritic cell chemokine (хемокин дендритных
клеток); LARC —
liver
and
activation–regulated
chemokine
(печёночный, регулируемый активацией
хемокин);
exodus — «Исход» (массовая эмиграция);
согласно
Ветхому Завету, массовая эмиграция
евреев из Египта; SLC — secondary lymphoid
tissue chemokine (хемокин вторичных лимфоидных
органов); MDC —
macrophage–derived
chemokine
(происходящий из макрофагов хемокин);
MPIF —
myeloid progenitor inhibitory factor (миелоидных
предшественников ингибирующий фактор);
eotaxin —
назван в связи с накоплением эозинофилов
под влиянием этого хемокина; TECK —
thymus–expressed chemokine (экспрессируемый в
вилочковой железе хемокин); CTACK —
cutaneous T cell–attracting chemokine (привлекающий
T–лимфоциты
кожи хемокин); MGSA — melanoma growth stimulatory
activity, alpha (стимулирующий рост меланомы
фактор альфа); GRO
(от growth) —
стимулирующий рост;
PF4 — platelet factor 4 (тромбоцитарный фактор
4); GCP —
granulocyte–chemoattractant
protein
(хемотактический белок для гранулоцитов);
NAP — neutrophil–activating peptide (активирующий
нейтрофилы пептид); MDNCF — monocyte-derived
neutrophil chemotactic factor (происходящий из
моноцитов хемокин для нейтрофильных
лейкоцитов); IP–10 — interferon–gamma–inducible
protein 10 (индуцируемый ИНФ–
белок 10); Mig
(Humig) — (human)
monokine induced by gamma interferon (индуцируемый ИНФ–
монокин); SDF —
stromal cell–derived factor (происходящий из клеток
стромы фактор);
3.
Цитокины —
организаторы
лимфоцитарного
иммунного
ответа —
цитокины, регулирующие пролиферацию и
дифференцировку T– и B–лимфоцитов
и NK
в периферических лимфоидных органах и
тканях. Такие цитокины продуцируют в
первую очередь активированные
профессиональные АПК (дендритные клетки
и макрофаги) и затем сами лимфоциты. К
этой группе относят ИЛ–2 (митоген для
лимфоцитов), ИЛ–4, 12 и 15, ИФН–.
4.
Цитокины —
медиаторы
иммунного
воспаления —
цитокины, продуцируемые иммунными
T–лимфоцитами и направленные на активацию
лейкоцитов общевоспалительного
назначения: ИФН–
(активатор макрофагов и NK),
ИЛ–5 (индуктор и активатор эозинофилов);
лимфотоксины (активатор нейтрофилов),
лимфотоксин–
(обеспечивает образование воспалительных
гранулем in
vivo).
5.
Противовоспалительные
(иммуносупрессорные)
цитокины —
ИЛ–10 (продуцируется макрофагами и
ингибирует макрофаги) и ТФР–
(продуцируется иммунными CD4+
T–лимфоцитами и ингибирует дальнейшую
пролиферацию лимфоцитов). Кроме них
цитокины, оказывающие ингибирующее
действие на макрофаги, также в конкретных
процессах проявляют себя как
противовоспалительные — интерлейкины
4 и 13.
Существует классификация цитокинов по структурному принципу. Она проста по форме, трудно применима по смыслу, но несёт в себе конкретную морфологическую информацию (табл. 7.7).
Таблица 7.7. Структурная классификация цитокинов
Группа |
Структура |
Цитокины |
1 |
4 |
ИЛ–2,3,4,5,7,9,13
и 15; ИФН– |
2 |
4 |
ИЛ–6, LIF, ИЛ–10, ИЛ–11, онкостатин М, ресничный нейротрофический фактор |
3 |
Длинная
|
TNF– |
4 |
Короткая
цепь с |
Хемокины |
5 |
Мозаичная структура |
ИЛ–12 |
Приведём данные о биологических эффектах в разных клетках–мишенях наиболее охарактеризованных цитокинов T–лимфоцитов (табл. 7.8).
Таблица 7.8. Биологические эффекты цитокинов T–лимфоцитов в моделях на мышах
Цитокин |
T–субпо-пуляция— продуцент |
Действие на различные клетки–мишени |
Что происходит при knock–out гена цитокина |
||||||
|
|
B–лимфоциты |
T–лимфоциты |
макрофаги |
лейкоциты |
другие клетки |
|
||
ИЛ–2 |
Тh1, Th0, некоторые CD8+ |
Стимулирует пролиферацию; стимулирует синтез J–цепи молекулы Ig |
Стимулирует пролиферацию |
|
Стимулирует пролиферацию NK |
|
Снижены T–клеточные реакции |
||
ИФН– |
Тh1, CD8+ |
Дифференци-ровка и переключение синтеза Ig на IgG2a |
Апоптоз(?) |
Активация, возрастание экспрессии MHC–I, MHC–II |
Активация функций NK |
Подавление
пролиферации, в том числе вирусов;
|
Возрастает уязвимость к инфекциям микобак-териями |
||
Лимфотоксин
(TNF– |
Тh1, некоторые CD8+ |
Ингибирует пролиферацию и дифференци-ровку |
Апоптоз |
Активирует; индуцирует NO–синтазу |
Активирует нейтрофилы |
Апоптоз опухолевых клеток и фиброблаc–тов |
Отсутствие лимфатических узлов, дезорганизация структуры селезёнки |
||
ИЛ–4 |
Th2, TCR+/ CD4+ /CD8– |
Стимулирует
дифференци-ровку: переключение Ig
на классы E
и G1;
|
Выживание и дифференци-ровка Th2 |
Ингибирует активацию |
Стимулирует дифференцировку тучных клеток |
|
Полное отсутствие Th2 |
||
ИЛ–5 |
Th2 |
Стимулирует дифференцировку и биосинтез IgA |
|
|
Стимулирует пролиферацию и дифференцировку эозинофилов |
? |
? |
||
ИЛ–10 |
Th2 |
|
Ингибирует дифферен-цировку Th1 |
Ингибирует продукцию цитокинов |
Костимулятор пролиферации предшественников тучных клеток |
|
? |
||
ИЛ–3 |
Th1, Th2, некоторые CD8+ |
|
|
|
Фактор роста ранних предшественников всех ростков миелопоэза |
|
? |
||
Фактор
некроза опухолей |
Th1, некоторые Th2 и CD8+ |
|
|
Активирует, индуцирует NO–синтазу |
|
|
Резистентность к септическому шоку, вызванному грамотрица-тельными бактериями |
||
Гранулоцит-моноцит-коло-ниестиму-лирующий фактор (GM–CSF) |
Тh1, некоторые Th2, CD8+ |
Стимулирует дифферен-цировку |
Ингибирует пролиферацию |
Активирует |
Усиливает пролиферацию и дифференци-ровку грануло-цитов, макрофагов и дендритных клеток |
|
? |
||
Трансформирующий
фактор роста |
CD4+ (Th3) |
Ингибирует пролиферацию; переключает синтез иммуноглобулинов на IgA |
|
Ингибирует активацию |
Активирует нейтрофилы |
Стимулирует пролиферацию фибро-бластов |
Смерть в возрасте около 10 нед |
||
|
|
|
|
|
|
|
|
|
|
