
- •Часть 2. Коллоидная химия
- •Содержание
- •Введение
- •2. Коллоидная химия
- •2.1. Дисперсные системы
- •2.1.1. Структура дисперсных систем
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.1.2. Классификация дисперсных систем
- •Задачи и упражнения для самостоятельного решения
- •2.1.3. Методы получения и очистки дисперсных систем
- •Конденсационные методы получения коллоидных систем
- •Химическая конденсация
- •Физическая конденсация
- •Диспергационные методы получения дисперсных систем
- •Методы очистки дисперсных систем
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.2. Молекулярно-кинетические и оптические свойства коллоидных систем
- •2.2.1. Броуновское движение, диффузия, осмотическое давление. Их взаимосвязь
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.2.2. Седиментация
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.2.3. Рассеяние и поглощение света
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.3. Строение и электрический заряд коллоидных частиц. Электрокинетические явления
- •2.3.1. Строение и электрический заряд коллоидных частиц
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.3.2. Природа электрокинетических явлений
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.4. Устойчивость и коагуляция коллоидных систем
- •2.4.1. Кинетическая и термодинамическая устойчивость коллоидных систем
- •Задачи и упражнения для самостоятельного решения
- •2.4.2. Гелеобразование (желатинирование)
- •Свойства гелей
- •Задачи и упражнения для самостоятельного решения
- •2.4.3. Теории коагуляции
- •1. Адсорбционная теория коагуляции г. Фрейндлиха
- •2. Электростатическая теория коагуляции г. Мюллера
- •3. Теория устойчивости гидрофобных дисперсных систем длфо
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5. Разные классы коллоидных систем
- •2.5.1. Аэрозоли и их свойства
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.2. Порошки и их свойства
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.3. Суспензии и их свойства
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.4. Эмульсии и их свойства
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.5. Пены и их свойства
- •2.5.6. Коллоидные системы, образованные поверхностно-активными веществами
- •Свойства коллоидных растворов пав
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.7. Высокомолекулярные соединения (вмс) и их растворы
- •2.5.8. Полимерные полиэлектролиты
- •2.5.9. Набухание и растворение вмс
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.10. Вязкость растворов вмс
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.11. Осмотические свойства растворов вмс
- •Примеры решения задач и упражнений
- •Задачи и упражнения для самостоятельного решения
- •2.5.12. Факторы устойчивости растворов вмс
- •Предметный указатель
- •Приложение
- •1. Основные единицы измерения физических величин
- •2. Основные физические постоянные
- •Литература Основная
- •Дополнительная
Примеры решения задач и упражнений
Определите линейную, поверхностную и объемную степени диспергирования при получении муки из зерна, считая, что размер частиц муки и зерна приведен к эквивалентному диаметру, равному 38 мкм и 2,27 мм соответственно.
Решение:
Используя формулы (0), (0) и (0), определим линейную, поверхностную и объемную степени диспергирования:
![]()
![]()
![]()
Задачи и упражнения для самостоятельного решения
1. Определите линейную, поверхностную и объемную степени диспергирования при получении талька, полагая, что размер частиц талька и материала, из которого его производят, равен соответственно 3,0·10–6 м и 5,0·10–3 см соответственно.
(Ответ: 60; 3,6·10–3; 2,16·10–6)
2. Рассчитайте концентрацию силиката натрия, находящегося в растворенном состоянии в равновесии с частицами (удельная поверхность частиц 3,0·105 м2/кг) гидрозоля кремнезема при 298 К. Растворимость кремнезема в равновесии с макрофазой при этой же температуре составляет 0,015% (масс.). Плотность частиц SiO2 2,2 г/см3, поверхностное натяжение на границе кремнезема с раствором – 45 мДж/м2.
(Ответ: 0,13 % масс.).
2.2. Молекулярно-кинетические и оптические свойства коллоидных систем
2.2.1. Броуновское движение, диффузия, осмотическое давление. Их взаимосвязь
Молекулярно-кинетические свойства коллоидных систем, как и обычных растворов, обнаруживаются в таких явлениях, как броуновское движение, диффузия, осмотическое давление. Частицы ультрамикрогетерогенных систем (золей, аэрозолей) участвуют в тепловом движении и подчиняются всем молекулярно-кинетическим законам. Поэтому размер, массу и концентрацию частиц дисперсной фазы можно определить экспериментально.
Броуновское движение проявляется в хаотическом и непрерывном движении частиц дисперсной фазы под действием ударов молекул растворителя (дисперсионной среды), находящихся в состоянии интенсивного молекулярно-теплового движения. Частицы дисперсной системы, испытывая с разных сторон многочисленные удары молекул жидкости, могут перемещаться поступательно в различных направлениях. Траектория движения таких частиц представляет собой ломаную линию (рис. 6).
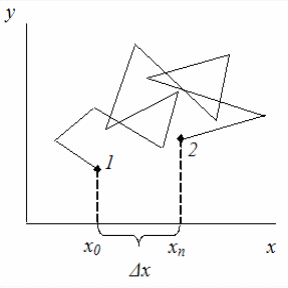
Рис. 6. Схема перемещения частицы при броуновском движении:
Δх – величина смещения от точки 1 до точки 2
В качестве
характеристики движения принят средний
сдвиг частицы
![]() за время t,
то есть отрезок прямой, соединяющий
начальную точку движения (при t
= 0) с положением
частицы в момент t
в плоскости
горизонтальной проекции, наблюдаемой
в микроскоп. Смещения одинаково вероятны
как слева направо, так и в противоположном
направлении. Поэтому при вычислении
среднего смещения за большой промежуток
времени может быть равно нулю.
за время t,
то есть отрезок прямой, соединяющий
начальную точку движения (при t
= 0) с положением
частицы в момент t
в плоскости
горизонтальной проекции, наблюдаемой
в микроскоп. Смещения одинаково вероятны
как слева направо, так и в противоположном
направлении. Поэтому при вычислении
среднего смещения за большой промежуток
времени может быть равно нулю.
Эйнштейном А. и Смолуховским М. было показано, что среднее значение квадрата смещения частицы для одномерного броуновского движения за время t равно:
|
(0) |
где D – коэффициент диффузии.
Иначе это уравнение можно записать:
|
(0) |
где R – универсальная газовая постоянная; Т – абсолютная температура; η – вязкость среды; r – радиус взвешенных частиц; NА – постоянная Авогадро; t – время.
Из уравнения
Эйнштейна – Смолуховского
следует, что величина
![]() обратно пропорциональна радиусу частицы
r.
Это означает, что чем крупнее частица,
тем меньше величина ее смещения.
обратно пропорциональна радиусу частицы
r.
Это означает, что чем крупнее частица,
тем меньше величина ее смещения.
Диффузия – это самопроизвольное перемещение частиц (молекул) в область с более низкой их концентрацией в результате теплового движения (или броуновского) движения.
Процесс диффузии идет самопроизвольно, поскольку он сопровождается увеличением энтропии системы. Равномерное распределение вещества в системе отвечает наиболее вероятному ее состоянию.
Диффузия может быть выражена уравнением первого закона Фика в дифференциальной форме:
|
(0) |
где dc/dх – градиент концентрации (знак минус указывает, что диффузия идет в сторону уменьшения концентрации), jдифф – диффузионный поток.
Эйнштейн, используя уравнение Стокса для коэффициента трения,
|
(0) |
где ui
– средняя скорость частиц, f
– скорость, отнесенная к единичной
силе, приложенной к 1 моль;
![]() – коэффицент сопротивления среды;
показал, что коэффициент диффузии связан
с размерами диффундирующих частиц:
– коэффицент сопротивления среды;
показал, что коэффициент диффузии связан
с размерами диффундирующих частиц:
|
(0) |
С помощью уравнения Эйнштейна можно определить размер частиц золей и молекулярную массу полимеров. Для этого надо лишь экспериментальным путем найти значение коэффициента диффузии D.
Осмотическим давлением Росм называют избыточное внешнее давление, которое следует приложить к раствору, чтобы предотвратить осмотический перенос воды и восстановить одинаковый уровень раствора и растворителя, разделенных между собой полупроницаемой перегородкой.
Я. Вант-Гофф установил, что осмотическое давление зависит от внешних факторов:
Росм = сRT, |
(0) |
где с – молярная концентрация вещества в растворе, моль/л; Т – абсолютная температура, К; R –универсальная газовая постоянная, Дж/(мольК); Росм – осмотическое давление, Па.
Следовательно, осмотическое давление пропорционально числу частиц растворенного или диспергированного вещества в единице объема раствора и не зависит от природы и массы частиц.
Однако это уравнение справедливо только для идеальных растворов.
