
биофиз №2
.docx-
Первый закон термодинамики – изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме количества теплоты, подведенной к системе из вне и работе внешних сил действующих на нее: ∆U=Q+A.
-
Обратимый процесс — равновесный термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы.Примеры необратимых процессов:
диффузия, термодиффузия, теплопроводность, вязкое течение и др .
-
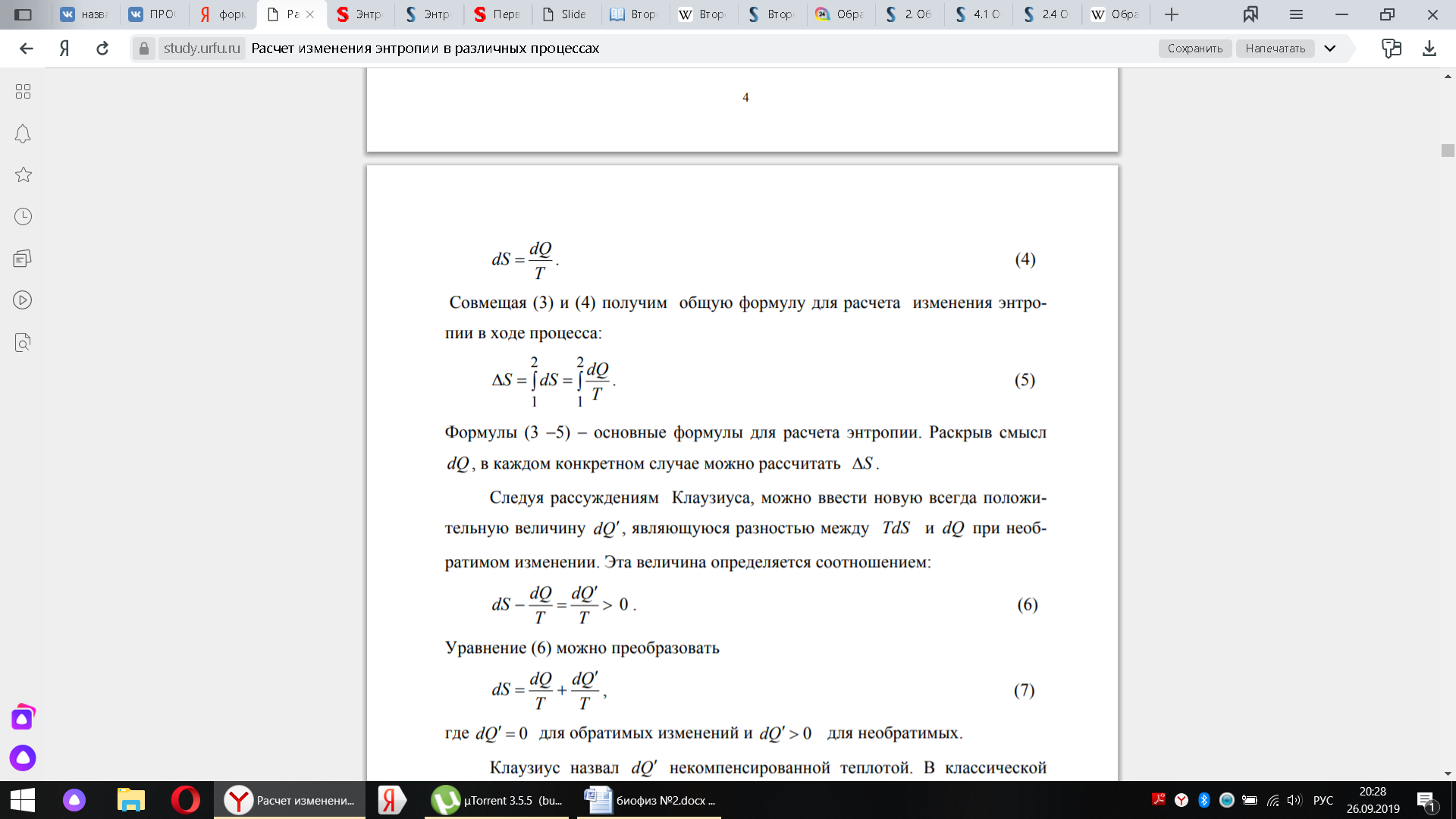
Если в замкнутой системе происходит процесс, то энтропия этой системы не убывает.
В данной формулировке второго начала термодинамики следует обратить внимание на то, что рассматриваемая система должна быть замкнутой. В незамкнутой системе энтропия может вести себя как угодно (и убывать, и возрастать, и оставаться постоянной). Заметим, что энтропия не изменяется в замкнутой системе при обратимых процессах.
-
Энтропия – это параметр состояния рабочего тела, устанавливающий связь между количеством теплоты и температурой. Энтропия – это мера неупорядоченности состояния системы; стремление частиц (молекул, ионов, атомов) к хаотическому движению. По изменению энтропии в ходе реакции можно судить о переходе системы от более упорядоченного состояния к менее упорядоченному или наоборот.Энтропия возрастает (∆Ѕ>0) с увеличением движения частиц при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п.Процессы, связанные с упорядоченностью системы (конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация), сопровождаются уменьшением энтропии (∆Ѕ < 0). Измеряется энтропия в Дж/(моль×К). Энтропия является функцией состояния, т. е. ее изменение не зависит от пути, по которому это изменение происходит, а определяется только разностью значений энтропии в конечном и начальном состоянии. Кроме того, энтропия − экстенсивное свойство системы.
-
-
у всякой изолированной системы, находящейся в неравновесном состоянии, энтропия с течением времени возрастает, и ее рост продолжается до тех пор, пока система не достигнет равновесного состояния.
9. Закон Гесса — основной закон термохимии, который формулируется следующим образом:Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
10. Принцип Пригожина:В стационарном состоянии системы скорость возникновения энтропии вследствие необратимых процессов имеет минимальное значение при данных внешних условиях, препятствующих достижению системой равновесного состояния.
11. Обмен веществ и энергии — это совокупность физических, химических и физиологических процессов усвоения питательных веществ в организме с высвобождением энергии. Основным обменом называется количество энергии, которое тратит организм при полном мышечном покое, через 12—14 часов после приема пищи и при окружающей температуре 20—22 °С.
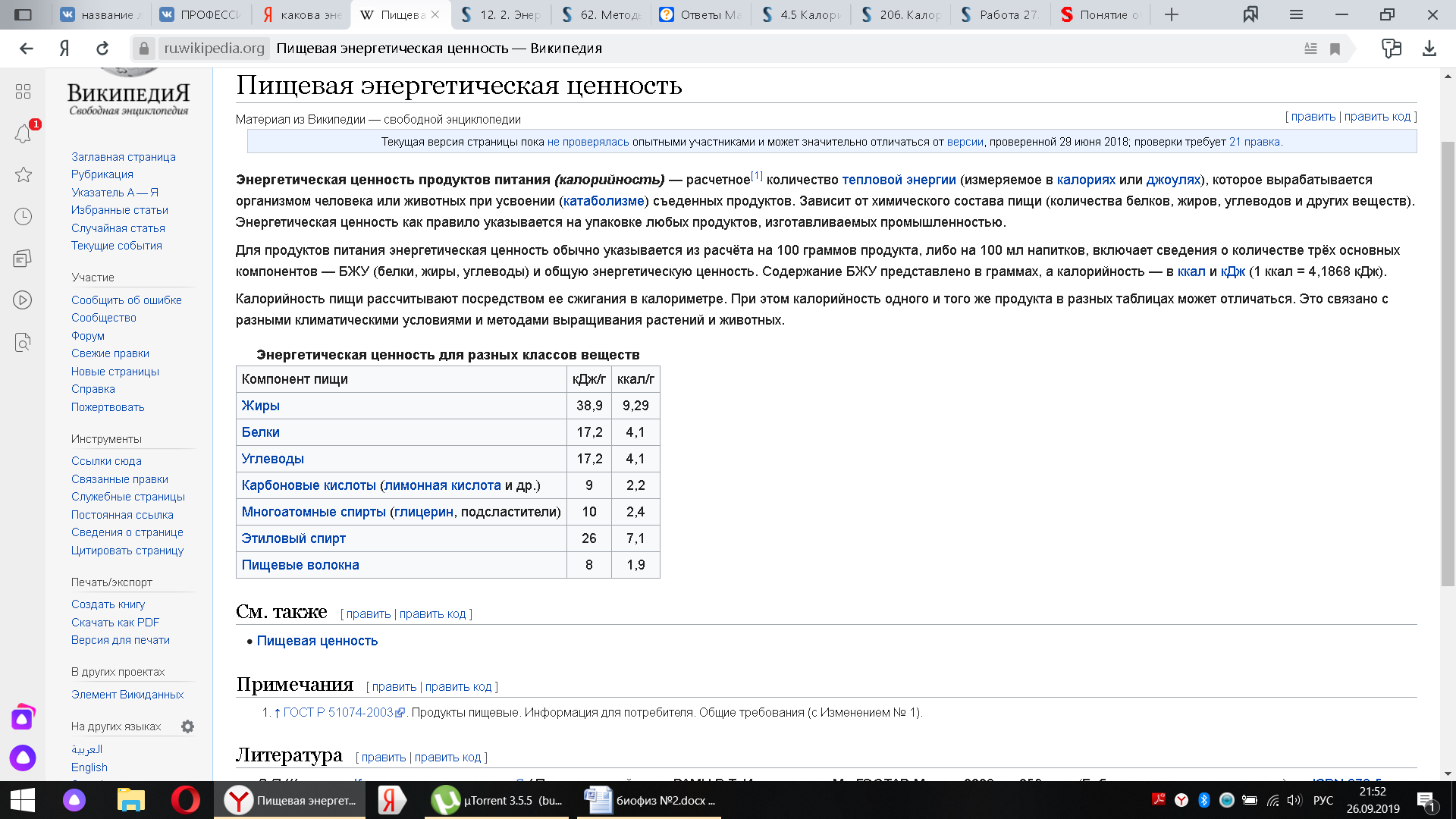
12. Дыхательный коэффициент – это отношение объема выделенного углекислого газа к объему поглощенного кислорода. Его величина позволяет судить о природе субстрата дыхания.
Калориметрический коэффициент-количество тепла,выделяемое при окислении в организме 1 г. вещества
13. Потому что превращение одних веществ в другие сопровождается или поглощением,энергии или её выделением. 14. Прямая калориметрия основана на непосредственном измерении теплоотдачи организма. Методы непрямой калориметрии основаны на учете газообмена организма с атмосферой
15.
Пищевой рацион — это суточное количество пищи для одного человека.
17. Энергозатраты при умственном труде составляют 2500–3000 ккал в сутки. Но затраты энергии меняются в зависимости от рабочей позы. Так, при рабочей позе сидя затраты энергии превышают на 5-10 % уровень основного обмена; стоя – на 10–25 %, при вынужденной неудобной позе – на 40–50 %. При интенсивной интеллектуальной работе потребность мозга в энергии составляет 15–20 % общего обмена в организме. Повышение суммарных энергетических затрат при умственной работе определяется степенью нервно-эмоциональной напряженности. Суточный расход энергии при умственном труде повышается на 48 % при чтении вслух сидя, на 90 % – при чтении лекций, на 90-100 % – у операторов ЭВМ. Кроме того, мозг склонен к инерции, так как после прекращения работы мыслительный процесс продолжается, что приводит к большему утомлению и истощению ЦНС, чем при физическом труд
