
Задачник по химии
.pdf
Продолжение табл. П.1
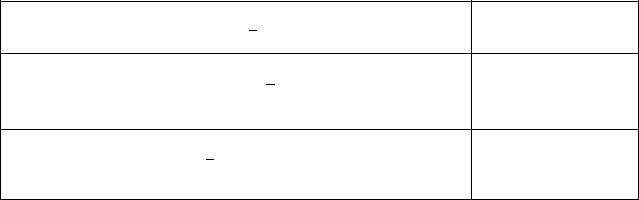
C6H6 (ж) |
124,5 |
49,0 |
173,2 |
-3267,7 |
CH3OH (ж) |
-166,1 |
-238,6 |
126,8 |
-726,6 |
CH3Cl(г) |
-58,5 |
81,9 |
234,2 |
|
C2H5OH (ж) |
-174,8 |
-277,6 |
160,4 |
-1366,9 |
CS2 (г) |
65,06 |
11,53 |
237,8 |
-1075 |
Ca (k) |
0 |
0 |
41,62 |
-635,1 |
CaO (k) |
-604,2 |
-635,1 |
39,70 |
- |
CaC2(k) |
-67,8 |
-62,7 |
70,3 |
- |
Ca(OH)2 (k) |
-898,5 |
-986,2 |
83,4 |
- |
CaCO3 (k) |
-1128,8 |
-1206 |
92,90 |
- |
CaCl2 (k) |
-750,2 |
-785,8 |
113,8 |
- |
CaSO4 (k) |
-1318,3 |
-1424 |
106,7 |
- |
Cd (k) |
0 |
0 |
51,76 |
-60,9 |
CdO (k) |
-225,06 |
-256,1 |
54,80 |
- |
Cd(OH)2 (k) |
-470,85 |
-553,2 |
95,40 |
- |
CdCl2 (k) |
-342,6 |
-389,0 |
115,30 |
- |
CdSO4(k) |
-820,57 |
- |
- |
- |
Cl2 (г) |
0 |
0 |
223,0 |
- |
Cl2O(г) |
94,2 |
76,6 |
266,2 |
- |
CoO(k) |
-502,42 |
- |
- |
- |
Cr (k) |
0 |
0 |
23,76 |
-1141 |
Cr2O3 (k) |
-1046,84 |
-1141 |
81,1 |
- |
CrO3 (k) |
-505,8 |
-594,5 |
72 |
- |
Cr(OH)3 (k) |
-902,5 |
-1033,9 |
80,30 |
- |
Cu (k) |
0 |
0 |
33,30 |
-165,0 |
Cu2O(k) |
-146,36 |
- |
- |
- |
Cu2Cl2(k) |
-237,8 |
- |
- |
- |
CuCl(k) |
-118,8 |
- |
- |
- |
CuCl2(k) |
-149,0 |
|
|
|
CuO (k) |
-127,19 |
-165,0 |
42,64 |
- |
Cu(OH)2 (k) |
-359,4 |
-448,5 |
79,50 |
- |
CuSO4 (k) |
-661,9 |
-771,1 |
113,3 |
- |
GeO2 |
-531,4 |
|
|
|
Ga(OH)2(k) |
-829,43 |
- |
- |
- |
F2 (г) |
0 |
0 |
202,9 |
- |
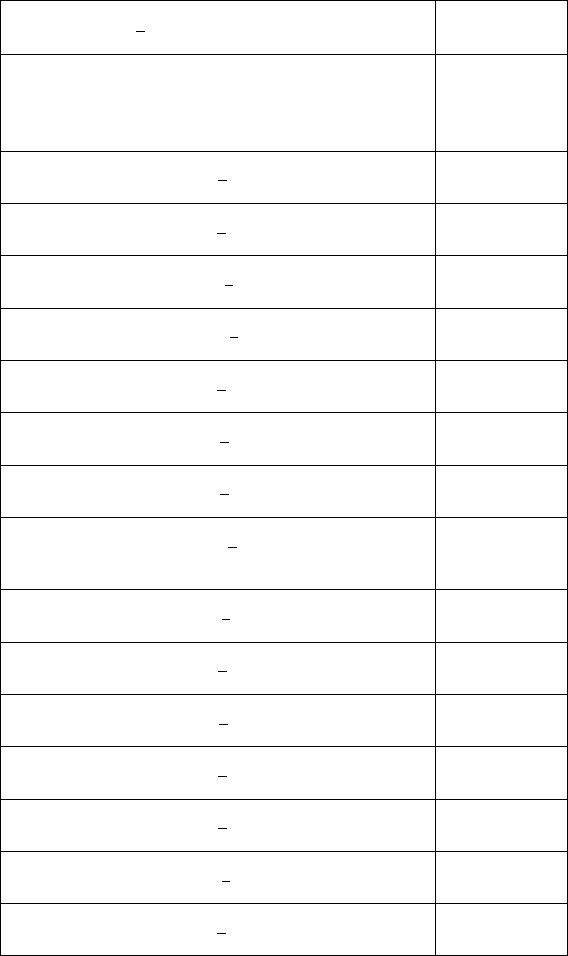
Fe (k) |
0 |
0 |
27,15 |
- |
FeO (k) |
-244,3 |
-263,7 |
58,79 |
- |
Fe2O3 (k) |
-740,99 |
-822,16 |
89,92 |
- |
Fe3O4(k) |
-1014,2 |
-1117,1 |
146,2 |
- |
Fe(OH)2 (k) |
-483,5 |
-568,0 |
79,5 |
- |
Fe(OH)3 (k) |
-699,6 |
-824,2 |
96,2 |
- |

Продолжение табл. П.1
H2 (г) |
0 |
0 |
130,6 |
-241,84 |
H2O (k) |
- |
-291,85 |
44,1 |
- |
H2O (ж) |
-237,2 |
-285,84 |
70,1 |
- |
H2O (г) |
-228,4 |
-241,84 |
188,8 |
- |
H2S (г) |
-33,01 |
-20,15 |
205,64 |
- |
HF (г) |
-270,7 |
-268,6 |
173,5 |
- |
HCl (г) |
-95,27 |
-92,30 |
186,7 |
- |
HCl(ж) |
-131,2 |
-167,5 |
55,2 |
|
HBr (г) |
-53,5 |
-35,98 |
198,5 |
- |
HI (г) |
1,3 |
25,94 |
206,3 |
- |
HgO(кр.k) |
-58,6 |
- |
- |
- |
HNO3 (ж) |
-80,3 |
-174,3 |
156,6 |
- |
H2SO4 (ж) |
-1119,0 |
-1283,6 |
176,15 |
- |
RuO2 |
-205,15 |
|
|
|
S(k) |
0 |
0 |
31,88 |
- |
SO2(г) |
-300,4 |
-296,9 |
248,1 |
- |
SO3(г) |
-370,4 |
-395,2 |
256,23 |
- |
Sc2O3(k) |
-1004,83 |
- |
- |
- |
Tl2O3 |
-217,71 |
|
|
|
I2 (г) |
19,37 |
62,24 |
260,6 |
- |
I2 (k) |
0 |
0 |
116,7 |
- |
In2O3(k) |
-838,9 |
- |
- |
- |
KOH (k) |
-380,2 |
-425,9 |
59,41 |
- |
KCl(k) |
-408,32 |
-435,9 |
82,7 |
- |
K2SO4(k) |
-1316,37 |
- |
- |
- |
KClO3(k) |
-289,91 |
- |
- |
- |
KIO3(k) |
-714,27 |
- |
- |
- |
MnO2(k) |
-466,1 |
-519,4 |
53,14 |
- |
Mn(OH)2(k) |
-610,85 |
-693,7 |
88,28 |
- |
MnCl2(k) |
-441,4 |
-468,6 |
117,15 |
- |
MoO3 |
-502,42 |
|
|
|
N2(г) |
0 |
0 |
191,5 |
- |
NH3(г) |
-16,7 |
-46,19 |
192,5 |
- |
N2H4(ж) |
149,2 |
50,4 |
121,3 |
- |
N2H4(г) |
98,4 |
50,36 |
303,8 |
- |
NH4OH(р) |
-254,2 |
-361,2 |
165,4 |
- |
NH4Cl(k) |
-203,0 |
-314,4 |
94,56 |
- |
(NH4)2SO4(k) |
-900,3 |
-1179,3 |
220,3 |
- |
NO(г) |
86,7 |
90,37 |
210,6 |
- |
NO2(г) |
51,8 |
33,50 |
240,45 |
- |

Продолжение табл. П.1
N2O(г) |
103,6 |
81,55 |
220,0 |
- |
N2O4(г) |
98,28 |
9,66 |
304,3 |
- |
N2O5(г) |
140,5 |
-41,8 |
307,0 |
- |
Nb2O5 |
-731,64 |
|
|
|
NaBr(k) |
-347,7 |
-359,8 |
83,7 |
- |
NaI(k) |
-284,5 |
-287,9 |
91,2 |
- |
NaOH(k) |
-381,3 |
-427,8 |
64,18 |
- |
Na2SO4(k) |
-1267,0 |
-1384,0 |
149,4 |
- |
Na2CO3(k) |
-1048,0 |
-1129,0 |
136,0 |
- |
NaF(k) |
-543,5 |
-570,3 |
51,3 |
- |
NaCl(k) |
-384,9 |
-410,9 |
72,33 |
- |
Ni(k) |
0 |
0 |
29,86 |
- |
NiO(k) |
-216,4 |
-239,5 |
38,0 |
- |
Ni(OH)2(k) |
-453,43 |
-538,0 |
79,5 |
- |
O(г) |
230, |
247,5 |
261,0 |
- |
O2(г) |
0 |
0 |
205,0 |
- |
O3(г) |
163,4 |
142,3 |
138,8 |
- |
LiOH (к) |
-443,9 |
-487,8 |
42,70 |
- |
Li2CO3(k) |
-1133,2 |
- |
- |
- |
Mg (k) |
0 |
0 |
32,55 |
-601,2 |
MgO (k) |
-569,57 |
-601,2 |
26,94 |
- |
Mg(ОН)2 (k) |
-833,8 |
-924,7 |
63,14 |
- |
MgCl2(k) |
-592,72 |
- |
- |
- |
MgCO3(k) |
-955,96 |
-1063,74 |
112,13 |
- |
MnSO4 (k) |
-1029 |
-1096 |
65,69 |
- |
Sb2O3(k) |
-293,08 |
- |
- |
- |
PdO |
-125,61 |
|
|
|
SiO2 (αкварц) |
-847,2 |
-859,3 |
42,09 |
- |
Sn(OH)2(k) |
-492,37 |
- |
- |
- |
SnO2(k) |
-519,65 |
-580,8 |
52,34 |
- |
TiO2(k) |
-852,7 |
- |
- |
- |
Th(OH)4(k) |
-1585,7 |
- |
- |
- |
Zn (k) |
0 |
0 |
41,59 |
- |
ZnO (k) |
-318,19 |
-349,0 |
43,5 |
- |
Zn(OH)2 (k) |
-554,4 |
-642,2 |
84,9 |
- |
ZnS (k) |
-198,32 |
-201 |
57,7 |
- |
ZnSO4 (k) |
-870,7 |
-978,2 |
124,6 |
- |
ZnCl2(k) |
-369,51 |
- |
- |
- |
ZrO2(k) |
-1022,6 |
- |
- |
- |
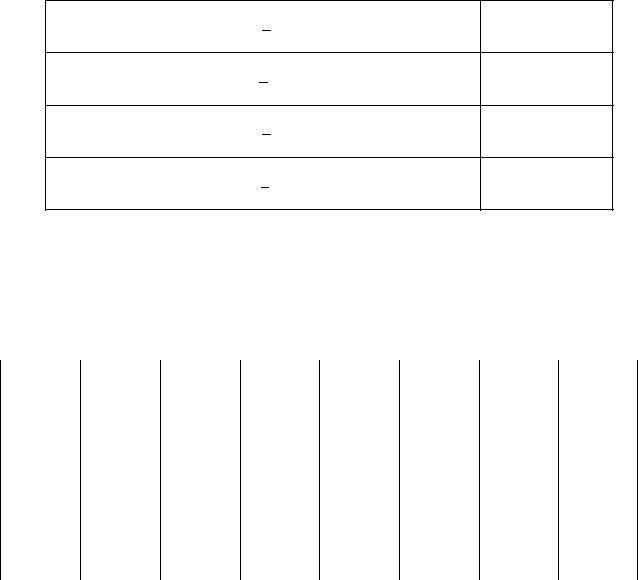
Pb(k) |
0 |
0 |
64,9 |
- |

Окончание табл. П.1
PbBr2(k) |
|
|
|
-260,4 |
|
|
|
|
|
-277,0 |
161,4 |
|
|
- |
||||||||||||||||||||
PbCl2(k) |
|
|
|
-314,0 |
|
|
|
|
|
-359,1 |
136,4 |
|
|
- |
||||||||||||||||||||
PbI2(k) |
|
|
|
-173,8 |
|
|
|
|
|
-175,1 |
176,4 |
|
|
- |
||||||||||||||||||||
PbS(k) |
|
|
|
-92,7 |
|
|
|
|
|
-94,8 |
91,2 |
|
|
- |
||||||||||||||||||||
PbSO4(k) |
|
|
|
-811,78 |
|
|
|
|
|
918,1 |
147,28 |
|
- |
|||||||||||||||||||||
PbO(k) |
|
|
|
-188,49 |
|
|
|
|
|
-217,8 |
69,45 |
|
|
- |
||||||||||||||||||||
Pb(OH)2(k) |
|
|
|
-421,19 |
|
|
|
|
|
- |
- |
|
|
- |
||||||||||||||||||||
PbO2(k) |
|
|
|
-219,0 |
|
|
|
|
|
-276,6 |
76,44 |
|
|
|
||||||||||||||||||||
PCl3(г) |
|
|
|
-286,27 |
|
|
|
|
|
-277,0 |
311,7 |
|
|
- |
||||||||||||||||||||
PCl5(г) |
|
|
|
-324,55 |
|
|
|
|
|
-369,45 |
362,9 |
|
|
- |
||||||||||||||||||||
PH3(г) |
|
|
|
12,5 |
|
|
|
|
|
-- |
- |
|
|
|
||||||||||||||||||||
V2O3(k) |
|
|
|
-795,49 |
|
|
|
|
|
- |
- |
|
|
- |
||||||||||||||||||||
WO3(k) |
|
|
|
-535,91 |
|
|
|
|
|
- |
- |
|
|
- |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица П 2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Стандартные электродные потенциалы |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Электрохимическая система |
|
|
|
|
|
|
ϕ0,В |
|||||||||||||||||||||||||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
AgCl + |
|
|
|
|
= Ag + Cl − |
|
|
|
|
|
|
0,2222 |
||||||||||||||||||||||
е |
|
|
|
|
|
|
||||||||||||||||||||||||||||
Cu2+ + |
|
|
= Cu+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,153 |
||||||||||||||||
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
Hg2Cl2 + 2 |
|
|
|
|
= 2Hg + 2Cl − |
|
|
|
|
|
|
0,2696 |
||||||||||||||||||||||
е |
|
|
|
|
|
|
||||||||||||||||||||||||||||
Hg2O + 2 |
|
|
|
+ H2O = 2Hg + 2OH − |
|
|
|
|
|
|
0,123 |
|||||||||||||||||||||||
е |
|
|
|
|
|
|
||||||||||||||||||||||||||||
2ClO3− + 12H+ + 10 |
|
= Cl2 (г) + 6H2O |
|
|
|
1,47 |
||||||||||||||||||||||||||||
е |
|
|
|
|||||||||||||||||||||||||||||||
H2 = 2H+ + 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
||||||||||||||
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
2H2O + 2 |
|
|
|
= 2OH − + H2, pH > 7 |
|
|
|
|
|
|
-0,828 |
|||||||||||||||||||||||
е |
|
|
|
|
|
|
||||||||||||||||||||||||||||
2H2O + 2 |
|
|
|
|
= 2OH − + H2, pH = 7 |
|
|
|
|
|
|
-0,414 |
||||||||||||||||||||||
е |
|
|
|
|
|
|
||||||||||||||||||||||||||||
O2 + 4H+ + 4 |
|
|
= 2H2O |
|
|
|
|
|
|
1,229 |
||||||||||||||||||||||||
е |
|
|
|
|
|
|
||||||||||||||||||||||||||||
O2 + 2H2O + 4 |
|
|
= 4OH − |
|
|
|
|
|
|
0,401 |
||||||||||||||||||||||||
е |
|
|
|
|
|
|
||||||||||||||||||||||||||||
N2H4 + 4OH − = N2 + 4H2O + 4 |
|
|
|
|
|
|
|
|
|
|
-1,16 |
|||||||||||||||||||||||
е |
|
|
|
|
|
|
||||||||||||||||||||||||||||
CH3OH + 8OH − = CO32− + 6H2O + 6 |
|
|
|
|
|
-0,91 |
||||||||||||||||||||||||||||
е |
|
|
|
|||||||||||||||||||||||||||||||
CH3OH + H2O = CO2 + 6H+ + 6 |
|
|
|
|
|
|
|
|
|
|
0,017 |
|||||||||||||||||||||||
е |
|
|
|
|
|
|
||||||||||||||||||||||||||||
Li = Li+ + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-3,045 |
||||||||||||
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
2SOCl2 + 4 |
|
|
|
= SO2 + S + 2Cl − |
|
|
|
|
|
|
0 |
|||||||||||||||||||||||
е |
|
|
|
|
|
|
||||||||||||||||||||||||||||
Mg0 = Mg2+ + 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-2,363 |
|||||||||||||||||
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Продолжение табл.П 2
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
MnO2 + H+ + |
|
|
= MnOOH |
0,5 |
||||||||||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
C6H4(NO2)2 + 6H2O + 8 |
|
= C6H4(NHOH)2 + 8OH − |
-0,163 |
|||||||||||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
NiOOH + H2O + |
|
|
|
|
|
|
= Ni(OH)2 + OH − |
0,49 |
||||||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
H2O2 = O2 + 2H+ + 2 |
|
|
|
|
0,6824 |
|||||||||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
MnO 4− + 8H+ + 5 |
|
|
|
|
|
= Mn2+ + 4H2O |
1,52 |
|||||||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
HNO2 (aq) + H+ + |
|
|
|
|
= NO (г) + H2O |
1,0 |
||||||||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
I2 + 2 |
|
= 2I − |
0,5355 |
|||||||||||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
MnO2 + 4H+ + 2 |
|
|
|
= Mn2+ + 2H2O |
1,23 |
|||||||||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
S2- = S0 + 2 |
|
|
|
|
|
|
|
|
|
|
-0,48 |
|||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
Cr2O 72− + 14H+ + 6 |
|
|
= 2Cr3+ + 7H2O |
1,33 |
||||||||||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||
Fe2+ = Fe3+ + |
|
|
|
|
|
|
|
0,771 |
||||||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||
ClO3− + 6H+ + 6 |
|
|
|
|
= Cl − + 3H2O |
1,45 |
||||||||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||
SO2 + 2H2O = SO 4− + 4H+ + 2 |
|
|
0,138 |
|||||||||||||||||||||||
е |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

0,957
NO3− + 4H+ + 3е = NO + 2H2O
2Br − = Br2 + 2 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|||||||||||
е |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1,68 |
|||||||||||
PbO2 + 4H+ + 2 |
|
|
|
|
= Pb2+ + 2H2O |
|||||||||||||||||||
е |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,50 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
C2O 42− = 2CO2 + 2 |
|
|
||||||||||||
|
|
|
|
|
|
|
е |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
0,564 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
MnO 4− + 1 |
|
= MnO |
||||||||||||
|
|
|
|
|
|
|
е |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2− |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1,359 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
2Cl − |
= Cl2 + 2 |
|
|
|
||||||||||
|
|
|
|
|
|
|
е |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
0,960 |
|||||||||||
NO3− + 3H+ + 2 |
|
|
|
= HNO2 + H2O |
||||||||||||||||||||
е |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1,682 |
|||||||||||
PbO2 + 4H+ + SO 42− + 2 |
|
= PbSO4 +2H2O |
||||||||||||||||||||||
е |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,763 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
Zn = Zn2+ + 2 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
е |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
-1,662 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
Al = Al3+ + 3 |
|
|
||||||||||||
|
|
|
|
|
|
|
е |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,13 |
|||||||||||
CrO 42− + 4H2O + 3 |
|
|
= Cr(OH)3 + 5OH − |
|||||||||||||||||||||
е |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1,195 |
|||||||||||
2IO3− + 12H+ + 10 |
|
= I2 + 6H2O |
||||||||||||||||||||||
е |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
0,172 |
|||||||||||
SO 42− + 4H+ + 2 |
|
= H2SO3 (aq) + H2O |
||||||||||||||||||||||
е |
||||||||||||||||||||||||
0,799
Ag = Ag+ + е
-0,93
SO32− + 2OH − = SO 24− + H2O + 2е
-0,04
Ti4+ + е = Ti3+
0,761
BrO − + H2O + 2е = Br − + 2OH −
-0,05
MnO2 + 2H2O +
2е = Mn(OH)2 + 2OH −
-0,126
Pb2+ + 2е = Pb0
-0,744
Cr3+ + 3е = Cr0
-1,180
Mn2+ + 2е = Mn0
-0,277
Co2+ + 2е = Co0
-0,44
Fe2+ + 2е = Fe0
-0,4029
Cd2+ + 2е = Cd0
0,337
Cu2+ + 2е = Cu0
-0,136
Sn2+ + 2е = Sn0
(белый)
1,498
Au3+ + 3е = Au0
0,24
Sb3+ + 3е = Sb0
0,300
Re3+ + 3е = Re0
0,987
Pd2+ + 2е = Pd0
0,009
Sn4+ + 4е = Sn2+
-2,431
Nd3+ + 3е = Nd0
-0,913
Cr2+ + 2е = Cr0
-0,25
Ni2+ + 2е = Ni0
-0,343
In3+ + 3е = In0
-0,036
Fe3+ + 3е = Fe0
0
2H+ + 2е = H2
Таблица П 3*
Перенапряжения катодного восстановления некоторых ионов
(при i = 0,01 A/см2), рН < ?, Е = 298 К
Ион |
ηk ,B |
ηk ,B |
ηk ,B |
ηk ,B |
Zn2+ |
0,03 |
Re3+ |
0,65 |
H+ |
|
H+ |
|
|
|
|
|
|
(на Ag) |
0,47 |
(на Re) |
0,6 |
|
Ag+ |
0,18 |
Pd2+ |
0,48 |
(на Au) |
0,24 |
(на Pd) |
0,3 |
|
Pb2+ |
0,04 |
Sn4+ |
0,35 |
(на Zn) |
0,72 |
(на Mn) |
0,45 |
|
Cr3+ |
0,41 |
Cr2+ |
0,22 |
(на Cd) |
0,98 |
(на Co) |
0,50 |
|
Mn2+ |
0,5 |
Ni2+ |
0,11 |
(на Sn) |
0,86 |
(на Au |
0,3 |
|
|
|
|
|
|
Окончание табл.П 3 |
|
||
|
|
|
|
|
|
|||
Co2+ |
0,5 |
In3+ |
0,18 |
(на Pb) |
0,92 |
|
|
|
Fe2+ |
0,11 |
Fe3+ |
0,3 |
(на Cr) |
0,5 |
(на In) |
0,26 |
|
Cd2+ |
0,03 |
Sn2+ |
0,01 |
(на Fe) |
0,5 |
(на Sb) |
0,5 |
|
Cu2+ |
0,06 |
Sb3+ |
0,6 |
(на Ni) |
0,63 |
|
|
|
Au3+ |
0,35 |
|
|
(на Cu) |
0,48 |
|
|
|
*Примечание: Часть данных, в частности, по перенапряжениям катодного восстановления некоторых ионов (табл.П 3), анодного окисления металлов (табл.П 8), ионизации кислорода на пассивных металлах (табл.П 9) получена пересчетом из поляризационных кривых или полярографических данных (“Справочник по электрохимии /Под ред.А.М.Сухотина. – Л.: Химия, 1981. – 488 с; с.210-246.)
Таблица П 4
Константы диссоциации некоторых слабых электролитов при 298 К
Вещество |
Кд |
Вещество |
Кд |
1 |
2 |
3 |
4 |
НСООН |
К=1,77·10-4 |
H2O |
K=1,8·10-16 |
СН3СООН |
K=1,75·10-5 |
NH4OH |
K=1,79·10-5 |
HCN |
K=7,9·10-10 |
Al(OH)3 |
K3=1,38·10-9 |
H2CO3 |
K1=4,45·10-7 |
Zn(OH)2 |
K1=4,4·10-5 |
|
K2=4,8·10-11 |
|
K2=1,5·10-9 |
HF |
K=6,61·10-4 |
Cd(OH)2** |
K2=5·10-3 |
HNO2* |
K=4·10-4 |
Fe(OH)2 |
K2=1,3·10-4 |
H2SO3 |
K1=1,7·10-2 |
Fe(OH)3 |
K2=1,82·10-11 |
|
K2=6,3·10-8 |
|
K3=1,35·10-12 |
H2S |
K1=1,1·10-7 |
|
|
|
K2=1·10-14 |
Cu(OH)2 |
K2=3,4·10-7 |
H2SiO3 |
K1=1,3·10-10 |
|
|
|
K2=2·10-12 |
Ni(OH)2 |
K2=2,5·10-5 |
H3PO4 |
K1=7,5·10-3 |
|
|
|
K2=6,31·10-8 |
Cr(OH)3 |
K=1·10-10 |
|
K3=1,3·10-12 |
|
|
HAlO2 |
K=6·10-13 |
AgOH |
K=1,1·10-4 |
H3BO4 |
K1=5,8·10-10 |
Pb(OH)2 |
K1=9,6·10-4 |
|
K2=1,8·10-13 |
|
K2=3·10-8 |
|
K3=1,6·10-14 |
|
|
*Кд определены при 180С. |
**Кд определены при 30 |
|
|
|||||||||
Таблица П 5 |
|
Упругости диссоциации оксидов |
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Оксид |
|
|
|
PO |
,равновесн., |
|
|
|
|
PO |
,равновесн., |
|
|
|
|
|
2 |
|
|
|
|
|
2 |
||
|
|
|
|
|
Па |
|
|
|
|
|
|
Па |
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe2O3 |
|
500 |
|
|
1,013·10-45 |
|
|
|
750 |
|
|
1·10-42 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Ag2O |
|
600 |
|
|
3,6·107 |
|
CoO |
|
750 |
|
|
1·10-32 |
Cu2O |
|
500 |
|
|
5,6·10-26 |
|
Sb2O3 |
|
500 |
|
|
1·10-36 |
PbO |
|
1600 |
|
|
4,4·10-2 |
|
PdO |
|
500 |
|
|
1·10-10 |
