
- •2. Инвариантность. Принципы симметрии и законы сохранения
- •2. Микро-, макро-, мегамир.
- •3. Элементарные частицы и их классификация.
- •1. Химия как наука. Эволюция химических знаний.
- •2. Энергетика химических процессов. Тепловой эффект реакции. Закон Гесса.
- •3. Закон сохранения массы в хим. Системах.
- •1. Энергия. Становление теории теплоты.
- •Тепловая (термодинамическая)
- •Структурная
- •Информационная
- •Невозможно совершить работу за счет тел, находящихся в термодинамическом равновесии.
- •4. Самоорганизация в природе. Синергетика.
- •5. Динамические и статистические закономерности в природе.
1. Химия как наука. Эволюция химических знаний.
Химия – важнейший раздел естествознания. Она изучает превращение одних веществ в другие. Химическим превращением называют такое, когда в результате взаимодействия веществ меняется их химический состав и структура. Например, природный газ (СН4)
С2Н2 Н2 СН3ОН
Химические процессы лежат в основе жизнедеятельности всех живых организмов.
Вещество – это вид материи, обладающий при определенных условиях постоянными физическими свойствами (плотность, Тпл, Ткип, теплоемкость…). Вещество состоит из одного или нескольких химических элементов. Химический элемент – совокупность атомов с одинаковым зарядом ядра.
Химия, как и другие науки, возникла в процессе практической деятельности людей (выплавка металлов, производство красок, лекарств – патрохимия, обработка кожи…).
Химия прошла следующие этапы развития:
I этап (1 – 12 в.в) – зарождение химических знаний.
II этап (12 – 17 в.в.) – алхимия.
III этап (17 – 19 в.в.) становление химии как науки.
IV этап (с 20 в. по наст время)
Различают следующие уровни химических знаний:
1 уровень (1660 – 1800)– учение о составе вещества (Роберт Бойль). Суть: свойства вещества зависят от входящих в его состав химических элементов.
2 уровень (1800 – 1950) – развитие структурной химии (А.М. Бутлеров).
3 уровень (1950 – 1970) – учение о химических процессах.
4 уровень (с 1970 по наст. время) – развитие эволюционной химии. - науки о самоорганизации, саморазвитии хим. систем. Происходит биологизация химии. Главная задача - освоение каталитического опыта живой природы
2. Реакционная способность.
Все вещества обладают способностью участвовать в хим. реакциях т.е. им присуща реакционная способность (РС). РС – характеристика хим. активности веществ, учитывающая как разнообразие реакций, возможных для данного вещества, так и их скорость. Например, благородные металлы (Au, Pt) и инертные газы (He, Ar, Xe) химически инертны т.е. у них низкая РС. Щелочные металлы(Li, Na, K) и галогены (F, Cl, Br) химически активны, т.е. обладают высокой РС.
Современные представления о РС основаны на электронной теории валентности и на рассмотрении распределения электронной плотности молекулы (строения молекулы).

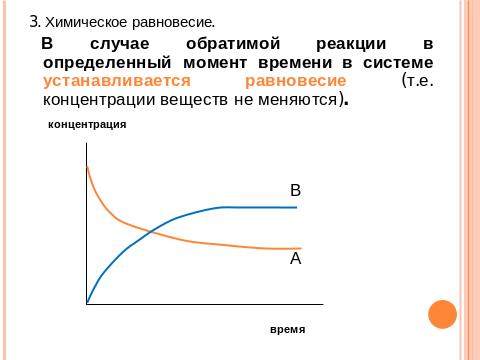
Количественно РС выражают константами скорости реакций или константами равновесия в случае обратимых реакций. Наука, которая изучает скорости и особенности хим. превращений в зависимости от условий их проведения, называется химической кинетикой. С практической точки зрения большое значение имеет регуляция РС т.е. управление скоростью хим. реакции.
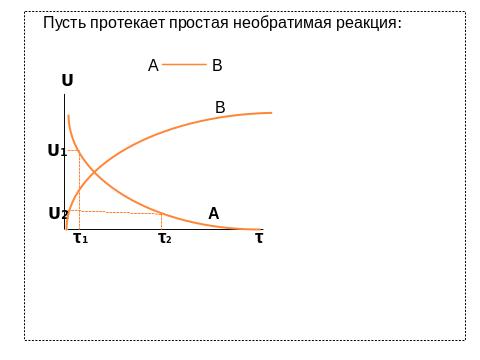




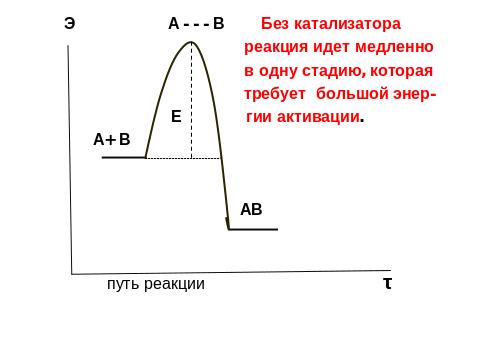
Катализ – изменение скорости хим. реакций в результате действия какого – либо вещества или смеси веществ, количество которых практически не изменяется в ходе реакции. Эти вещества – катализаторы. На применении катализаторов основано около 90 % процессов хим. промышленности. Они позволяют проводить процессы при более низких t°, что снижает расход энергии.
Механизм катализа можно представить сл. образом:
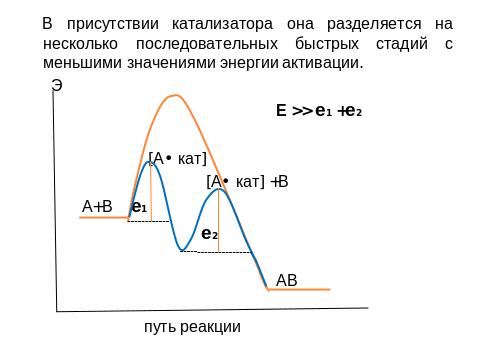
Активность катализатора – мера его ускоряющего действия по отношению к данной реакции. Количественно она может определяться относительным увеличением . Чем активнее катализатор, тем при меньшей t° можно вести процесс, что несомненно выгодно. Для удлинения сроков службы катализаторов в промышленности проводят очистку реагентов от контактных ядов. Процессы, в которых катализаторами являются сами исходные вещества или продукты реакции называются автокаталитическими (горение, полимеризация, разложение взрывчатых в -в).
Вещества, повышающие активность катализаторов называются промоторами.
Вещества, замедляющие реакции называются ингибиторами.




Лекция №10
Химические системы, превращения и процессы.
Энергетика химических процессов. Тепловой эффект реакции. Закон Гесса.
3. Закон сохранения массы в химических системах
1. Химические системы, превращения, процессы.
Хим. система – это совокупность хим. веществ, находящихся во взаимодействии.
Хим. реакция – это превращение одних веществ в другие, отличные по хим. составу и (или) строению.
Химический процесс– совокупность физических и химических явлений, направленных на получение целевого продукта. Он складывается из трех основных стадий:
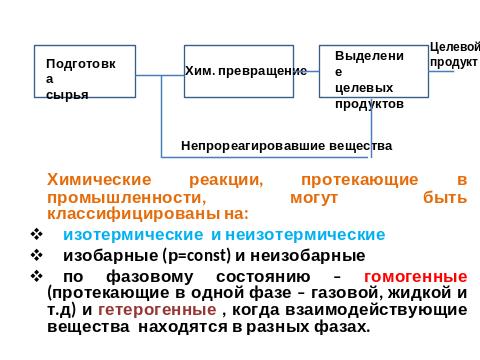

Хим. системы создаются за счет хим. связей – совокупности сил, действующих между атомами или группой атомов. В молекулах различают три основных типа хим связей:
Ковалентная – образуется за счет общих электронных пар;
Ионная – хим. связь между заряженными частицами – ионами;
Металлическая –хим. связь, основанная на обобществлении валентных электронов, которые принадлежат всем атомам в кристалле хим. системы.
