
- •Введение
- •Оформление лабораторной работы и лабораторного журнала
- •Тема 1 Понятие эквивалента. Определение эквивалента простого вещества и соединений
- •Лабораторная работа № 1 Определение молярной массы эквивалента металла по количеству выделившегося водорода
- •Контрольные вопросы:
- •Тема 2 Буферные растворы
- •Лабораторная работа № 2 Буферные растворы. Буферное действие
- •Опыт 1. Приготовление буферных растворов
- •Опыт 2. Влияние сильных кислот и щелочей на pH буферных растворов
- •Опыт 3. Влияние разбавления на pH буферного раствора.
- •Контрольные вопросы:
- •Тема 3 Химическая кинетика. Скорость химической реакции
- •Лабораторная работа №3 Скорость химических реакций
- •Опыт 1. Влияние концентрации ионов железа (III) и иодид - ионов на скорость реакции окисления иодид - ионов ионами железа (III)
- •Опыт 2. Зависимость скорости реакции от температуры
- •Опыт 3. Влияние степени измельчения реагирующих твердых частиц на скорость реакции
- •Опыт 4. Влияние катализатора на скорость реакции. Гомогенный катализ
- •Контрольные вопросы:
- •Тема 4 Гидролиз солей
- •Лабораторная работа № 4 Гидролиз.
- •Опыт 1. Гидролиз солей, образованных сильными основаниями и слабыми кислотами
- •Опыт 2. Гидролиз солей, образованных сильными кислотами и слабыми основаниями
- •Опыт 3. Гидролиз солей, образованных слабой кислотой и слабым основанием
- •Опыт 4. Необратимый гидролиз
- •Опыт 5. Влияние температуры на степень гидролиза солей
- •Опыт 6. Влияние разбавления раствора на степень гидролиза и его обратимость
- •Опыт 7. Негидролизуемость труднорастворимых соединений
- •Опыт 8. Растворение металлов в продукте гидролиза их солей
- •Контрольные вопросы:
- •6. Найти значения степени гидролиза нитрита натрия (NaNo2) и формиата калия (hcook) в растворах молярных концентраций: 0,001 и 10 моль/л.
- •Тема 5 Реакции, протекающие с изменением степени окисления атомов элементов
- •Лабораторная работа № 5 Окислительно- восстановительные реакции
- •Опыт 1. Изучение восстановительных свойств металлов и окислительных свойств кислот
- •Опыт 2. Изучение окислительно- восстановительных свойств хлороводородной кислоты
- •Опыт 3. Изучение окислительно-восстановительных свойств нитритов (тяга!)
- •Опыт 8. Взаимные переходы хромат (CrO4-) и бихромат - ионов (Cr2o72-)
- •Контрольные вопросы:
- •Тема 6 Химия р-элементов. Сера. Фосфор. Азот.
- •Лабораторная работа № 6 Химия элементов. Сера. Фосфор. Азот
- •Сера Опыт 1. Получение пластической серы (Тяга!)
- •Опыт 2. Изучение свойств сульфида натрия
- •Опыт 3. Изучение свойств сульфид-иона
- •Опыт 4. Изучение окислительно-восстановительных свойств соединений серы
- •Опыт 5. Изучение свойств серной кислоты (Выполнять под тягой!)
- •Опыт 6. Изучение свойств тиосерной кислоты
- •Азот Опыт 1. Получение аммиака
- •Опыт 2. Восстановительные свойства аммиака
- •Опыт 3. Азотистая кислота
- •Фосфор Опыт 1. Гидролиз растворимых фосфатов
- •Опыт 2. Фосфаты кальция
- •Контрольные вопросы:
- •Тема 7.
- •Лабораторная работа № 7 Химия соединений d-элементов
- •Опыт 1. Получение гидроксидов железа (II), кобальта (II) и никеля (II). Изучение свойств полученных соединений
- •Опыт 2. Свойства гидроксидов железа (III), кобальта (III) и никеля (III)
- •Опыт 3. Образование солей железа
- •Опыт 4. Получение аммиакатов кобальта (II) и никеля (II)
- •Тема 8 Произведение растворимости
- •Лабораторная работа № 8 Растворимость. Гетерогенное равновесие в растворах электролитов. Произведение растворимости
- •Опыт 1. Изучение условий образования осадков малорастворимых соединений
- •Опыт 2. Изучение условий растворения осадков
- •Опыт 3. Получение одних малорастворимых веществ из других
- •Контрольные вопросы:
- •Тема 9 Комплексные соединения
- •1. По заряду комплекса:
- •2. По числу мест занимаемых лигандами в координационной сфере:
- •3. По природе лиганда:
- •Лабораторная работа № 9 Комплексные соединения
- •Опыт 1. Получение соединений с комплексными ионами
- •Опыт 2. Сравнение устойчивости комплексных ионов
- •Опыт 3. Зависимость окраски комплексного соединения от координационного числа центрального атома – комплексообразователя
- •Опыт 4. Влияние среды на устойчивость комплексных соединений
- •Опыт 5. Ступенчатое образование комплексных ионов
- •Опыт 6. Смещение равновесия в растворах комплексных соединений при нагревании
- •Опыт 7. Различная способность ионов 3d-элементов к комплексообразованию
- •Опыт 8. Разрушение комплексных ионов
- •Опыт 9. Растворимость комплексных соединений в различных растворителях
- •Контрольные вопросы:
- •Тема 10 Методы очистки твердых веществ
- •Лабораторная работа № 10 Очистка кристаллических веществ методом перекристаллизации
- •Опыт 1. Очистка бихромата калия
- •Опыт 2. Очистка сульфата меди. (Очистка пятиводного сульфата меди перекристаллизацией)
- •Контрольные вопросы:
- •Тема 11 Соединения элементов с кислородом
- •Лабораторная работа № 11 Методы получения оксидов Опыт 1. Получение оксида олова (II)
- •Опыт 2. Получение оксида кобальта (II)
- •Контрольные вопросы:
- •Тема 12 Растворы. Приготовление растворов
- •Лабораторная работа № 12 Взвешивание. Приготовление растворов. Титрование
- •Опыт 1. Определение массовой доли вещества по относительной плотности раствора
- •Плотность и концентрация растворов гидроксида калия (koh) и гидроксида натрия (NaOh)
- •Опыт 2. Определение точной концентрации приготовленного раствора щелочи путем титрования его раствором кислоты с точно известной концентрацией
- •Контрольные вопросы:
- •Тема 13 Комплексонометрическое титрование
- •Лабораторная работа № 13 Комплексонометрическое определение общей жесткости воды
- •Ход работы
- •Контрольные вопросы:
- •Тема 14 Йодометрическое титрование
- •Лабораторная работа № 14 Йодометрическое определение меди
- •Ход работы.
- •Контрольные вопросы:
- •Список рекомендуемой литературы
- •Содержание
Лабораторная работа № 1 Определение молярной массы эквивалента металла по количеству выделившегося водорода
Цель работы: экспериментальное определение молярной массы эквивалента неизвестного металла. Определение металла-элемента.
Меры предосторожности при выполнении работы:
1. Работать со стеклом аккуратно, не применяя чрезмерных усилий!
2. Раствор кислоты приливать аккуратно, пользуясь для этого мерным цилиндром с носиком.
|
Рисунок. Прибор для определения молярной массы эквивалента металла |
 рибор
для определения молярной массы эквивалента
металла
изображен на рисунке.
рибор
для определения молярной массы эквивалента
металла
изображен на рисунке.
Он состоит из бюретки на 50 мл (1), двухколенной пробирки Оствальда (2), открытой трубки, служащей в качестве уравнительного сосуда (3), стеклянного крана (или зажима) (4). Для укрепления прибора используется штатив с держателями и зажимами.
Собрать прибор в соответствии с рис.1, в уравнительный сосуд налить воду, которая заполнит бюретку и вытеснит из прибора воздух через открытый кран (4). Бюретку укрепить на штативе так, чтобы уровни воды в бюретке и открытой трубке совпадали с нулевым делением. Для удобства отсчета бюретку следует укрепить так, чтобы нулевое деление было на уровне глаз наблюдателя. Отсчеты уровня жидкости следует делать по нижнему краю мениска.
Получить навеску металла и поместить ее в одно из колен пробирки. В другое ее колено налить мерным цилиндром 24 %-ый раствор соляной кислоты.
Прежде чем проводить реакции, следует убедиться в герметичности прибора (герметичность прибора - залог успеха опыта). Для этого плотно вставить пробки и закрыть кран тройника, уравнительный сосуд снять с держателя и опустить вниз на 15-20 см. Уровень воды в бюретке несколько снизится и остановится без изменения, если прибор герметичен. При возвращении сосуда на прежнее место вода в нем и в бюретке должна остаться на том же нулевом уровне.
После того как установлена герметичность прибора, пробирку следует повернуть таким образом, чтобы кислота перелилась в то колено пробирки, где находится металл. Если реакция протекает медленно, то можно подогреть реакционную пробирку, погружая ее в стакан с горячей водой.
Водород, выделившийся в результате взаимодействия металла с раствором кислоты, вытесняет из бюретки воду. Уравнительный сосуд при этом надо опускать и во время опыта стараться держать воду в нем и бюретке па одном уровне, чтобы давление газа внутри прибора было все время близким к атмосферному.
Пока идет реакция, можно зарисовать в своей тетради установку, а также записать показания барометра – Р и термометра – °С.
Когда весь металл растворится, понижение уровня воды в бюретке прекратится. Окончательный точный отсчет показаний на бюретке следует сделать после охлаждения пробирки до комнатной температуры.
Результаты измерений и расчетов оформить в виде табл. 1.
Таблица 1
Результаты измерений
-
№
Данные опыта
Номер опыта
1
2
1
Масса навески металла, мг
2
Атмосферное давление (по барометру), P атм. (кПа)
3
Температура опыта, tº C
Для приведения объема выделившегося водорода к нормальным условиям необходимо учесть, что водород, собранный над водой, содержит водяной пар и что общее давление газа в бюретке, равное атмосферному давлению, складывается из парциальных давлений водорода и водяного пара (табл. 2)..
Таким образом, объем водорода при нормальных условиях определяется по уравнению:
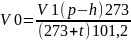
Используя закон эквивалентов, рассчитать молярную массу эквивалента исследуемого металла:
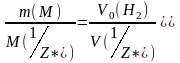
Таблица 2
Давление насыщенного водяного пара при различных температурах
Температура, °С |
Давление, мм.рт.ст. (h) |
Температура, 0С |
Давление мм.рт.ст. (h) |
|
15 |
12,79 |
21 |
18,65 |
|
16
|
13,62 |
22 |
19,83 |
|
17 |
14,53 |
23 |
21,07 |
|
18 |
15,48 |
24 |
22,38 |
|
19 |
16,48 |
25 |
23,76 |
|
20 |
17,54 |
26 |
25,21 |
