
Факторы, влияющие на степень гидролиза
Поскольку гидролиз – обратимая реакция, то на состояние равновесия гидролиза влияют температура, концентрации участников реакции, добавки посторонних веществ. Если в реакции не участвуют газообразные вещества, то давление практически не влияет. Исключается из рассмотрения вода, т.к. ее концентрация в водных растворах практически постоянна (~55 моль/л). Так как гидролиз – равновесный процесс, , то его можно описать количественно при помощи константы гидролиза — константы равновесия гидролитической реакции.
Выведем уравнение константы гидролиза соли, образованной слабой кислотой и сильным основанием:
![]()
![]()
Уравнение константы равновесия для данной реакции будет иметь вид:
![]() или
или ![]()
Так как концентрация
молекул воды в растворе постоянна, то
произведение двух постоянных
![]() можно
заменить одной новой — константой
гидролиза:
можно
заменить одной новой — константой
гидролиза:
![]()
Численное значение
константы гидролиза получим, используя
ионное
произведение воды
![]() и
константу
диссоциации азотистой
кислоты
и
константу
диссоциации азотистой
кислоты
![]() :
:
![]()
![]()
подставим в уравнение константы гидролиза:
![]()
В общем случае для соли, образованной слабой кислотой и сильным основанием:
![]() ,
где Ka —
константа диссоциации слабой кислоты,
образующейся при гидролизе.
,
где Ka —
константа диссоциации слабой кислоты,
образующейся при гидролизе.
Для соли, образованной сильной кислотой и слабым основанием:
![]() ,
где Kb —
константа диссоциации слабого основания,
образующегося при гидролизе.
,
где Kb —
константа диссоциации слабого основания,
образующегося при гидролизе.
Для соли, образованной слабой кислотой и слабым основанием:
![]()
Константа гидролиза зависит от температуры, но не зависит от концентрации раствора
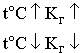
Гидролиз в природе технике, практическое применение
На практике с гидролизом приходится сталкиваться, например, при приготовлении растворов гидролизующихся солей, в частности ацетата свинца. Ели в воду насыпать соль и взболтать, остается белый осадок. Добавив еще воды, взбалтываем – осадок не исчезает. Добавляем горячей воды – осадка кажется еще больше… Причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который видно, – это уже продукты гидролиза – малорастворимые основные соли. Все дальнейшие действия – разбавление, нагревание – только усиливают степень гидролиза.
В результате гидролиза минералов (алюмосиликатов) происходит разрушение горных пород. Гидролиз некоторых солей (Na2CO3, Na3РО4) применяется для очистки воды и уменьшения ее жесткости. Растущая быстрыми темпами гидролизная отрасль промышленности вырабатывает из отходов (древесные опилки, хлопковая шелуха, подсолнечная лузга, солома, кукурузные кочерыжки, отходы сахарной свеклы и др.) ряд ценных продуктов: этиловый спирт, кормовые дрожжи, глюкозу, «сухой лед», фурфурол, метанол, лигнин и многие другие вещества. Гидролиз протекает в организме человека и животных при переваривании пищи (жиров, углеводов, белков) в водной среде под действием ферментов – биологических катализаторов. Он играет важную роль в ряде химических превращений веществ в природе (цикл Кребса, цикл трикарбоновых кислот) и промышленности.
Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающийся гидролизу. В результате происходит полный гидролиз, и железо отделяется в виде осадка гидроксида железа(III).
На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются, и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси. В результате гидролиза минералов – алюмосиликатов – происходит разрушение горных пород. Известкование почв с целью понижения их кислотности также основано на реакции гидролиза: CO32−+ НОН НCO3− + ОН–.
