
Проблемы ионизации и липофильности биологически активных соединений. Гипоксантин, урацил, 6-меркаптопурин, 5-фторурацил.
Как видно из вышесказанного, проблемы ионизации и липофильности — весьма важные проблемы для проникновения веществ через различные мембраны и, конечно, они существенны не только для неорганических катионов, но и для всех молекул соединений, рассматривающихся как биологически активные. Очевидно, что степень ионизации органических молекул в растворах определяется их структурой. Четвертичные соли, например, ионизированы полностью, вне зависимости от рН окружающей среды. Сильные кислоты и щелочи в растворах также ионизированы стопроцентно. Это, однако, совершенно нехарактерно для органических (не четвертичных) соединений, являющихся, как правило, достаточно слабыми кислотами и основаниями. Степень ионизации этих соединений характеризуется их константой ионизации Ка: для равновесий типа
рассмотрение проводится одинаково и величина константы ионизации вычисляется для ионизации оснований А, Как
[АН*] для ионизации кислот АН, как
Четвертичные соли-
Липофильность-
Ионизация-
Кислотность-
Основность-
Электронодоноры-
Для удобства кислотность и основность характеризуется величиной
и из приведенных уравнений следует, что чем в большей степени кислота АН диссоциирует на ионы в выбранной среде, тем больше величина Ка и тем меньше величина рКа. В таблицах даны примеры величин рКя для различных кислот и оснований и из приведенных данных следует ряд выводов, позволяющих оценить, какие структурные изменения приводят к увеличению (уменьшению) кислотности и основности органических соединений Как видно из таблиц, введение в молекулу органической кислоты электроноакцепторных заместителей приводит к увеличению се кислотности, а электронодонорных — к снижению этого параметра. Для оснований картина соответственно обратная — электроноакцепторы дают снижение, а электронодоноры — повышение основности, Таким образом,
варьируя заместители в кислотах и основаниях, можно управлять степенью их ионизации, т.е. количеством ионизированных форм в растворах, что, зачастую, весьма важно для проявления биологической активности, в частности, за счет изменения проникновения веществ через мембраны и за счет различного взаимодействия с мембранами нейтральных И ионизированных молекул.
Как уже указывалось, молекулы испытывают затруднения при проникновении через липофильные мембраны, и в тех случаях, когда биологическое действие осуществляется за мембраной, липофильность молекулы играет весьма значительную роль. Максимальная липофильность особенно важна для наркоза, общих анестетиков. Для веществ, обладающих низким уровнем гидрофильности, например, для сульфамидов при небольшом повышении липофильности активность возрастает, а при дальнейшем повышении падает. Напротив, для пенициллинов и цефалоспоринов активность сначала усиливается при снижении липофильности и падает при дальнейшем ее уменьшении. Понятно, что если бы липофильность была единственным параметром, от которого зависело бы биологическое действие, изыскание новых лекарств являлось бы не такой уж сложной проблемой. Однако это не так. Существует множество факторов, определяющих биологическое действие. К ним относятся и электронные свойства заместителей, и стерические характеристики молекулы в целом.
Следует отметить, что изменение липофильности веществ, то есть повышение возможности проникновения через мембраны первого типа (простая диффузия) и поиск соединений, способных к переносу через мембраны с использованием переносчиков — важные пути изыскания биологически активных соединений. Так, информация о транспорте в клетку таких соединений, как гипоксантин, урацил — необходимых блоков для синтеза ксантина и нуклеиновых кислот, явилась основой для получения известных противоопухолевых препаратов 6-меркаптопурина и 5-фторурацила.

Здесь уместно также отмстить, что способность некоторых поверхностно активных соединений повреждать цитоплазматические мембраны бактерий использована для создания антибактериальных средств в ряду четвертичных аммониевых солей, имеющих гидрофобные заместители с длинной алкильной цепью (обычно С12 и более). Например, цетилтриметиламмоний бромид:

Механизм действия подобных соединений связан, по-видимому, с образованием больших пор в мембранах, через которые из клеток выходят крупные молекулы и клетки перестают функционировать.
Необходимо отметить, что при исследовании производных акридина было установлено, что именно максимально ионизированные соединения в этом ряду обладают максимальной бактериостатической активностью. Так, показано, что из исследованных аминоакридинов наивысшей активностью обладает 9-аминоакридин, который при рН 7,3 ионизирован на 99%. Именно концентрация катиона (а не общее количество соединения) определяет бактериостатическое действие производных акридина. Сейчас уже ясно, что производные акридина интеркалируют в ДНК и ингибируют ДНК-полимеразу бактерий путем связывания с матричной ДНК. Оба этих механизма обусловлены возможностью связывания производных акридина с ДНК, которое усиливается ионным взаимодействием, характерным именно для катионов.
Депонирование, выведение, метаболизм. Зависимость депонирования от структуры соединения. Способность альбумина связывать лекарственные препараты.
Выведение лекарственных препаратов. Трансформация лекарств в организме. Почечный клиренс.
Химическая инактивация лекарственных препаратов-метаболизм. Метаболические процессы I и II фазы. Окисление первичных и вторичных спиртов под действием алкогольдегидрогеназы. Превращение янтарной кислоты в малеиновую под действием сукцинатдегидрогеназы.
Метаболизм углеводов и липидов. Примеры превращения лекарственных средств в процессе метаболизма в более биологически активные соединения.
Фармакодинамика. Определение понятия «рецептор». Химические связи, участвующие во взаимодействии «лекарство-рецептор». Локализация рецепторов.
Схема индукции фармакологического эффекта лекарственного вещества.

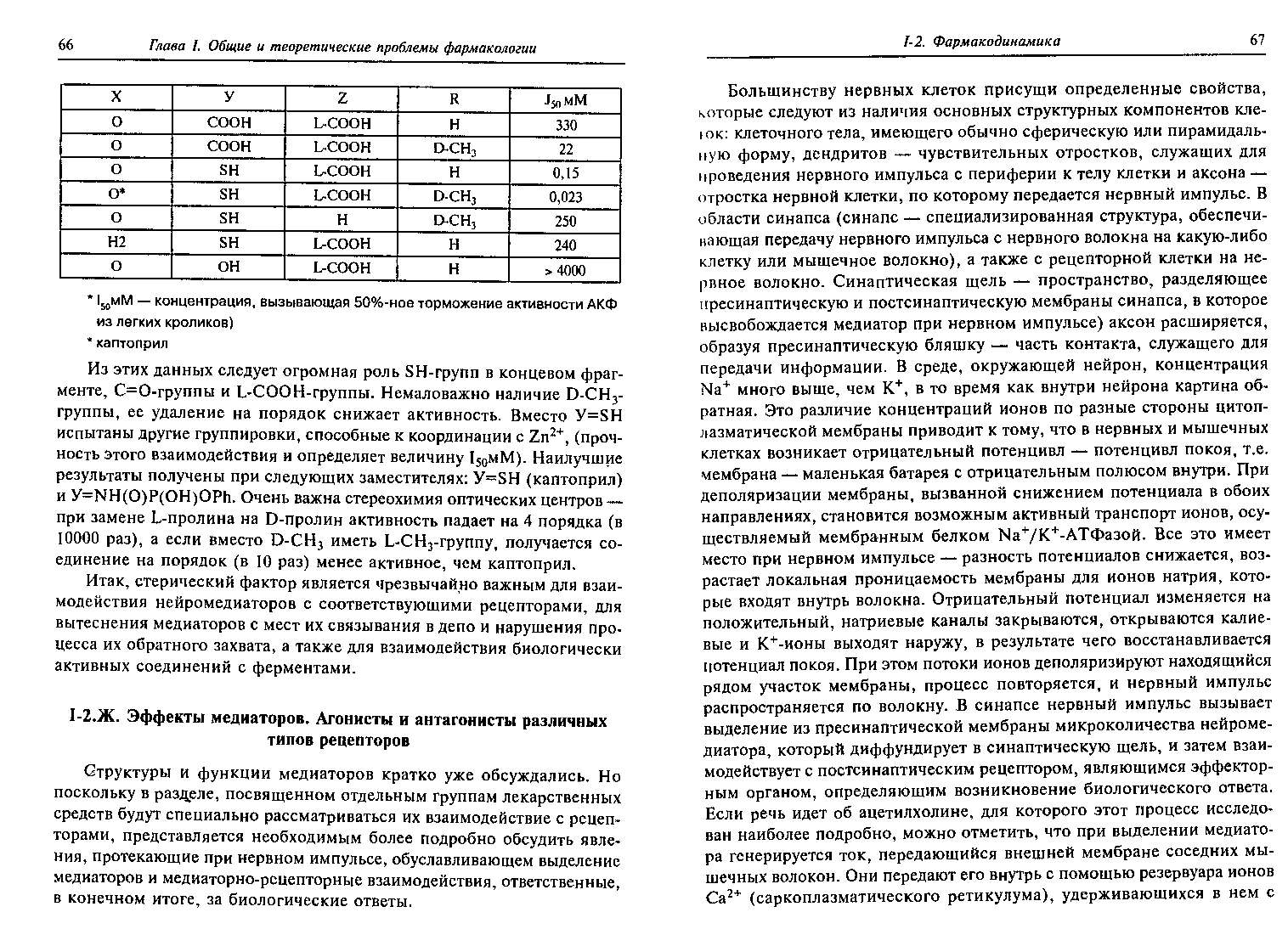
Нейромедиаторы - ацетилхолин, норадреналин, глицин, глутаминовая кислота, эндорфин.
Синергизм и антагонизм. Примеры: Пенициллины и пробенецид; Сульфазин и хлоридин; Пенициллин и тетрациклины; Новокаин и сульфамидные препараты.


Метаболиты. Антиметаболиты. Примеры.
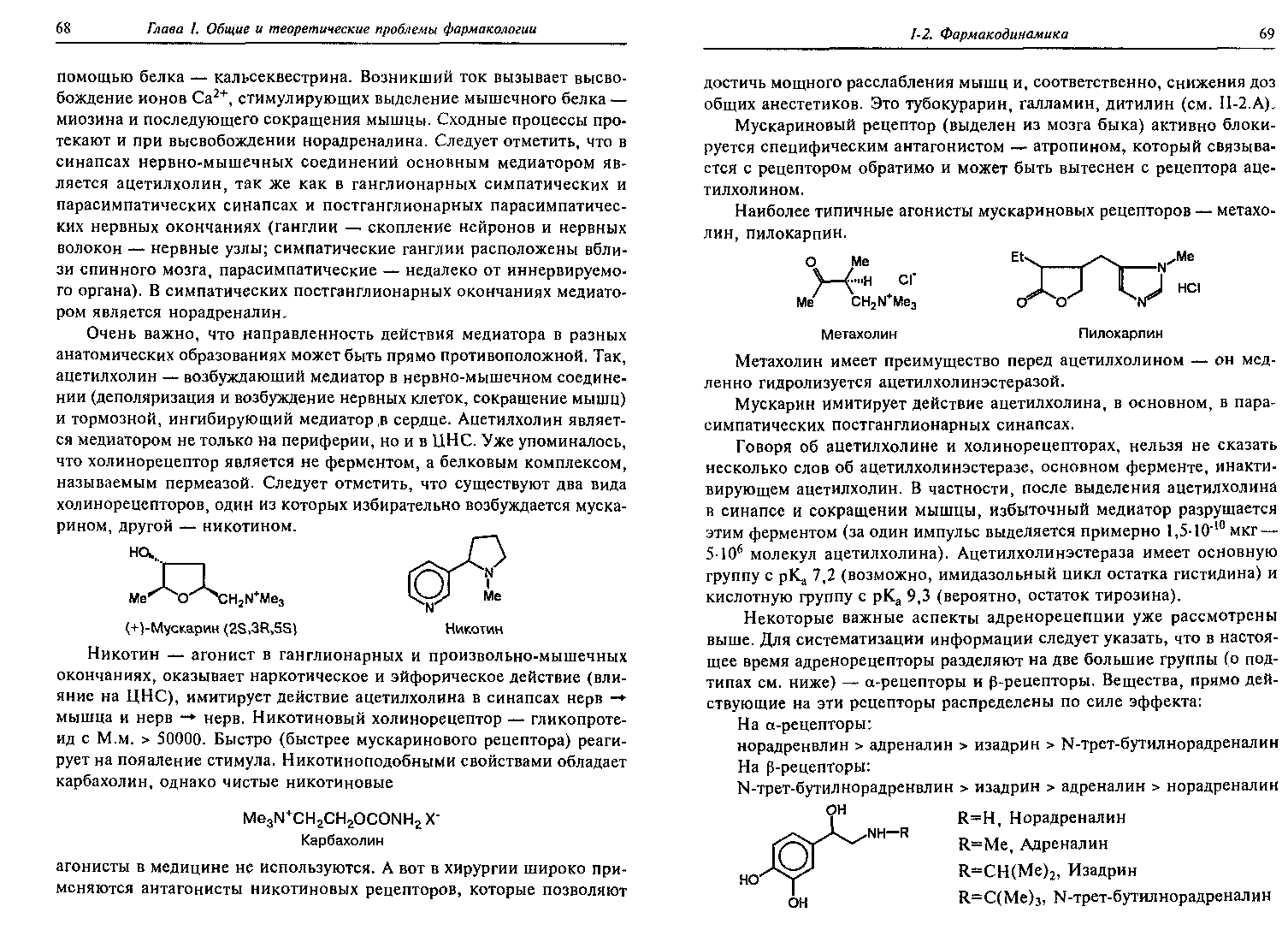
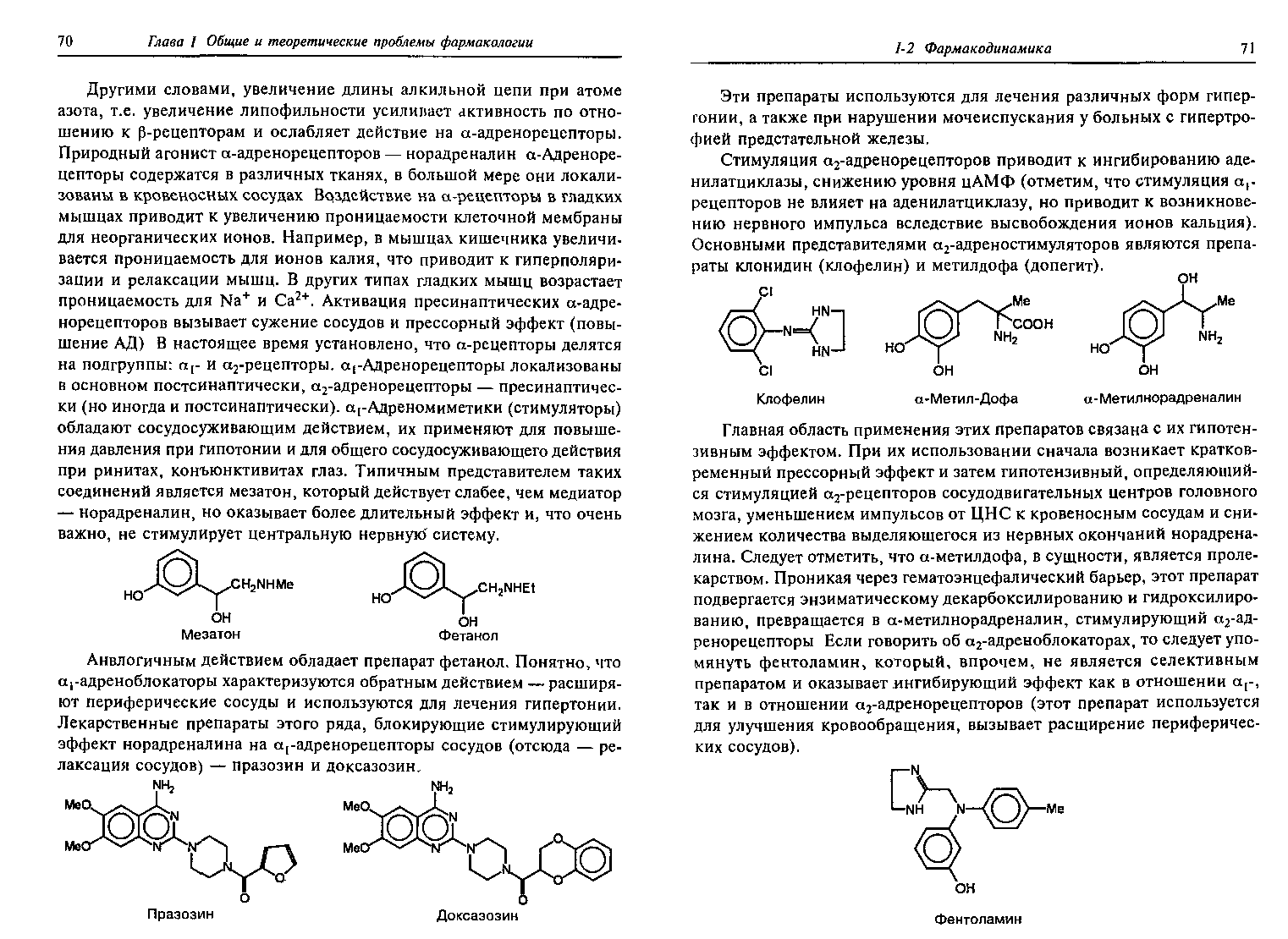
Агонисты и антагонисты различных типов рецепторов.
Средства для ингаляционного наркоза: фторотан, метоксифлуран. Промышленное получение фторотана и хлороформа.


Снотворные средства. Барбитураты. Требования к снотворным средствам (по М.Д.Машковскому).
Этанол- антисептик. Промышленное получение этанола. Получение этанола ферментативным путем.


Анальгезирующие и противовоспалительные препараты. Ацетилсалициловая кислота.
Аспирин. Синтез аспирина-карбоксилирование фенолята натрия.

Гистамин и антигистаминные препараты.Синтез димедрола-алкилирование бензгидрола.
Спазмолитики. Папаверин, но-шпа.
Антибиотики. Пенициллины, цефалоспорины, тетрациклины.
Вирусы. Противовирусные препараты- арбидол, ремантадин, оксолин.
Синтез оксолина-окисление 1-амино-β-нафтола.

Кинетика взаимодействия лиганд-рецептор. Агонист, антагонист, частичный агонист, аффинность.

Аденилатциклазная система передачи сигнала.
ц ГМФ как вторичный посредник.
Ионы Са +2 как вторичные посредники.
Определение «фермент», «активный центр», «апофермент», «кофермент».
Лекарственные средства, влияющие на синтез нуклеиновых кислот и белков. Рифамицин, стрептомицин и др.
Методы изучения метаболизма лекарственных препаратов.

Факторы, влияющие на метаболизм лекарственных веществ: дозировка препарата, пути введения препарата, видовая специфичность метаболизма, взаимодействие лекарств.



Роль сведений о метаболизме в конструировании лекарственных средств.

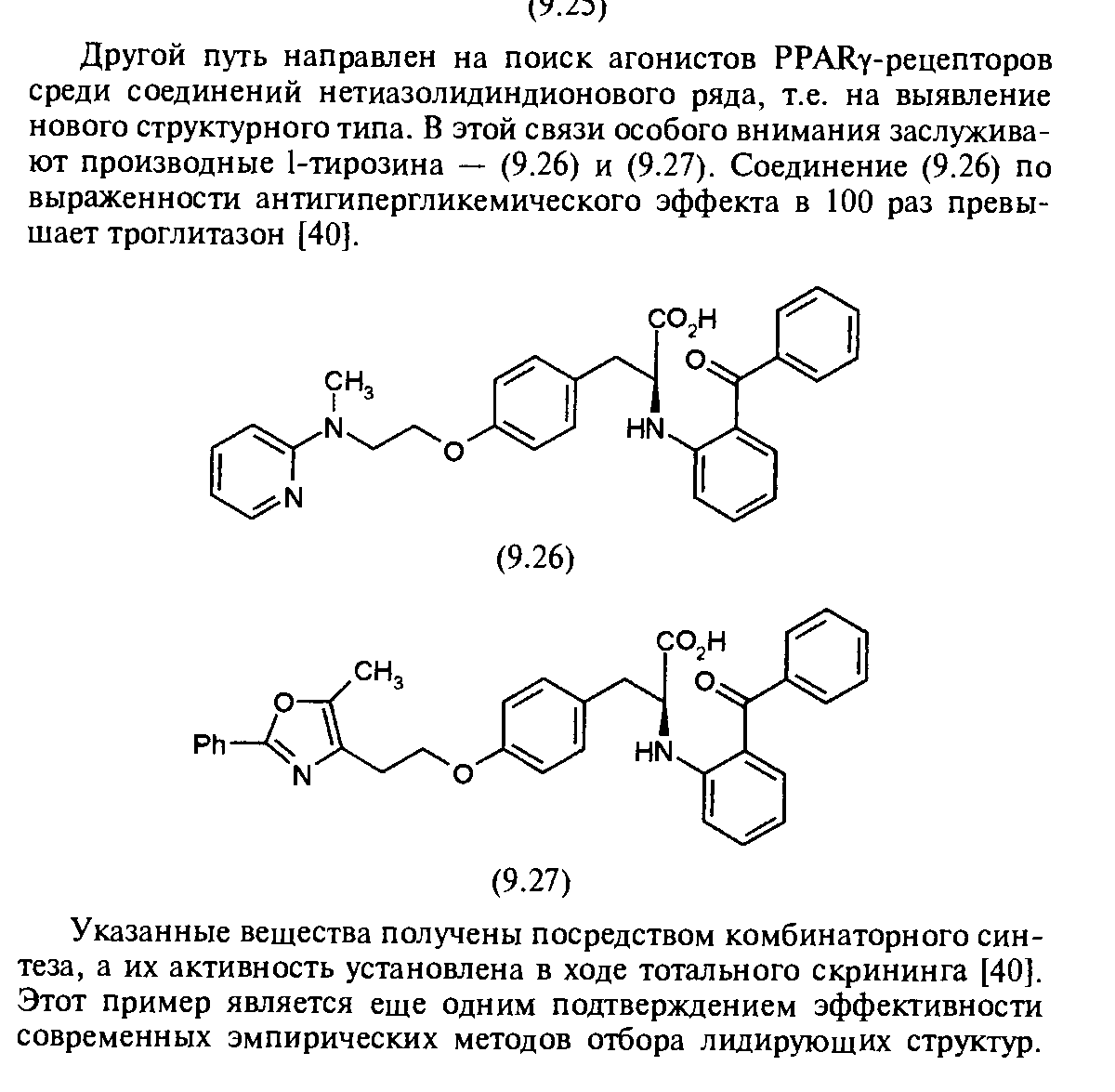
Выбор стратегий исследования при создании новых лекарственных средств. Структура-лидер. Критерии оценки качества структуры-лидера.




Источники поиска новых лекарственных средств. Природное сырье как источник новых лекарственных средств.
Официальные лекарственные средства как источник создания новых лекарственных препаратов.
Физиологические посредники как источник новых лекарственных средств. На примере создания антигистаминных препаратов.
Пролекарства. Защитные группы, применяемые в конструировании пролекарств.
Способы повышения водорастворимости лекарственных веществ.
Способы повышения липофильности лекарственных веществ.
Способы метаболической и химической стабильности лекарственных веществ. «Маскировка» фармакофоров.
Конструирование мягких лекарств.
Барбитураты, терапевтический эффект барбитуратов. Общая схема получения барбитуратов-циклоконденсация замещенных эфиров малоновой кислоты.
Биологические испытания новых соединений: исследования in vitro.
Биологические испытания новых соединений: исследования: тотальный скрининг.
Биологические испытания новых соединений:скрининг комбинаторных библиотек.
Биологические испытания новых соединений: исследования на лабораторных животных.
Клинические испытание. Оценка побочных эффектов, терапевтического эффекта.
Фенол- антисептик. Получение фенола окислением изопропилбензола.

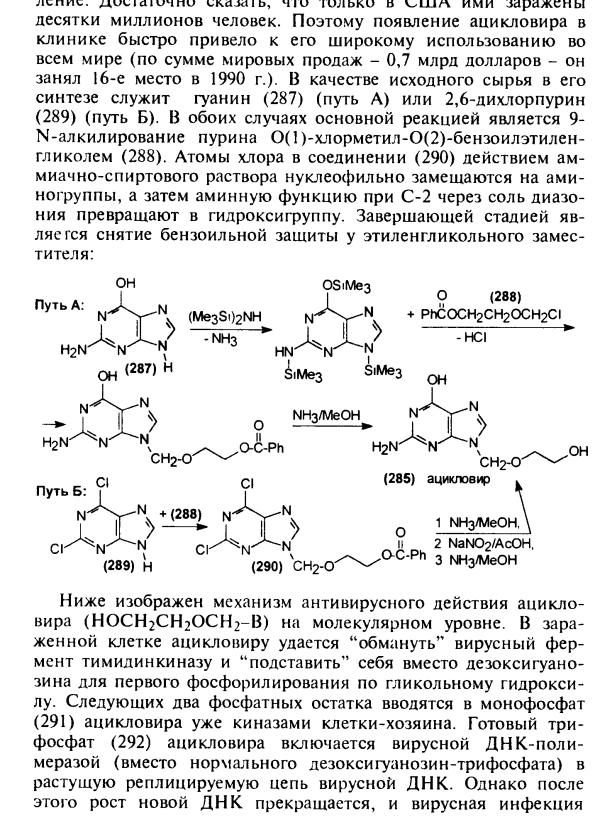
Ацикловир- противовирусный препарат. Два пути синтеза ацикловира.
Фенолфталеин-антисептик, слабительное. Получение фенолфталеина окислением нафталина.

