Лабораторная работа № 4
Изучение реального газа (Эффект Джоуля-Томсона)
Цель работы.
Целью лабораторной работы является экспериментальное определение изменения температуры воздуха в процессе адиабатного дросселирования при перепаде давления на дросселе до 12 атмосфер, а также определить внутреннее давление газа, применяя для воздуха модель реального газа Ван-дер-Ваальса.
Краткое теоретическое введение.
В 1852 – 1862 гг. совместно Джоулем и В. Томсоном был выполнен целый ряд экспериментальных работ по исследованию термодинамических свойств газов. В этой серии работ ими был обнаружен эффект названный в последствии эффектом Джоуля-Томсона.
|
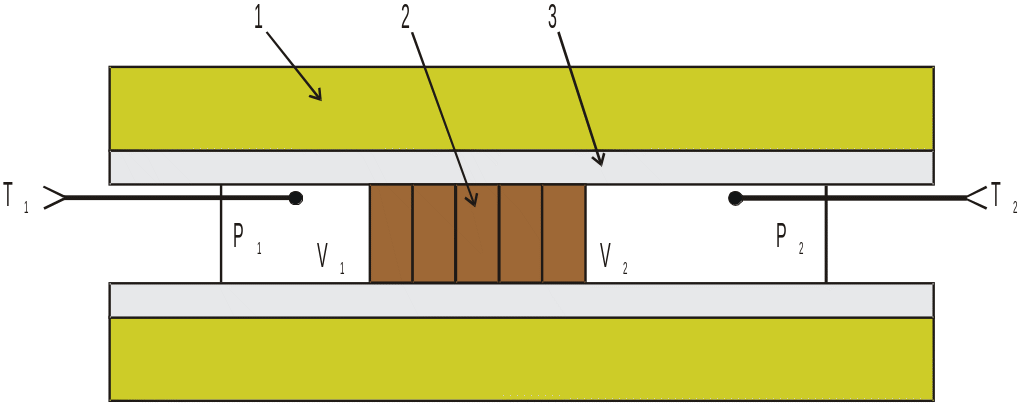
Рис. 1. Схематическое изображение опыта Джоуля-Томсона.
1 – теплоизолирующая оболочка. 2 – пористая перегородка 3 – цилиндрическая трубка |
В опыте Джоуля и Томсона
цилиндрическая трубка, окруженная
теплоизолирующим веществом, разделяется
на две части с помощью пробки из плотного
материала (вата или очесы шелка). Схема
опыта представлена на рисунке 1.
Исследуемый газ под действием разности
давлений медленно перетекает через
пробку. Благодаря наличию пробки газа
течет спокойно без турбулентности.
Кроме того, медленность течения позволяет
пренебречь кинетической энергией газа
как величиной, пропорциональной квадрату
скорости. Наличие тепловой защиты делает
процесс адиабатическим. Давления газа
![]() и
и
![]() по обе стороны от пробки поддерживается
постоянным. Пробка и газ обмениваются
теплом до тех пор, пока процесс не
становится стационарным, после этого
физическое состояние пробки, а значит
и ее внутренняя энергия, остается
неизменным. При стационарном течении
газа по одну сторону пробки устанавливалась
температура
по обе стороны от пробки поддерживается
постоянным. Пробка и газ обмениваются
теплом до тех пор, пока процесс не
становится стационарным, после этого
физическое состояние пробки, а значит
и ее внутренняя энергия, остается
неизменным. При стационарном течении
газа по одну сторону пробки устанавливалась
температура
![]() ,
а по другую температура
,
а по другую температура
![]() .
Стационарное течение газа через пробку
называется процессом Джоуля-Томсона,
а изменение температур при таком течении
эффектом Джоуля-Томсона.
.
Стационарное течение газа через пробку
называется процессом Джоуля-Томсона,
а изменение температур при таком течении
эффектом Джоуля-Томсона.
Применим к эффекту Джоуля-Томсона первое начало термодинамики. Помня, что процесс адиабатический (т.е. газ не получает тепла, состояние пробки и ее внутренняя энергия не изменяются), можно записать
![]() .
.
Заметим, что из уравнения
следует постоянство энтальпии
![]() в процессе Джоуля-Томсона. Используем
это свойство для определения разности
температур
в процессе Джоуля-Томсона. Используем
это свойство для определения разности
температур
![]() в процессе Джоуля-Томсона при разности
давлений
в процессе Джоуля-Томсона при разности
давлений
![]() :
:
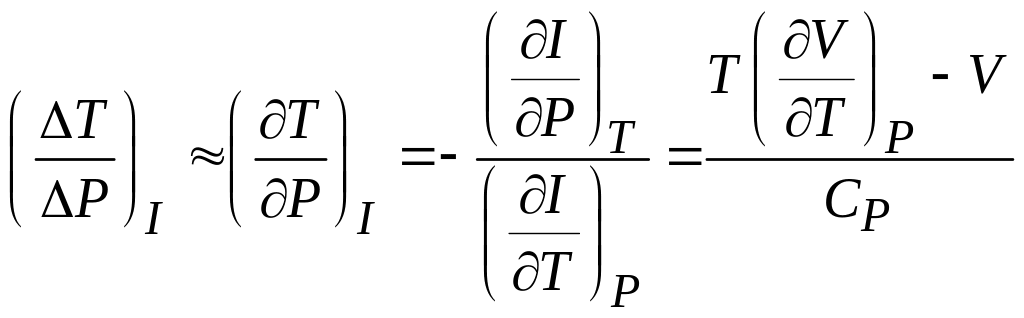 ,
,
Для дальнейшего использования формулы необходимо определить уравнение состояния. В частности, можно видеть, что для идеального газа числитель выражения в правой части обращается в ноль.
Рассмотрим более реалистическое приближение для уравнения состояния. Как известно, отступление от законов идеального газа объясняется существованием межмолекулярных сил, которыми пренебрегают в модели идеального газа. Из опыта мы знаем, что потенциальную энергию межмолекулярного взаимодействия можно приближенно представить в виде потенциала Леннарда-Джонса
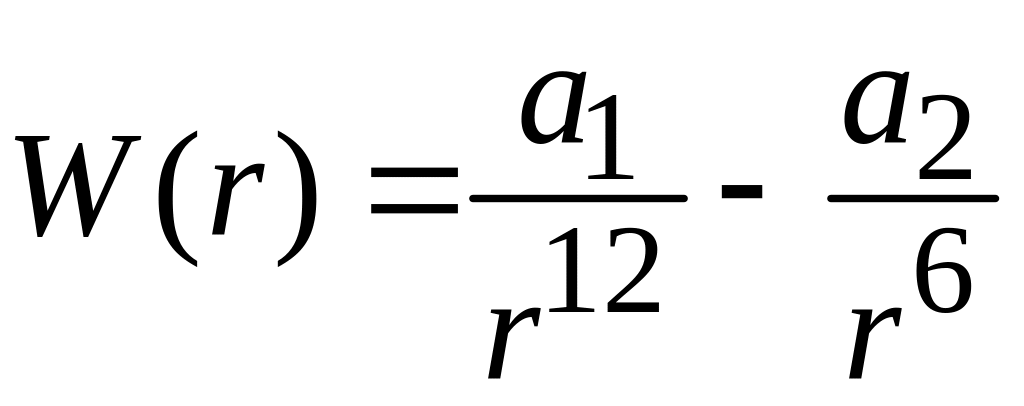 ,
,
здесь
![]() и
и
![]() – положительные константы. Отсюда
видно, что на малых расстояниях
межмолекулярные силы носят резко
отталкивающий характер, а на больших
расстояниях – притягивающий. Для учета
этих особенностей молекулярного
взаимодействия в модели газа Ван-дер-Ваальса
вводят две поправки.
– положительные константы. Отсюда
видно, что на малых расстояниях
межмолекулярные силы носят резко
отталкивающий характер, а на больших
расстояниях – притягивающий. Для учета
этих особенностей молекулярного
взаимодействия в модели газа Ван-дер-Ваальса
вводят две поправки.
Первая поправка связана
с взаимодействием молекул на малых
расстояниях, где оно заменяется
взаимодействием абсолютно упругих
твердых шаров некоторого радиуса
![]() ,
так что
,
так что
![]() .
Это приводит к тому, что при столкновении
центры молекул не могут сблизиться на
расстояние меньшее
.
Это приводит к тому, что при столкновении
центры молекул не могут сблизиться на
расстояние меньшее
![]() .
Если в сосуде имеется
.
Если в сосуде имеется
![]() одинаковых молекул, то такую ситуацию
можно представить как, если бы половина
из этих молекул была заменена неподвижными
сферами радиуса
,
а молекулы другой половины были бы
точечными и двигались с удвоенной
кинетической энергией. Тогда мы бы имели
идеальный газ, состоящий из
одинаковых молекул, то такую ситуацию
можно представить как, если бы половина
из этих молекул была заменена неподвижными
сферами радиуса
,
а молекулы другой половины были бы
точечными и двигались с удвоенной
кинетической энергией. Тогда мы бы имели
идеальный газ, состоящий из
![]() молекул, находящийся в объеме
молекул, находящийся в объеме
![]() .
Величина
.
Величина
![]() и есть искомая поправка. Уравнение
состояния одного моля такого газа можно
записать в виде
и есть искомая поправка. Уравнение
состояния одного моля такого газа можно
записать в виде
![]() ,
,
где суммарный недоступный объем газа
![]() .
.
Вторая поправка связана
с притягивающим взаимодействием молекул
на больших расстояниях, которое приводит
к появлению так называемого внутреннего
давления газа
![]() .
Можно показать, что величина
будет пропорциональна квадрату
концентрации молекул газа (чем больше
молекул газа в объеме, тем больше
суммарная сила «самопритяжения»).
Поэтому уравнение состояния моля такого
газа можно записать в виде
.
Можно показать, что величина
будет пропорциональна квадрату
концентрации молекул газа (чем больше
молекул газа в объеме, тем больше
суммарная сила «самопритяжения»).
Поэтому уравнение состояния моля такого
газа можно записать в виде
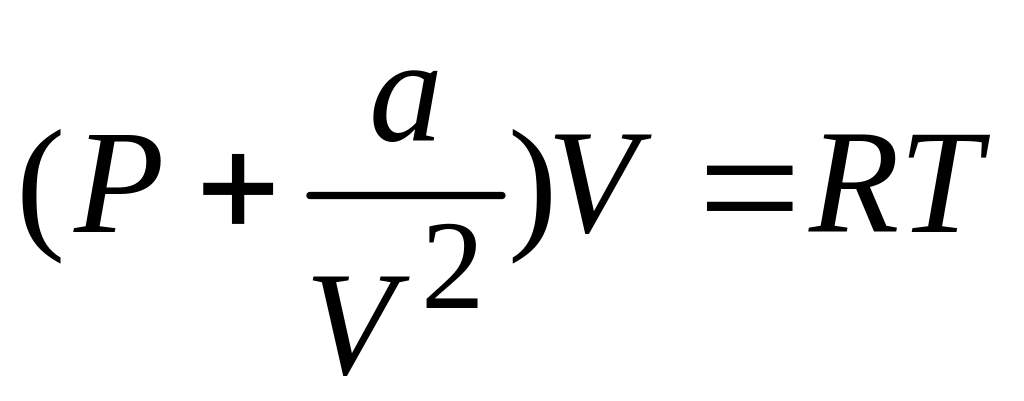 ,
,
где
![]() – вторая поправочная величина,
представляющая собой некоторую константу,
характерную для данного газа.
– вторая поправочная величина,
представляющая собой некоторую константу,
характерную для данного газа.
Объединяя формулы и , получим уравнение состояния газа Ван-дер-Ваальса
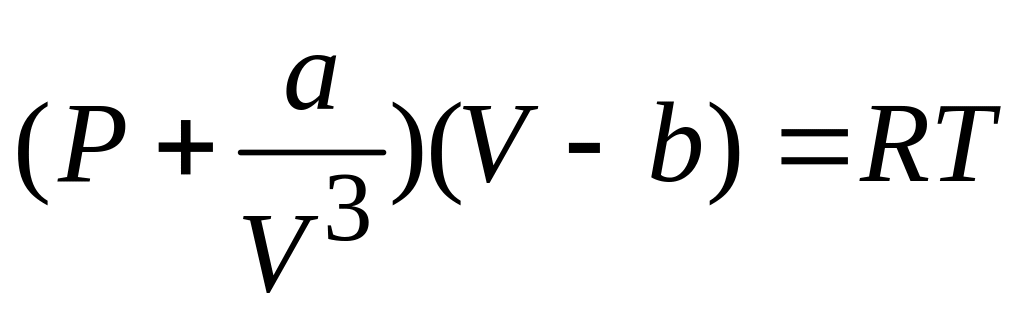 .
.
Определить зависимость внутренней энергии газа Ван-дер-Ваальса от объема и температуры можно на основании соотношения для газа в состоянии термодинамического равновесия (см. §34 [1])
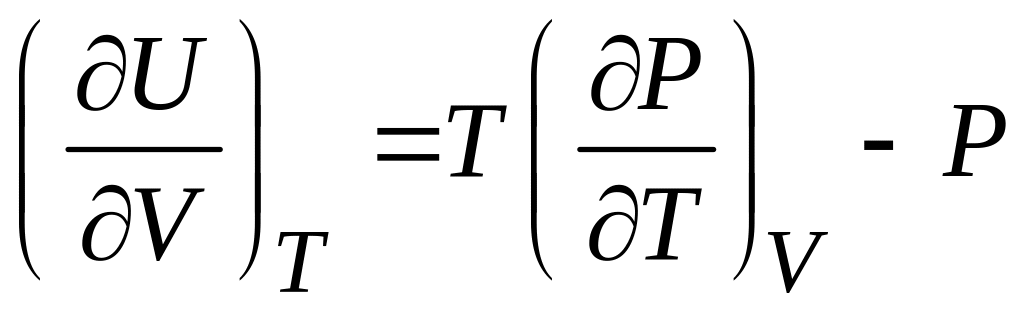 ,
,
откуда с учетом поучим
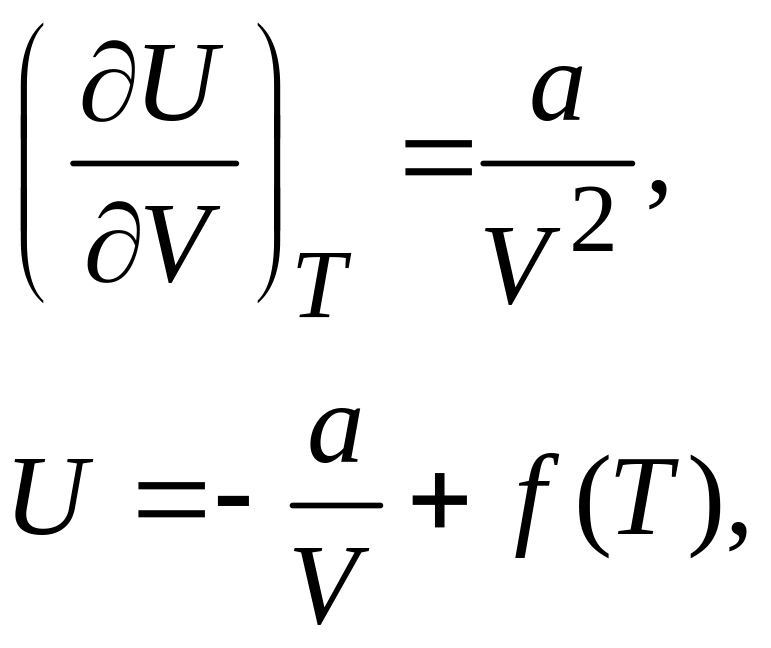
где
![]() – «постоянная интегрирования», которая
может зависеть только от температуры,
здесь мы так же пренебрегли зависимостью
теплоемкости от температуры. Для
внутренней энергии неидеального газа
получим
– «постоянная интегрирования», которая
может зависеть только от температуры,
здесь мы так же пренебрегли зависимостью
теплоемкости от температуры. Для
внутренней энергии неидеального газа
получим
![]() .
.
Используем выражения и для определения константы Ван-дер-Ваальса для воздуха
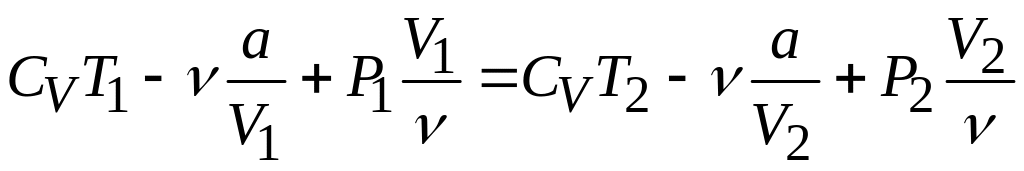 .
.
Перегруппировывая слагаемые в последнем выражении, получим
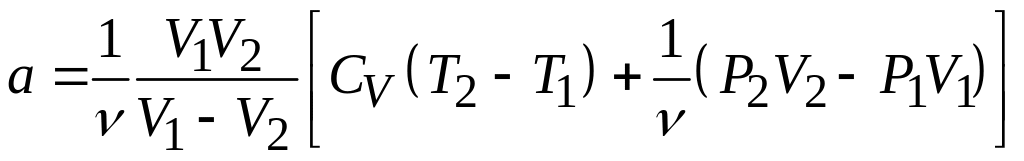 ,
,
где
![]() – количество молей воздуха в объеме
– количество молей воздуха в объеме
![]() ,
,
![]() – объем того же количества молей
– объем того же количества молей
![]() воздуха после перетекания через пористую
перегородку.
воздуха после перетекания через пористую
перегородку.
Схема экспериментальной установки.
|
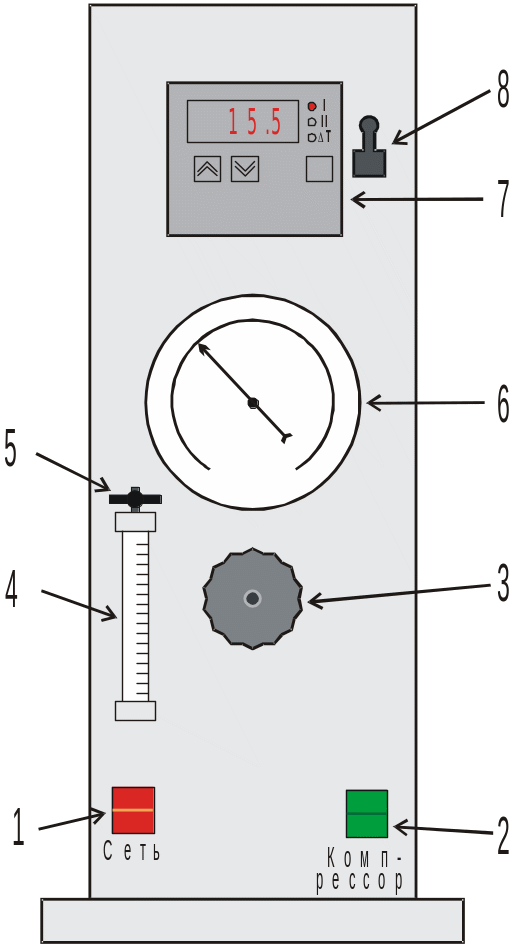
Рис. 2 Общий вид установки:
1 – тумблер «Сеть». 2 – тумблер включения компрессора 3 – кран регулировки давления 4 – ротаметр 5 – регулировочный вентиль ротаметра 6 – манометр 7 – измеритель температуры 8 – тумблер включения измерителя температуры |
|
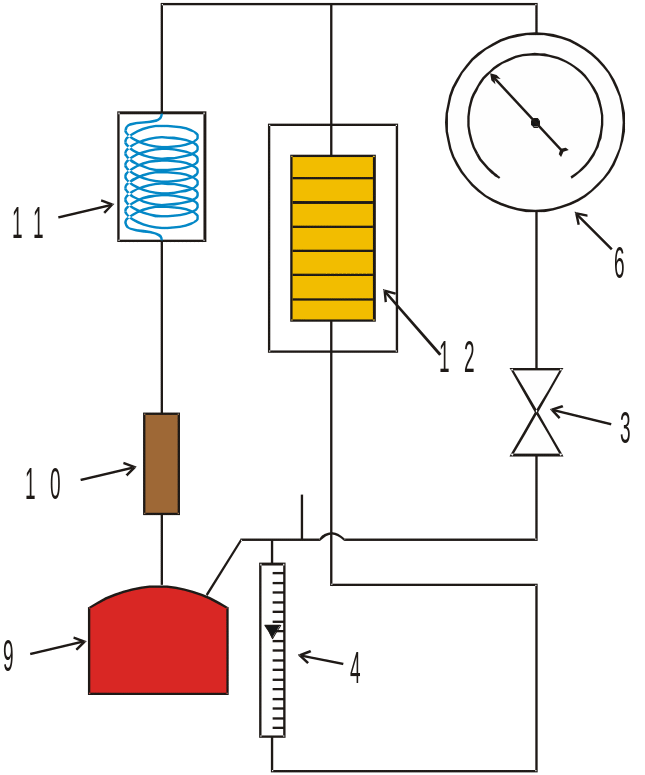
Рис. 3 Рабочий участок установки
3 – кран регулировки давления 4 – ротаметр 6 – манометр 9 – компрессор 10 – сепаратор 11 – холодильник 12 – дроссель
|
Схема установки и рабочего участка приведены на рис. 2 и 3. Рабочий объем – дроссель (12) – представляет собой цилиндрическую гильзу из текстолита, запрессованную в дюралевую оболочку и заполненную уплотненным войлоком. Через специальные уплотнения со стороны высокого и низкого давлений вводятся термопары, для определения температур на входе и выходе из дросселя. Гильза с войлоком находится в теплоизоляции.
Принцип работы установки
состоит в следующем. Сжатый воздух с
помощью компрессора (9) подается в
дроссель (12) через сепаратор (10) и
холодильник (11). Давление воздуха на
входе в дроссель регулируется краном
(3). Манометр (6) измеряет избыточное
давление
по отношению к атмосферному, т.е. давление
на входе в дроссель
![]() ,
а на выходе
,
а на выходе
![]() .
Шкала манометра градуирована в единицах
кгс/см2.
Расход воздуха измеряется с помощью
ротаметра (4), работа с которым описана
в разделе с дополнительной информацией.
.
Шкала манометра градуирована в единицах
кгс/см2.
Расход воздуха измеряется с помощью
ротаметра (4), работа с которым описана
в разделе с дополнительной информацией.
Порядок проведения работы:
Перед началом работы вывернуть кран регулировки давления (3) до упора против часовой стрелки.
Включить установку тумблером «Сеть» (1). Включить измеритель температуры (5) тумблером (6).
Измерить температуры воздуха на входе и выходе дросселя. Если они не меняются и совпадают (
 0.1оС),
можно начинать опыт.
0.1оС),
можно начинать опыт.
Тумблером (2) включить компрессор и установить начальное избыточное давление на входе = 3 кгс/см2. По показаниям ротаметра определить объемный расход воздуха
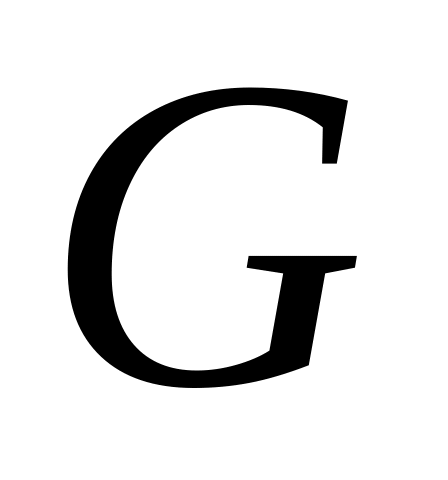 через дроссель (ниже см. дополнительную
информацию по пользованию ротаметром).
через дроссель (ниже см. дополнительную
информацию по пользованию ротаметром).Через 2-3 минут по показаниям измерителя температуры (7) произвести отсчет температур и .
Повторить измерения, описанные в пунктах 4 – 5, для давлений на входе = 4, 5, 6 и 7 кгс/см2. Данные занести в таблицу 1.
Медленно открывая кран, убрать давление. Выключить компрессор.
Полагаем, что объем воздуха после его перетекания через пористую перегородку за 1 сек равен
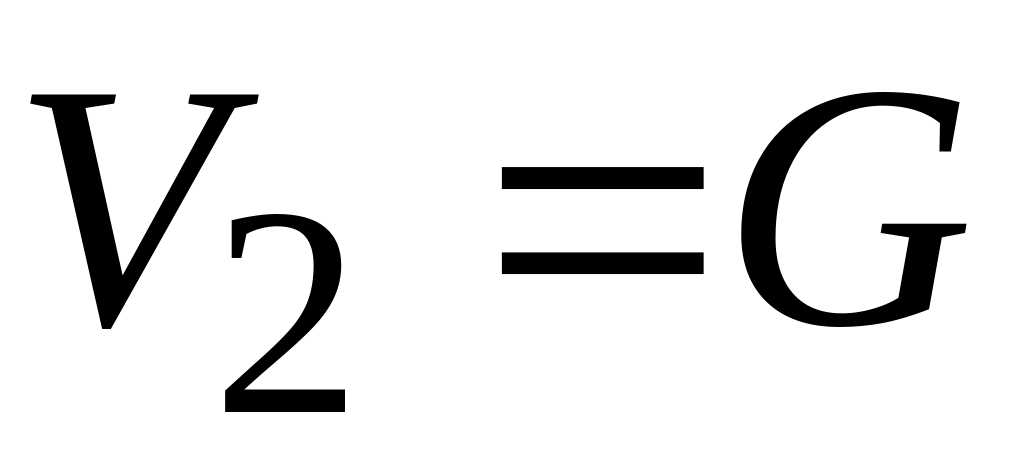 .
Вычислим число молей в объеме
.
Вычислим число молей в объеме
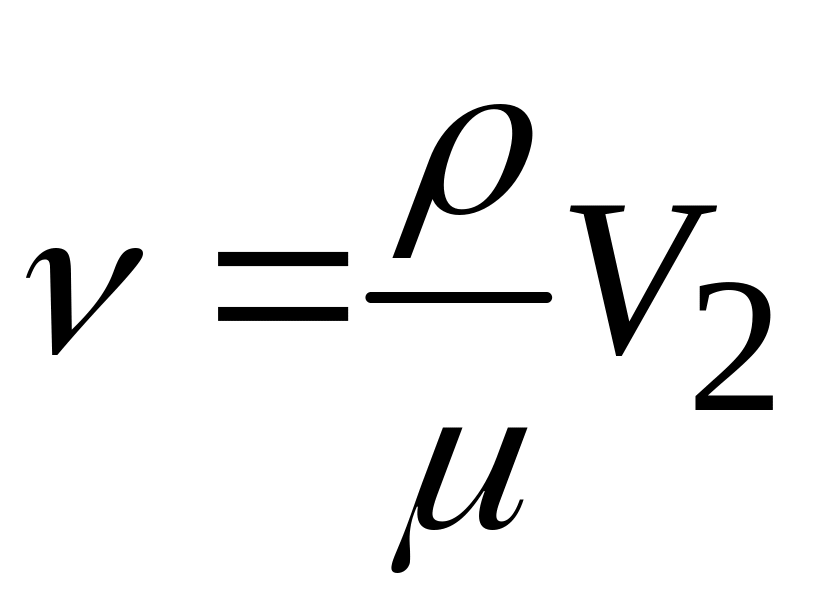 ,
[моль/сек].
,
[моль/сек].
Объем того же количества молей воздуха до перетекания через перегородку приближенно оценить по формуле
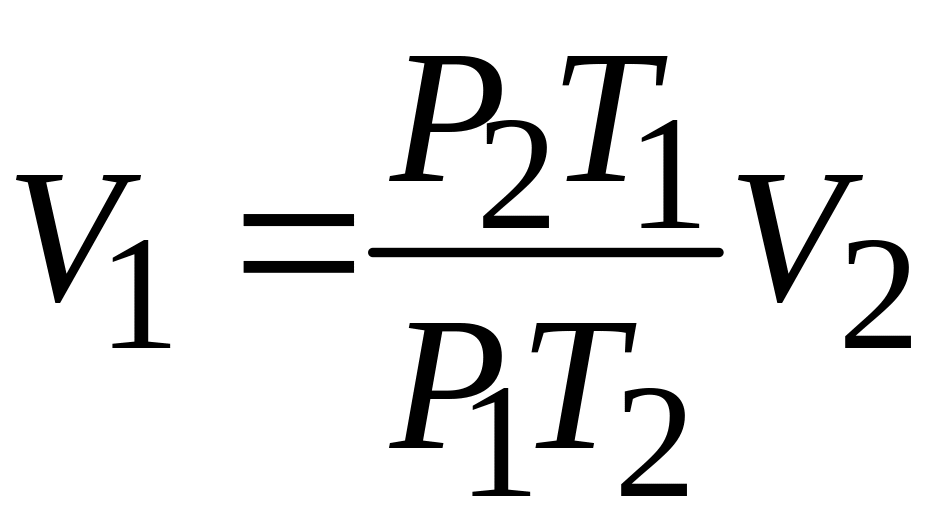 ,
[м3/сек].
,
[м3/сек].
Константу Ван-дер-Ваальса определить по формуле для каждой серии опыта. Вычислить среднее значение. Для полученного значения вычислите поправку к давлению воздуха. По формуле оцените величину поправки к объему воздуха.
Оценить погрешность измерений.
Таблица 1.
№ |
T1,оС |
T2, оС |
T, оС |
P, кгс/см2 |
P1, кгс/см2 |
P2, кгс/см2 |
V1, м3/сек |
V2, м3/сек |
, моль/сек |
a, Н*м4/моль2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дополнительная информация:
1. Оценка плотности воздуха при атмосферной температуре и атмосферном давлении производится на основании уравнения состояния молей идеального газа
![]() ,
,
где
![]() – давление газа,
– давление газа,
![]() – объем газа,
– объем газа,
![]() – его температура в оК,
– его температура в оК,
![]() = 8.31 Дж/(моль*К) – универсальная газовая
постоянная. Умножая на молекулярную
массу воздуха
= 8.31 Дж/(моль*К) – универсальная газовая
постоянная. Умножая на молекулярную
массу воздуха
![]() ,
для плотности воздуха получим следующее
выражение
,
для плотности воздуха получим следующее
выражение
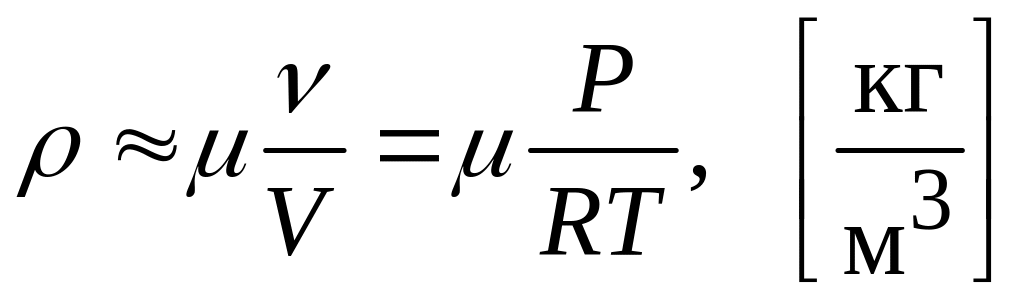 .
.