
- •Общая и неорганическая химия
- •Закон эквивалентов.
- •Классы неорганических соединений. Кислые соли.
- •Основные соли.
- •Строение атома.
- •Современная теория строения атома.
- •Квантовые числа и их физический смысл.
- •Периодический закон и периодическая система д. И. Менделеева.
- •Физический смысл периодического закона.
- •Изменение свойств элементов и их соединений по периодической системе.
- •Химическая связь.
- •Параметры химической связи.
- •Ковалентная связь.
- •Метод валентных связей.
Классы неорганических соединений. Кислые соли.
Кислыми солями называются продукты неполного замещения атомов водорода в кислоте на атомы металла.
![]()
![]() - фосфат калия
- фосфат калия
![]() - дигидрофосфат калия
- дигидрофосфат калия
![]() - гидрофосфат калия
- гидрофосфат калия
![]() - гипофосфит натрия.
- гипофосфит натрия.
Получение кислых солей:
1). Реакция нейтрализации с избытком кислоты.
![]()
изб.
![]() .
.
2). Основание плюс избыток кислотного оксида.
![]()
изб.
![]()
3). Средняя соль плюс кислота.
С![]() войства
кислых солей:
войства
кислых солей:
1). Кислые соли взаимодействуют с гидроксидами (нейтрализация кислой соли).
![]()
![]() .
.
2). Кислая соль взаимодействует с кислотой.
![]()
![]() .
.
Основные соли.
Основной солью называется продукт неполного замещения гидроксо-группы в основании на кислотный остаток. Щелочи основных солей не образуют.
![]()
![]()
![]() -
хлорид железа
-
хлорид железа
![]() -
хлорид
-
хлорид
дигидроксожелеза (III)
![]() - хлорид
- хлорид
гидроксожелеза (III).
![]()

Получение основных солей.
1). Реакция нейтрализации с избытком основания.
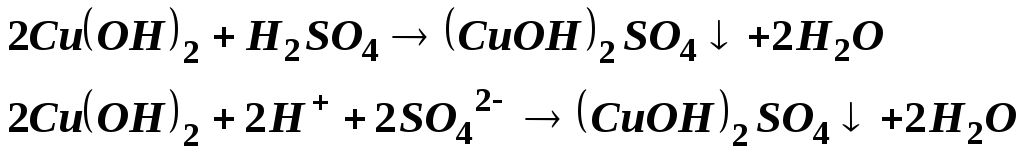
2). Средняя соль плюс щелочь (недостаток).
![]()
недост.
![]() .
.
Свойства основных солей.
1). С кислотами (реакция нейтрализации основной соли).

2). Реакция со щелочами.

Строение атома.
В конце XIX – XX
веков были открыты явления, которые
указывали на то, что атом сложная частица.
К таким явлениям относятся: радиоактивность
(Беккерель), открытие катодных лучей
(Томсон, Крукс), открытие фотоэффекта
(Столетов). В начале XX века
катодные лучи представляют собой поток
электронов. Электрон – заряженная
частица, имеющая очень малую массу.
![]() .
.
Электрон несет отрицательный заряд:
![]() .
.
1904 г. – Томсон. Согласно его модели атом представляет море положительного заряда, в который вкраплены маленькие, отрицательно заряженные электроны.
1911 г. – Резерфорд создает планетарную модель атома. На основании своих опытов Резерфорд рассчитал радиус ядра атома и радиус самого атома.
![]()
Модель Резерфорда была основана на законах классической механики, согласно которым любое движущееся тело теряет энергию. Поэтому электрон должен был приближаться к ядру атома. А это приводит к самоуничтожению атома.
1913 г. – Модель Резерфорда попытался
спасти датский ученый Н. Бор. Он создает
теорию строения атома водорода, используя
при этом одно из положений квантовой
механики, что микрочастицы испускают
и поглощают энергию не непрерывно, а
порциями (квантами). Он использовал
уравнение М. Планка, что
![]() ,
где h – постоянная Планка,
,
где h – постоянная Планка,
![]() - частота испускания. Он выдвинул 3
постулата и рассчитал радиусы дозволенных
(стационарных) орбит и скорости движения
электронов на этих орбитах. Он показал,
что радиусы атомов стационарных орбит
относятся друг к другу как квадраты
натуральных чисел. Он рассчитал энергию
электрона на каждой из стационарных
орбит. Энергия электрона равна
- частота испускания. Он выдвинул 3
постулата и рассчитал радиусы дозволенных
(стационарных) орбит и скорости движения
электронов на этих орбитах. Он показал,
что радиусы атомов стационарных орбит
относятся друг к другу как квадраты
натуральных чисел. Он рассчитал энергию
электрона на каждой из стационарных
орбит. Энергия электрона равна
![]() ,
где Z – заряд ядра атома,
h – орбиты.
,
где Z – заряд ядра атома,
h – орбиты.
Расчеты Бора достаточно хорошо совпадают с данными по энергии об электронах полученных опытным путем. Опытные данные по энергии электронов были получены на основании излучения спектра атома водорода. Различают спектры испускания и спектры поглощения. Спектры испускания – это спектры, полученные при испускании энергии веществом. Спектры поглощения – это спектры той энергии, которое вещество поглощает.

При переходе на n=1 лучи лежат в инфракрасной области спектра. Спектры атомов линейчатые. Спектры молекул полосатые. Спектры твердых тел сплошные. Теория Бора для атома водорода достаточно хорошо совпадала с данными атома водорода. Однако эта теория не могла объяснить такие явления, как: мультиплексность спектра, яркость линий в спектре, а также эффекты Штарка и Зеемана.
