
- •1.Предмет и задачи химии. Понятие о материи и вещ-ве. Место химии среди естест-ных наук
- •2.Основные понятия в химии: относительная атомная масса химического элемента, отно-сительная молекулярная масса вещества, моль, молярная масса, молярный объем.
- •3. Простые и сложные вещества. Степень окисления атома элемента в соединении. Состав-ление формул бинарных соединений по известным степеням окисления.
- •4. Оксиды: определение, классификация, номенклатура, методы получения, важнейшие химические свойства.
- •Основания: определение, классификация, номенклатура, диссоциация, важнейшие химические свойства. Методы получения.
- •5. Кислоты: определение, классификация, номенклатура, диссоциация, важнейшие хими-ческие свойства. Методы получения.
- •7. Соли: определение, классификация, номенклатура. Диссоциация. Важнейшие свойства. Методы получения кислых, средних (нормальных) и основных солей.
- •10. Элементарные частицы – протоны, нейтроны и электроны.
- •11. Атомные ядра, их строение. Заряд атома. Массовое число. Понятие о химическом эле-менте. Изотопы. Относительная атомная масса химического элемента.
- •14. Периодический закон д.И. Менделеева. Структура периодической системы.
- •15. Связь электронных структур атомов с их положением в периодической системе. Причины периодичности. Валентные электроны для атомов s-, p-, d- и f-элементов.
- •17. Типы химической связи. Ковалентная связь. Метод валентных связей (вс). Механизм образования ковалентной связи (обменный и донорно-акцепторный). Свойства ковалентной связи.
- •18. Ионная связь как предельный случай ковалентной полярной связи, ее особенности.
- •Водородная связь, ее особенности.
- •Виды межмолекулярного взаимодействия.
- •21. Термодинамические системы и их классификация.
- •22. Тепловой эффект химической реакции. Экзо- и эндо-термические реакции. Внутренняя энергия и энтальпия. Их связь с тепловым эффектом реакции.
- •23. Первый закон термодинамики. Закон Гесса. Условия его применения. Теплоты и энталь-пии образования химических соединений. Следствия из закона Гесса.
- •24. Особенности термохимических уравнений. Методы определения тепловых эффектов химических реакций.
- •25. Энтропия как мера вероятности состояния системы. Факторы, определяющие величину энтропии системы. Методы определения энтропии физико-химических процессов. Второй закон термодинамики.
- •29. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Активные молекулы. Энергия активации. Уравнение Аррениуса.
- •Катализ и катализаторы. Гомогенный и гетерогенный катализ.
- •31. Химическое равновесие. Константа равновесия для гомогенных и гетерогенных систем, факторы, от которых она зависит.
- •32. Смещение химического равновесия. Принцип Ле-Шателье.
- •33. Основные положения теории электролитической диссоциации. Степень диссоциации. Сильные и слабые электролиты. Константа диссоциации слабых электролитов. Закон разбавления Оствальда.
- •34. Диссоциация малорастворимых веществ. Произведение растворимости.
- •35. Диссоциация воды. Ионное произведение воды. Водородный показатель (рН).
- •36. Реакции обмена в растворах электролитов. Обратимые и необратимые реакции. Условия смещения равновесия в обратимых реакциях.
- •37. Гидролиз солей. Константа и степень гидролиза. Факторы, влияющие на степень гидролиза.
- •38. Окислительно-восстановительные реакции. Важнейшие окислители и восстановители. Классификация окислительно-восстановительных реакций.
- •39. Методы подбора коэффициентов в окислительно-восстановительных реакциях: метод электронного баланса, ионно-электронный метод. Роль среды в окислительно-восстановительных реакциях.
- •Гальванический элемент. Его устройство и принцип действия. (картинка!)
- •41. Эдс гальванического элемента, ее связь с ∆g процесса. Электродный потенциал, механизм его возникновения, факторы, влияющие на величину электродного потенциала.
- •42. Типы электродов: металлические, газовые, окислительно-восстановительные. Стандартный водородный электрод.
- •43. Методы измерения электродных потенциалов. Стандартные электродные потенциалы. Ряд напряжений. Уравнение Нернста.
- •44. Применение электродных потенциалов для определения возможности протекания окислительно-восстановительных реакций в растворе. ( нет?)
- •45. Понятие об амфотерности. Амфотерные элементы, их оксиды и гидроксиды. Взаимодействие амфотерных элементов и их соединений с кислотами щелочами. (дописать)!
- •46. Коррозия металлов. Виды коррозии. Химическая и электрохимическая коррозии.
-
Гальванический элемент. Его устройство и принцип действия. (картинка!)
Гальванический элемент Даниэля Якоби. ( медно-цинковый ГЭ)
Химические источники тока (хит) – это электрохимические устройства, в основе работы к-ых лежит ОВреакция превращения хим энергии в электрическую. К ним относятся аккумуляторы, топливные элементы, ГЭ.
Э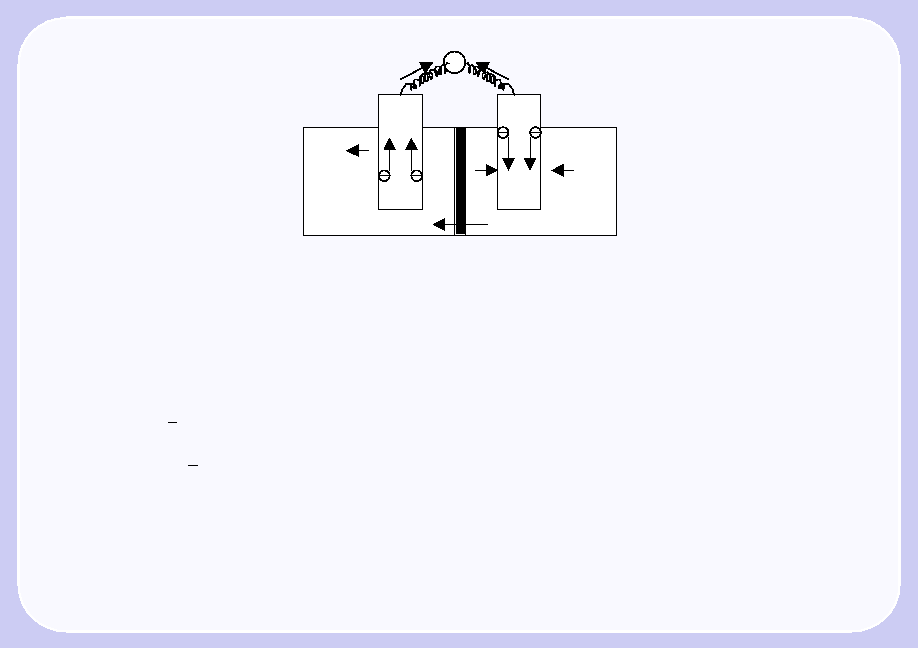 лектрод
– металл, опущенный в р-р или расплав
электролита. На аноде протекает процесс
окисления, на катоде – восстановление.
лектрод
– металл, опущенный в р-р или расплав
электролита. На аноде протекает процесс
окисления, на катоде – восстановление.
ГЭ сотоит из медного электрода, погруженного в р-р соли CuSO4 и цинкового электрода ZnSO4. Сосуды с растворами соединены U-образной трубкой, заполненные раствором электролита (KCl, KNO3, NH4NO3). Электроды соединяют металлическим проводником. На поверхности цинковой пластины + заряженные ионы цинка ориентируют вокруг себя полярные молекулы воды, в рез-те в р-р переходят гидротированные ионы цинка, поверхность металла заряж отриц, а р-р положит. На поверхности цинковой пластниы возникает двойной электрический слой и устанавливается равновесие. В рез-те данного процесса возникает электродный потенциал цинка.
Чтобы переход от А к К был направленным, необходимио пространственно разделять процессы окис-я и вос-я. К: электроны по внешней цепи переходят на медный электрод. Ионы Cu2+ из р-ра переходят к катоду, «снимают» с него электроны и осождаются в виде свободной меди. В рез-те медная пластина заряж +, а р-р -. На поверхности медного электрода возникает двойной электрический слой и устанавливается равновесие, в рез-те данного процесса возникает ЭП меди. Замыкает цепь ГЭ движение ионов в р-ре по U-образной трубке: ионы SO42- движутся к аноду, катионы Cu2+, Zn2+ к катоду. ( Zn + Cu2+ = Zn2+ +Cu – токообразующая реакция)
Схема ГЭ: (-) Zn/ZnSO4//CuSO4/Cu(+)
(/ - граница раздела м-у проводником первого рода(металла) и 2ого рода(р-ром электролита); // - граница раздела м-у проводниками второго рода.
4 основных процесса : 1) окисление цинка; 2) восстановление ионов меди; 3) движение электронов по внешней цепи; 4) движение ионов в р-ре по внутренней цепи.
41. Эдс гальванического элемента, ее связь с ∆g процесса. Электродный потенциал, механизм его возникновения, факторы, влияющие на величину электродного потенциала.
Электрохимический потенциал – это хим реакции, связанные с протеканием эл тока. ( Бывают хим рекции при протекании к-ых возникает эл ток (реакции в гальван эл-ах) и хим реакции, протекающие под воздействием эл тока(электролиз)).
Возникновение электродного потенциала
ЭП возникает при контакте любого металла с любым р-ром электролита.
Металлы имеют кристаллич. строение. В узлах кр решеток располаг ионы металла, нах в равновесии со свободными электронами. При погружении металла в р-р, + заряженные ионы металла притягивают к себе полярные молекулы воды. М-у ними возникает хим связ. Связь м-у ионом и кристаллической реш-ой ослабевает и ион переходит в р-р в виде гидротированного иона. Поверхность металла заряж отриц, а р-р положит. Под действием сил притяжения + заряж ионы из р-ра приятгиваются к отриц поверхности металла. Возникает двойной эл слой.
Разность потенциалов в двойном эл слое назыв электродным потенциалом металла в данном р-ре. ЭП приписывается тот знак., к-ый имеет поверхность металла.
По мере накопления ионов металла в р-ре начин протекать обратный процесс. Ионы металла отрываются от молекул воды и встраиваются в кристаллическую решётку металла.
Процесс обратимый, будет протекать до тех пор, пока не установится состояние хим равновесия. Потенциал, устанавливающийся в условиях равновесия назыв равновесным ЭП.
Me + mH2O = Men+ * mH2O =ne(электрон)
Me + mH2O – ne = Men+*mH2O
Восстанов форма = окисл форма
ЭДС ( электронно движущаяся сила) – максимальная разность потенциалов, к-ая м б получена при работе ГЭ.
![]() ,
A=
n*F*
,
A=
n*F*![]() (F=96500
Кл/моль, n-число
электронов, переход от В к О)
(F=96500
Кл/моль, n-число
электронов, переход от В к О)
![]()
Термодинамическим
условием протекания ОВРреакции в водном
р-ре в прямом направлении явл + знак ЭДС
(ЭДС>0)
![]()
