
- •I курса по профилю подготовки «Биология»
- •Введение
- •Общие правила работы в химической лаборатории.
- •Оформление лабораторной работы и лабораторного журнала
- •Лабораторная работа №1 определение молярной массы эквивалента металла по количеству выделившегося водорода Теоретическая часть.
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №2 взвешивание приготовление растворов. Титрование Теоретическая часть
- •Области перехода окраски некоторых рН-индикаторов
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №3 скорость химических реакций Теоретическая часть
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №4 буферные растворы. Буфетное действие Теоретическая часть
- •Расчет рН буферного раствора
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №5 гидролиз Теоретическая часть
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №6 окислительно-восстановительные реакци Теоретическая часть
- •Выполнение работы
- •Контрольные вопросы
- •Лабораторная работа №7 химия элементов. Сера. Фосфор. Азот Теоретическая часть
- •Выполнение работы
- •Сера. Соединния серы
- •Азот. Соединения азота
- •Фосфор. Соединения фосфора
- •Контрольные вопросы
- •Лабораторная работа №8 химия соединений d – элементов Теоретическая часть
- •Выполнение работы
- •Контрольные вопросы
- •Список рекомендуемой литературы
- •Содержание
Контрольные вопросы
1. Составить перечень химической посуды и химических реактивов, необходимых для выполнения работы.
2. Написать химическое уравнение реакции, протекающей в процессе титрования. К какому типу реакций она принадлежит?
3. Сформулировать закон, лежащий в основе расчетов при определении концентрации растворов щелочи по методу титрования.
4. Рассчитать, какой объем (в мл) 15%-го раствора едкого калия (КОН) следует взять для приготовления 1 л 5%-го раствора.
5. Рассчитать массовую долю, молярную концентрацию, молярную концентрацию эквивалента, моляльную концентрацию и массовую концентрацию раствора данного вещества, используя значение плотности данного раствора и соответствующие величины
|
№ |
Раствор NaCl , г/л |
№ |
Раствор H2SO4 , г/л |
№ |
Раствор HCl , г/л |
№ |
Раствор CH3COOH , г/л |
|
1 |
1010,0 |
6 |
1030,0 |
11 |
1015,0 |
16 |
1006,0 |
|
2 |
1050,0 |
7 |
1050,0 |
12 |
1035,0 |
17 |
1010,0 |
|
3 |
1080,0 |
8 |
1090,0 |
13 |
1055,0 |
18 |
1018,0 |
|
4 |
1120,0 |
9 |
1190,0 |
14 |
1080,0 |
19 |
1025,0 |
|
5 |
1170,0 |
10 |
1250,0 |
15 |
1125,0 |
20 |
1032,0 |
Лабораторная работа №3 скорость химических реакций Теоретическая часть
Скоростью реакции называется изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, происходящее за единицу времени.
Скорость химических реакций зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализаторов.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. В общем случае для реакции
nA + mB = pАВ
зависимость скорости реакции выражается уравнением:
υ = k CАnCВm
где CА и CВ - концентрации реагирующих веществ; k - константа скорости реакции. Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза:
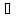 2
2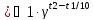
где υ 2 и υ 1 - скорости реакций при температурах t2 и t1; γ - температурный коэффициент скорости реакции.
Катализом называют процесс изменения скорости реакции, происходящий под действием небольших количеств веществ – катализаторов, которые учувствуют в процессе и к концу реакции остаются химически неизменными.
Катализатор – вещество, изменяющее скорость реакции вследствие многократного участия в промежуточном химическом взаимодействии с реагентами реакции, но после каждого цикла промежуточного взаимодействия восстанавливает свой химический состав.
Положительные катализаторы ускоряют реакцию, отрицательные катализаторы, или ингибиторы, ее замедляют. Каталитические процессы по фазовому состоянию делят на гомогенные и гетерогенные.
Выполнение работы
Цель работы: изучение влияния степени измельчения, концентрации реагирующих веществ, температуры и катализатора на скорость химических реакций.
Меры предосторожности при выполнении работы
1. Заполнение колб и бюреток производить только через воронки.
2. Для нагревания растворов реагирующих веществ применять только термостойкую посуду.
3. Упаривание реагирующих веществ или выпаривание досуха производить только под тягой.
3. Нагретые предметы брать и переносить с места на место только при помощи тигельных щипов.
ОПЫТ 1. ВЛИЯНИЕ КОНЦЕНТРАЦИИ ИОНОВ ЖЕЛЕЗА (III) И ЙОДИД-ИОНОВ НА СКОРОСТЬ РЕАКЦИИ ОКИСЛЕНИЯ ИОДИД-ИОНОВ ИОНАМИ ЖЕЛЕЗА (III)
В каждую из четырех конических колб емкостью 250 мл прилить из бюретки по 20 мл раствора хлорида железа (FeCl3), после чего во вторую, третью и четвертую колбы добавить соответственно 20, 40, 60 мл воды. После этого в первую колбу мерным цилиндром добавить 20 мл раствора иодида калия (KJ) и полученную смесь выдержать в течение 10 минут. После выдерживания раствор оттитровать раствором тиосульфата натрия (Na2S2O3) следующим образом: из бюретки, заполненной стандартным раствором тиосульфата натрия (Na2S2O3), по каплям, при постоянном перемешивании, приливают последний к анализируемому раствору, находящемуся в конической колбе. В момент, когда содержимое колбы после очередной капли тиосульфата натрия (Na2S2O3) приобретет соломенно-желтое окрашивание, следует добавить 3-4 капли свежеприготовленного раствора крахмала. Тщательно перемешать; после чего анализируемый раствор приобретает голубовато-синюю окраску. Заканчивают титрование, прибавляя стандартный раствор по каплям, медленно, тщательно перемешивая после каждой капли до полного обесцвечивания содержимого колбы. Объем тиосульфата, израсходованный на титрование, определяют по нижнему мениску раствора в бюретке, показания заносят в таблицу.
|
№ опыта |
Температура анализируемого раствора, 0С |
Объем FeCl3, мл |
Объем Н2О, мл |
Объем KJ, мл |
Объем Na2S2O3, мл |
|
1 |
|
20 |
0 |
20 |
|
|
2 |
|
20 |
20 |
20 |
|
|
3 |
|
20 |
40 |
20 |
|
|
4 |
|
20 |
60 |
20 |
|
Затем во вторую коническую колбу прилить 20 мл раствора иодида калия (KJ) и все последующие операции выполнять аналогично операциям, выполненным в предыдущем опыте.
Аналогично проанализировать третью и четвертую колбы.
Результаты, полученные при анализе содержимого всех колб, занести в таблицу. По полученным данным построить график зависимости скорости реакции от концентрации иодид-ионов (J-) и концентрации железа c (Fe3+). Под скоростью реакции понимают объем тиосульфата натрия (Na2S2O3), израсходованный на титрование.
ОПЫТ 2. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
В две пробирки прилить соответственно по 20 мл раствора хлорида железа (III) (FeCl3). В две другие пробирки - по 20 мл раствора иодида калия (KJ); еще одну пару пробирок заполнить водой по 20 мл. Затем соединить пробирки: пробирка с раствором хлорида железа (III) (FeCl3), пробирка с водой, пробирка с раствором иодида калия (KJ) и полученную серию из трех пробирок поставить на 5-10 минут в стакан с водой для термостатирования при температуре, на 20-30 ºС выше комнатной. После термостатирования содержимое всех трех пробирок слить в коническую колбу для титрования и выдержать в термостате в течение 5-10 минут и оттитровать по методике, описанной в опыте 1.
Затем понизить температуру в термостате на 10-15 º путем прибавления холодной воды и повторить опыт со второй парой пробирок. Полученные результаты занести в таблицу 1. По полученным данным построить график зависимости скорости реакции от температуры и определить температурный коэффициент скорости рассматриваемой реакции.
ОПЫТ 3. ВЛИЯНИЕ СТЕПЕНИ ИЗМЕЛЬЧЕНИЯ РЕАГИРУЮЩИХ ТВЕРДЫХ ЧАСТИЦ НА СКОРОСТЬ РЕАКЦИИ
а) В сухой пробирке осторожно смешать несколько кристалликов нитрата свинца (II) (Pb(NO3)2) и иодида калия (KJ), которые должны быть предварительно тщательно высушены. Происходит ли изменение окраски смеси? Эту же смесь перенести в сухую фарфоровую ступку и тщательно растереть. Что наблюдается? Добавить к растертой смеси в ступке несколько капель воды, что наблюдается? Написать уравнения реакции.
б) Уравновесить на весах маленький кусочек мрамора (около 2г) и мрамор в виде порошка. В две пробирки налить одинаковые объемы (примерно, 1/3 пробирки) раствора соляной кислоты (c(HCl)=1 моль/л). Затем одновременно опустить в пробирки: в одну – кусочек мрамора, в другую – порошок. В которой из пробирок наблюдается более быстрое выделение пузырьков газа? Написать уравнение реакции. Указать, какой газ выделяется. На основании результатов выполненных опытов сделать вывод о влиянии степени измельчения реагирующих веществ на скорость реакции. Чем это объясняется?
ОПЫТ 4. ВЛИЯНИЕ КАТАЛИЗАТОРА НА СКОРОСТЬ РЕАКЦИИ. ГОМОГЕННЫЙ КАТАЛИЗ
Налить в колбу емкостью 50 мл 0,5 мл раствора перманганата калия (KMnO4) с молярной концентрацией эквивалента 0,1 моль/л и 15 мл раствора серной кислоты (H2SO4) с молярной концентрацией эквивалента 2 моль/л. Полученный раствор разлить поровну в две пробирки. Затем в одну из пробирок добавить немного соли нитрата калия (KNO3) (на кончике шпателя) и встряхнуть пробирку для быстрого растворения соли. Затем в обе пробирки добавить по два кусочка гранулированного цинка (Zn). Что наблюдается в обеих пробирках? Описать, написать уравнения взаимодействия металлического цинка с серной кислотой.
Чем объяснить обесцвечивание раствора в пробирке, не содержащей нитрата калия (KNO3)? Написать уравнение реакции, какова роль нитрата калия во второй пробирке? Написать механизм каталитического действия нитрата калия (KNO3) в приведенных условиях. Чем объяснить обесцвечивание раствора во второй пробирке? Написать уравнение реакции. В какой из пробирок обесцвечивание раствора происходит быстрее? Почему?
