
- •1. Основные понятия и показатели химической технологии
- •2. Безопасность химических производств и защита окружающей среды
- •4. Классификация моделей хтс
- •5. Сырьевая база химических производств
- •6.Вода как сырье и компонент химического производства
- •Схемы водооборота
- •7. Энергетическая база химических производств
- •8. Термодинамика химико-технологических процессов
- •9. Кинетика химико-технологических процессов
- •1. Температура
- •1. Коэффициент скорости процесса
- •Зависимость V от т:
- •11. Катализ в химической промышленности
- •12.Основные типы химических реакторов
- •13. Основы теории подобия
- •14. Основные закономерности гидравлики
- •15. Общие сведения о насосах и компрессорных машинах
- •16. Псевдоожиженный слой зернистых материалов
- •17. Характеристика гетерогенных систем и методы их разделения
- •1. Осаждение
- •2. Фильтрование
- •18. Характеристика процесса перемешивания материалов
- •19. Тепловые процессы в химической технологии
- •20. Технологические способы нагревания и охлаждения
- •21. Характеристика процесса выпаривания
- •22. Массообменные процессы в химической технологии
- •23. Перегонка жидкостей
- •24. Абсорбция и адсорбция
- •25. Материалы как важная категория продуктов химической технологии
- •26. Производство серной кислоты
- •28. Производство азотной кислоты и нитрата аммония
- •30. Производство фосфорных и комплексных удобрений
- •35. Переработка нефти и нефтепродуктов
8. Термодинамика химико-технологических процессов
Под химическим процессом в реакторе понимают химическую реакцию или совокупность нескольких реакций и сопутствующие ей явления массо- и теплопереноса. Условно в химическом реакторе можно выделить три зоны в каждой из которых протекают процессы, подчиняющиеся разным закономерностям:
1) зона подвода реагирующих веществ в зону химических реакций,
2) зону химических реакций
3) зону отвода продуктов из зоны химических
реакций.
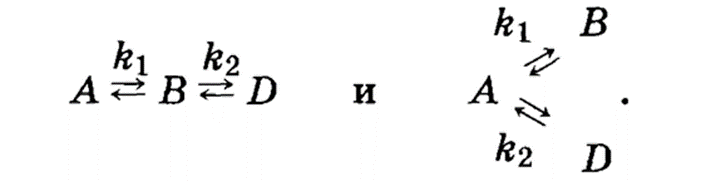
Химическая реакция характеризуется скоростью(кинетический фактор) исостоянием равновесия в системе(термодинамический фактор)
Факторы, влияющие на состояние равновесия
Степень приближения системы к состоянию устойчивого равновесия характеризуется изменением изобарно-изотермического потенциала
(ΔG) иравновесной степенью превращения (X*). Степень приближения системы к состоянию устойчивого равновесия характеризуется изменением изобарно-изотермического потенциала
(ΔG) и равновесной степенью
превращения (X*)ΔG < 0 –
наиболее вероятное течение реакции
слева направо,![]()
![]()
ΔG > 0 – наиболее вероятное течение
реакции справа налево![]()
ΔG= 0 –существует равновесие
∆H- тепловой эффект реакции, ∆S –изменение энтропии при реакции
Чем более экзотермична реакция, тем
более она вероятна ![]()
![]()
Рассмотрим простую обратимую реакцию:
![]()
k1 иk1 –
константы скоростей прямой и обратной
реакций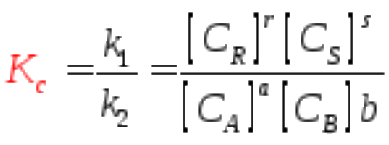
В условиях равновесия скорости:
где Кс – константа равновесия.
Если реакция газофазная, то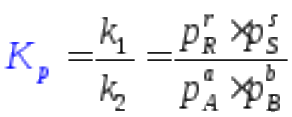
где PR,PS,PA,PB–
парциальные давления продуктов и
реагентов.![]()
![]()
∆ N- изменение числа молей
в ходе реакции.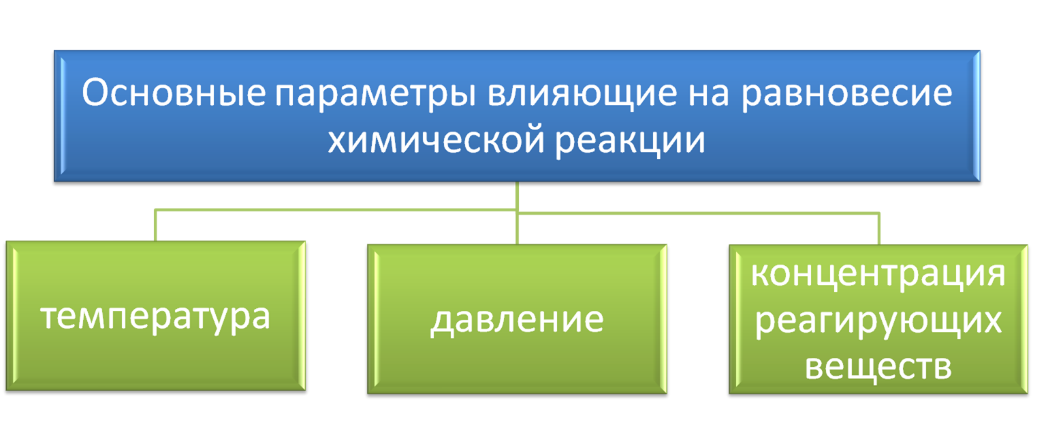
Принципом Ле-Шателье (2 закон термодинамики): если на систему, находящуюся в равновесии, воздействовать извне путем изменения какого-либо условия, определяющего положение равновесия, то в этой системе усилится такой процесс, течение которого ослабляет влияние произведенного воздействия. При этом положение равновесия сместится в соответствующем направлении.
сдвиг равновесия под влиянием температуры
Рассмотрим две реакции:![]()
экзотермическую
эндотермическую ![]()
![]()
Обычно устанавливают зависимость: 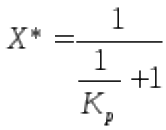
Для реакции A↔R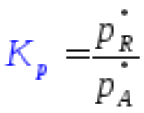
![]()
где p*– парциальные
давления продуктов и реагентов.![]()
A↔2Rp
– общее давление.Равновесная
степень превращения Х*
зависит от константы равновесия.
![]()
Влияние температуры на равновесие, т.е. функциональная зависимость
Кр
= f(Т),
отражается уравнением
изобары Вант-Гоффа:![]()
Т.к.
Кр = f(Т), то и
равновесная степень превращенияX*
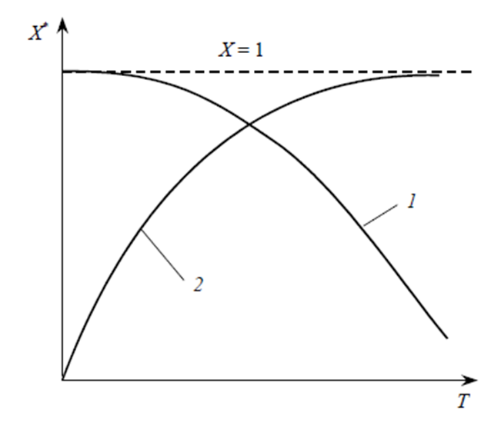
зависит от температуры.Зависимость
равновесной степени превращения Х*
от температуры Т:1 – для
экзотермической реакции;2 – для
эндотермической реакции ![]()
при повышении температуры равновесие смещается в сторону получения:
целевых продуктов (→) для реакций A↔R-Q (ΔН>0);
исходных реагентов (←) для реакцийA ↔ R + Q (ΔН<0);
Сдвиг
равновесия под влиянием давления![]()
—
объем газообразной системы уменьшается
(ΔV< 0) N2
+ 3H2 ↔
2NH3 (a)![]()
— объем газообразной системы увеличивается (ΔV>0), СН4 ↔ С + 2Н2 (б)
— объем газообразной системы не изменяется СО + Н2О↔H2 + СО2 (в)
при повышении давления равновесие смещается в сторону получения:
целевых продуктов (→) при ΔN < 0 (при уменьшенииV);
исходных продуктов (←) при ΔN > 0 (при увеличенииV);
не изменяется (↔) при ΔN = 0 (приV = const).
Сдвиг
равновесия под влиянием концентрации
реагирующих веществ
СО
+ Н2О↔H2 + СО2
где р* – парциальные давления
реагентов и продуктов 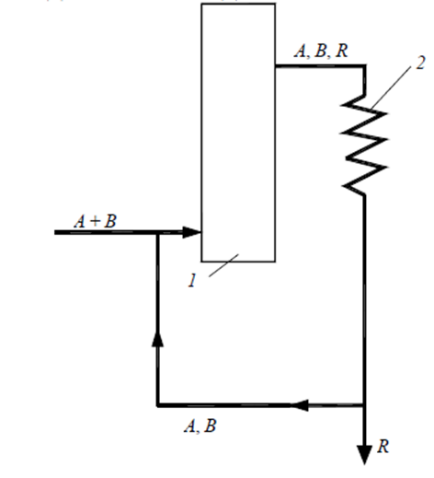
Равновесная степень превращения и, следовательно, равновесное парциальное давление водорода возрастает с увеличением парциального давления паров воды и понижением парциального давления диоксида углерода
Пример, N2+ 3Н2↔ 2NH3+Q (А + В↔R + S)
циркуляционная схема химико-технологического процесса с выводом продукта реакции: 1 – реактор;2 – конденсатор
