
- •Вопрос 1.
- •Дополнительная информация
- •Особенности метаболизма почек.
- •Механизм образования мочи.
- •Моча. Физиологические составные части мочи.
- •Неорганические составные части мочи.
- •Органические составные части мочи.
- •Патологические составные части мочи.
- •Камни в почках.
- •Гомеостатическая функция печени. Клеточный состав, функциональная и метаболическая гетерогенность гепатоцитов (перипортальные и перицентральные клетки).
- •Гомеостаз гормонов. Функциональные пробы печени в связи с ее ролью в обмене.
- •Метаболизм ксенобиотиков основные этапы (поступление, транспорт, детоксикация, конъюгация, выведение).
- •Особенности структуры и функции основных элементов нс – нейрона и нейроглии
- •Понятие о гемато-энцефалическом барьере
- •Особенности обмена углеводов
- •Особенности обмена липидов
- •Метаболические основы электрогенеза. Метаболизм медиаторов в норме и при патологии. Роль антиоксидантов, антигипоксантов, протекторов мембран.
- •Биохимические основы некоторых нервно-психических заболеваний
- •Биохимические механизмы повреждения мозга в результате инсульта
- •Депонирование амилоидного -протеина имеет отношение к патогенезу болезни Альцгеймера
- •Основные функции мышечной ткани (локомоторная, регуляторная и метаболическая). Особенности метаболизма мышечной ткани.
- •Гипокинетический синдром, основы патогенеза
- •Автономность мышечной ткани (запас субстратов, кислорода, макроэргов, набор ферментов, стабилизирующих атф. Субстраты метаболизма
- •Цикл пуриновых нуклеотидов
- •Пути утилизации атф в мышце
- •Характеристика и роль специфических белков мышечной ткани TnC, TnI, TnT, тропомиозина, актомиозина.
- •Механизм электромеханического сопряжения (теория мышечного сокращения).
- •Мышечное расслаблениеМеханизм расслабления. Роль атф-аз, атф.
- •Тетания и трупное окоченение. Ригорный комплекс
- •Гладкие мышцы
- •Метаболизм белков и аминокислот в мышцах
- •Биохимические основы развития сердечной недостаточности (сн)
- •Вопрос 1. Излагается содержание.
- •Вопрос 2. И т.Д.
Депонирование амилоидного -протеина имеет отношение к патогенезу болезни Альцгеймера
Болезнь Альцгеймера относится к неизлечимым нейропсихическим заболеваниям, при которых наряду с нарушением поведенческих реакций наблюдается расстройство функций сознания. Встречается оно довольно часто и является наиболее известной причиной деменции - прогрессирующего угасания интеллектуальных функций, которая приводит к потере способности себя обслуживать. Только в США ею страдает около 2 миллионов людей. Причем, в развитых странах частота его увеличивается, поскольку она напрямую связана с увеличением продолжительности жизни. В большинстве случаев болезнь Альцгеймера не имеет генетической зависимости. Обычно она развивается в возрасте старше 65 лет, хотя может встречаться и раньше, и длится от 2 до 20 лет. Первым симптомом является потеря памяти. Заболевание неумолимо прогрессирует и заканчивается полнейшей беспомощностью.
Основным патоморфологическим признаком является дегенеративный процесс, характеризующийся потерей клеток в некоторых участках мозга (в частности, в корковом слое и гиппокампе). Многочисленные исследования направлены на выяснение причин болезни Альцгеймера. Внимание ученых привлек амилоидный -протеин (АП), основной компонент амилоидных бляшек, чрезвычайно характерных для этого заболевания. Термин "амилоидный" относится к широкой группе внеклеточных скоплений белка, обнаруженных при многих заболеваниях. Амилоидные белки, подобно крахмалу, обычно окрашиваются йодом в синий цвет, за что и получили своё название. Согласно одной гипотезе (амилоидного каскада) накопление АП вызывает патологические изменения в мозге людей с болезнью Альцгеймера. Другие изменения, наблюдающиеся при этом заболевании, такие как нейрофибриллярные клубки и изменения сосудов, являются вторичными. АП образуется из своего предшественника, названного "предшественником амилоидного белка" (ПАБ). Ген белка-предшественника локализован в 21 хромосоме, близко к месту, изменяющемуся при синдроме Дауна (трисомия 21). Наверно, поэтому больные синдромом Дауна, которые дожили до 50 летнего возраста, часто поражаются болезнью Альцгеймера.
ПАБ - это трансмембранный белок, состоящий из 770 аминокислотных остатков. АП - пептид, состоящий из 39-42 аминокислот, который отщепляется в результате протеолиза от С-конца ПАБ. Он то и образует нерастворимое внеклеточное скопление. Расщепление ПАБ могут катализировать две различные протеазы. В результате действия одной из них, получившей название секретаза, образуется растворимый фрагмент, содержащий в своем составе только часть АП (рис.18.12). Вторая является лизосомальной протеазой, в результате её действия образуется фрагмент, содержащий полную последовательность АП. Предполагается, что именно этот фрагмент накапливается во внеклеточном пространстве и приводит к формированию гистопатологических признаков, присущих болезни Альцгеймера.
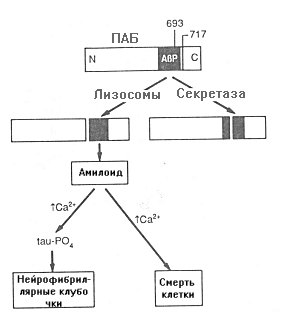
Рис.18.12. Гипотеза амилоидного каскада
ПАБ может подвергаться превращению двумя путями. Первый включает секретазу, действие которой приводит к образованию пептидов, которые не содержат полную аминокислотную последовательность амилоидного -протеина (АР). Эти пептиды раствориы в воде и не осаждаются с образованием амилоида. В соответствии со вторым путем действие эндосомальных-лизосомальных протеаз(ы) приводит к образованию амилоидного-белка или пептидов, содержащих его полную аминокислотную последовательность в своем составе. Такие пептиды выпадают в осадок с образованием амилоида. Предполагается, что это приводит к формированию нейрофибриллярных клубочков и смерти клетки.
В некоторых случаях болезни Альцгеймера, особенно с ранним началом заболевания, были обнаружены мутации на С-конце ПАБ. Белковые фрагменты, которые образовываются в результате таких мутаций, содержат в своем составе АП. Однако роль этих фрагментов до настоящего времени неясна.
Второй часть гипотезы амилоидного каскада в развитии болезни Альцгеймера основывается на том, что АП и фрагменты, содержащие этот белок, прямо или косвенно являются нейротоксичными веществами. Замечено, что в нейронах в присутствии АП может увеличиваться внутриклеточная концентрация Са2+. Уровень же Са2+способен оказывать регуляторное влияние на активность некоторых протеинкиназ, которые катализируют фосфорилирование tau-белка. Таким образом, повышение уровня Са2+может привести к гиперфосфорилированию tau и образованию спаренных спирализованных нитей, характерных для нейрофибриллярных клубочков. На рис.18.13 показана предполагаемая последовательность событий в некоторых случаях развития болезни Альцгеймера.

Рис.18.13. Гипотетическая схема последовательности событий, вовлекаемых в развитие некоторых случаев болезни Альцгеймера
Мутации гена ПАБ обнаружены только в небольшом количестве случаев этого заболевания, поэтому равновероятно существование и других патогенетических механизмов.
Гипотеза зачастую хороша не тем, что она правильная, а тем, что она стимулирует дальнейшие исследования. В частности, ключевым моментом, требующим в дальнейшем выяснения, является ответ на вопрос, первично ли накопление АП в развитии болезни Альцгеймера или это вторичное событие, которое развивается вследствие неизвестных ещё более ранних явлений? Существуют и другие гипотезы происхождения этого заболевания, которые представляются менее вероятными на сегодняшний день. Так, было замечено, что в составе бляшек при болезни Альцгеймера часто содержится повышенное количество алюминия. Это позволило предположить, что одной из причин заболевания является увеличенное поступление его в организм с пищей. Одновременно возник вопрос, в действительности ли увеличенное отложение алюминия в бляшках вызывает болезнь Альцгеймера или уже поврежденные каким-то другим процессом клетки приобретают способность усиленно поглощать алюминий? Ответа на этот вопрос на сегодняшний день нет. С другой стороны, в ткани мозга людей, умерших от болезни Альцгеймера, часто обнаруживается существенное снижение ацетилхолина и других нейромедиаторов, однако эти изменения представляются вторичными, возникшими вследствие повреждения клеток при этом заболевании.
С раскрытием механизмов развития болезни Альцгеймера связывают разработку эффективных тестов его диагностики и лечения. К примеру, большое значение могли бы иметь соединения, которые бы ингибировали образование АП или делали бы его растворимым в воде. В настоящее время точный дигноз болезни Альцгеймера чаще ставится на аутопсии при обнаружении характерных бляшек. Перспективной представляется разработка теста, основанного на определении количества ПАБ в цереброспинальной жидкости (ЦСЖ) с помощью специфических моноклональных антител. Считают, что в ЦСЖ людей, страдающих этим заболеванием, его уровень существенно (~ в 3 раза) ниже, чем у здоровых людей. В настоящее время нет специфической лекарственной терапии болезни Альцгеймера, хотя все более и более реальной становится возможность с помощью препаратов влиять на накопление АП в тканях. Такой перспективой, в частности, обладает выделенный из мозга фактор роста нервов. В некоторых областях мозга больных его количество снижено. Сейчас изучается терапевтический эффект от его использования у экспериментальных животных, у которых хирургическим путем была вызвана нейрональная дегенерация.
В происхождении шизофрении могут участвовать генетические и дофаминергические факторы, а также факторы, определяющие рост и развитие нервов
Шизофренические расстройства относятся к умственным расстройствам. Для них характерна психотическая симптоматика, отражающая изменения со стороны мышления, чувств и поведения. Важно различать "позитивные симптомы" (галлюцинации, мании, эксцентричное поведение) и "негативные симптомы" (социальный уход, эмоциональное притупление и др.). Существует большое количество подтипов или форм этого заболевания, в частности, дисорганизованная (гебефреническая), кататоническая, параноидная. Для простоты мы будем пользоваться термином шизофрения, имея ввиду, что это группа расстройств. Шизофрения распространена по всему миру. Ею болеют, в среднем 1%, населения. Заболевание возникает обычно в возрасте до 45 лет, зачастую, в подростковом возрасте, после чего приобретает хроническое течение.
Причина или причины шизофрении на сегодняшний день неизвестны, хотя многочисленные исследования были посвящены выяснению роли психологических, социальных, средовых, анатомических, генетических, биохимических и других факторов. В этом подразделе мы проанализируем, почему так трудно обнаружить генетическую основу для шизофрении, специфические структурные нарушения в мозге людей, страдающих этим заболеванием, а также рассмотрим дофаминергическую теорию его развития.
Генетическая основа
Проведенные генетические исследования показали большое значение генетического фактора в происхождении шизофрении. К примеру, вероятность развития шизофрении у ребенка, у которого оба родителя имеют это заболевание, составляет 39%. Среди монозиготных близнецов заболеваемость шизофренией совпадает в 47% случаев. Однако неизвестно, является ли шизофрения моногенным, полигенным или многофакторным состоянием.
Поиск генов, ответственных за развитие этого заболевания, привел к противоречивым результатам. Сначала было обнаружено, что соответствующий локус находится на 5 хромосоме. Однако эти данные не нашли подтверждения в последующих исследованиях, и вопрос остается открытым. Его решение зависит от отбора и скрупулезного анализа большого количества генов-кандидатов (таких, как гены для дофаминовых рецепторов или для ферментов, вовлеченных в обмен катехоламинов) и поиска мутаций, которые могут иметь значение в происхождении этого расстройства.
Структурные изменения в мозге больных шизофренией
В мозге многих больных шизофренией обнаруживаются изменения в медиальной лобной доле (парагиппокампальная извилина, гиппокамп и миндалина). Эти зоны участвуют в сборе и обработке информации из коры. К примеру, наблюдаемые изменения ориентация пирамидальных клеток гиппокампа могут отражать дефект нейрональной миграции. С другой стороны, эти изменения могут оказывать влияние вторичное действие на различные нейрохимические параметры в клетке. У больных шизофренией часто увеличены желудочки в мозге, однако разница по сравнению с нормой не всегда столь значительна, что бы использовать этот признак для диагностики.
Дофаминовая гипотеза происхождения шизофрении
В различные периоды времени возникали биохимические теории, в соответствии с которыми в возникновении шизофрении участвовали ацетилхолин, -аминомасляная кислота (ГАМК), норадреналин, опиаты, пептиды и другие молекулы. Однако в последние 30 лет наибольшее внимание приковано к дофамину. В начале 50-х годов, сразу после успешного начала использования неролептиков (антипсихотиков) для лечения психозов, в том числе шизофрении, было замечено, что у шизофреников в ходе такой терапии развивается паркинсонизм. Подобные наблюдения навели на мысль о том, что нейролептики снижают уровень дофамина в организме. Эти и другие факты подтверждали участие дофамина в развитии шизофрении (табл. 18.10). В соответствии с гипотезой происхождения шизофрении эту патологию рассматривают как проявление гипердофаминергии. Противоположно, болезнь Паркинсона может рассматриваться как состояние гиподофаминергии.
Таблица 18.10.Аргументы в пользу дофаминергической гипотезы происхождения шизофрении
|
Нейролептики (антипсихотики) часто вызывают паркинсонизм, что привело к заключению об их способности снижать уровень дофамина. |
|
Действие нейролептиков направлено на снижение биологической активности дофамина в мезолимбических дофаминовых нейронах |
|
Другие лекарственные препараты (в частности, L-ДОФА, амфетамин), которые оказывают дофамин-миметическое действие на его метаболизм, вызывают симптомы шизофрении. |
|
Длительное лечение нейролептиками приводит к снижению уровня гомованилиновой кислоты в цереброспинальной жидкости и улучшению клинического состояния больных |
|
Выраженность антипсихотического действия большинства нейролептиков коррелирует с их связыванием с D2 рецепторами. |
|
При анализе трупного материала и результатов позитронной томографии отмечено, что в мозге больных шизофренией увеличена плотность D2 рецепторов |
|
|
Результаты биохимических исследований относительно выяснения роли дофамина в патогенезе шизофрении можно разделить на три группы. (1) Определение количества дофамина в ткани мозга. Большинство исследователей обнаружили его увеличение, хотя полученные ими данные значительно варьировали. (2) Определение метаболитов дофамина в ткани мозга и биологических жидкостях. Особое внимание было уделено гомованилиновой кислоте как наиболее важному метаболиту у человека. У больных шизофренией её уровень оказался существенно повышенным, он снижался в ходе лекарственной терапии. Однако данные опять значительно варьировали. (3) Определение дофаминовых (D) рецепторов. Количество D2 рецепторов увеличено в мозге при шизофрении. Важным обстоятельством явилось установление зависимости между выраженностью антипсихотического действия нейролептиков и их способностью конкурировать in vitro с дофамином за связывание с D2 рецепторами.
Получив такие данные, неудивительно, что усилия исследователей сосредоточились на дофаминовых рецепторах. Благодаря технологии клонирования генов, удалось обнаружить их 5 различных классов (табл.18.11). Все они являются трансмембранными белками - гликопротеинами, сопряженными с G-белками. РецепторыD2,D3 иD4 очень похожи между собой. Известно, что нетипичный нейролептик клозапин (он не вызывает паркинсонизма как другие нейролептики) в 10 раз активнее связывается с рецепторами D4, чем - с D2.
Таблица 18.11. Некоторые свойства дофаминовых рецепторов
|
Различают, по меньшей мере, 5 различных классов (D1 - D5) рецепторов |
|
Это мембранные белки, часть из которых гликозилирована |
|
Большинство имеет в своем составе 7 трансмембранных доменов с петлями в цитозоле |
|
Большинство сопряжено с G-белками |
|
Действие одних опосредовано активацией аденилатциклазы (D1), действие других - её ингибированием (D2) |
|
Действие одного из подтипов D1 сопряжено с активацией фосфолипазы С |
|
Регуляция, по крайней мере, некоторых из них осуществляется путем фосфорилирования |
|
Конформационное соответствие большинства нейролептиков D2-рецептору отражает выраженность их терапевтического действия при шизофрении |
|
Различные рецепторы имеют разное анатомическое распределение |
|
Атипичный нейролептик клозапин связывается с рецептором D4 в 10 раз сильнее, чем - с D2 |
Все эти данные позволили несколько изменить первоначальную гипотезу. В настоящее время полагают, что для шизофрении характерно нарушение дофаминергической активности, которое не всегда сводится к её увеличению. В некоторых областях мозга дофаминергическая активность действительно может быть повышена, тогда как в других она в это же время снижена. Следует иметь в виду, что в развитии шизофрении могут принимать участие и другие нейромедиаторы, например, серотонин, самостоятельно или путем взаимодействия с дофаминергическими системами.
Доцент кафедры биологической химии, Коваль А. Н. ___________
19.10.2006
Министерство здравоохранения Республики Беларусь
УО «Гомельский государственный медицинский университет»
Кафедра биологической химии
Обсуждено на заседании кафедры (МК или ЦУНМС)
Протокол № _________________200__года
ЛЕКЦИЯ по биологической химии
наименование дисциплины
для студентов _2__ курсалечебногофакультета
Тема Биохимия мышечной ткани
Время 90 мин.
Учебные и воспитательные цели:
Дать понимание следующих предметов:
Основные функции и особенности метаболизма мышечной ткани.. Автономность мышечной ткани.
Механизм электромеханического сопряжения (теория мышечного сокращения). Роль ионов Ca, протеинкиназ. Характеристика и роль специфических белков мышечной ткани TnC,TnI,TnT, тропомиозина, актомиозина. Механизм расслабления. Роль АТФ-аз, АТФ. Ригорный комплекс.
Особенности метаболизма миокарда. Основные причины и механизм развития сердечной недостаточности. Обоснование биохимической коррекции сердечной недостаточности.
Гипокинетический синдром, основы патогенеза.
ЛИТЕРАТУРА
Основная
Материал лекций.
Березов Т. Т., Коровкин Б. Ф. Биологическая химия. М.: Медицина, 1990. С. 504–517; 1998. С. 645–660.
Николаев А. Я. Биологическая химия. М.: Высшая школа, 1989. С. 448–460. 2004. С. 518–530.
Дополнительная
Бэгшоу К. Мышечное сокращение. М.: Мир, 1985.
Марри Р. и др. Биохимия человека. М.: Мир, 1993. Т. 2. С. 332–351.
Уайт А. и др. Основы биохимии. М.: Мир, 1981. Т. 3. С. 1400–1424.
Албертс Б. и др. Молекулярная биология клетки. М.: Мир, 1994. Т. 2. С. 254–274.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ
1. Мультимедийная презентация
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
|
№ п/п |
Перечень учебных вопросов |
Количество выделяемого времени в минутах |
|
|
Основные функции мышечной ткани (локомоторная, регуляторная и метаболическая). Гипокинетический синдром, основы патогенеза. |
30 |
|
|
Особенности метаболизма мышечной ткани. Типы мышечных волокон, их характеристика (белые, красные, смешанные). Автономность мышечной ткани (запас субстратов, кислорода, макроэргов, набор ферментов, стабилизирующих АТФ. |
|
|
|
Механизм электромеханического сопряжения (теория мышечного сокращения). Роль ионов Ca, протеинкиназ. Характеристика и роль специфических белков мышечной ткани TnC,TnI,TnT, тропомиозина, актомиозина. Механизм расслабления. Роль АТФ-аз, АТФ. Ригорный комплекс. |
30 |
|
|
Особенности метаболизма миокарда (кислородная зависимость, аэробный тип обмена, ЛДГ1, ЛДГ2и т.д.). Основные причины и механизм развития сердечной недостаточности (низкоэнергетическое состояние, увеличение кальция и т.д.). Обоснование биохимической коррекции сердечной недостаточности. |
20 |
Всего 90 мин
